SYBR Green II荧光定量PCR结合熔解曲线鉴别不同亚型兔病毒性出血症病毒方法的建立
谭永贵,刘 腾,朱 杰,郭慧敏,吴巧梅,李 琦,缪秋红,陈宗艳,李传峰,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
SYBR Green II荧光定量PCR结合熔解曲线鉴别不同亚型兔病毒性出血症病毒方法的建立
谭永贵,刘 腾,朱 杰,郭慧敏,吴巧梅,李 琦,缪秋红,陈宗艳,李传峰,刘光清
本研究建立了一种荧光定量PCR(Real-time fluorescence quantitative PCR)结合熔解曲线区分不同亚型兔病毒性出血症病毒(Rabbit hemorrhagic disease virus,RHDV)方法。根据GenBank数据库中已公布的不同亚型RHDV(经典RHDV和RHDV2)的衣壳蛋白VP60序列保守区设计了1对特异性引物,利用SYBR Green II荧光染料,在实时荧光定量PCR方法的基础上结合熔解曲线进行分析,经典RHDV和RHDV2熔解温度(Tm)分别为(86.3±0.1)℃和(85.1±0.1)℃,扩增产物的熔解曲线分析均只出现单特异峰。结果表明,本研究建立的方法能够快速地鉴别经典RHDV和RHDV2。
兔病毒性出血症病毒;荧光定量PCR;熔解曲线;鉴别
(中国农业科学院上海兽医研究所,上海 200241)
兔病毒性出血症病毒(Rabbit hemorrhagic disease virus,RHDV)为单股正链RNA病毒,属于杯状病毒科(Caliciviridae)、兔病毒属(Lagovirus)。RHDV可引发兔发生急性、败血性传染病,发病率达100%,病死率可达90%以上,是兔的一种毁灭性传染病,俗称“兔瘟”。1984年,兔瘟第一次在中国江苏省大规模爆发,病兔呈现肝脏坏死,实质脏器水肿,呼吸系统弥散性出血等典型病变[1]。2010年法国发生一起非典型的兔瘟疫情,家兔发病的潜伏期较经典兔瘟久,死亡率低,但是死亡的家兔与经典兔瘟相似,很难区分。该病自从第一次爆发后迅速传播,在不到4年的时间里,已经传遍欧洲大陆,包括西班牙、英格兰、德国、意大利等国家[2-8],甚至在离欧洲1000 km以外的亚速尔群岛也检测到新型RHDV的存在[9]。
新型兔出血症病毒(RHDV2)同经典RHDV以及其他杯状病毒科病毒有着相似的基因组结构,5'-末端无帽子结构,3'-末端为多聚腺苷酸Poly(A)尾。其VP60基因序列与RHDV VP100基因序列相同率为85%,通过普通的RT-PCR很难区分[10]。普通ELISA一般是以表达的衣壳蛋白为包被抗原来检测疑似感染兔子血清,而RHDV和RHDV2的衣壳蛋白有交叉的抗原决定簇,能够相互识别对方阳性血清,故不能区分两种病原。
本研究通过对RHDV和RHDV2毒株的衣壳蛋白VP60序列进行分析,设计了一对特异性引物,建立了基于SYBR Green II染料的荧光定量PCR,结合熔解曲线差异,能够快速鉴别出两者。该方法仅需加一对引物就能够区分两种不同的RHDV,简单易行,耗时少,给兔瘟的正确诊断和防治提供了极大的便利。虽然中国目前还没有检测到RHDV2的公开报道,但是也不能够排除该病原有隐性感染的可能,本研究建立的方法为RHDV2的检测提供了可靠方法。
1 材料与方法
1.1 材料
1.1.1 质粒与毒株 新型兔出血症病毒(RHDV2)VP60基因序列(GenBank登录号: KM878681.1)由上海生工生物有限公司合成,然后构建成重组质粒(PVC-RHDV2-VP60)保存于本实验室;经典兔出血症病毒(RHDV)全长质粒PBL-RHDV由本实验室保存。
1.1.2 试剂和仪器 DNA Marker、Taq酶、SYBR Green II荧光染料、荧光定量PCR管购自TaKaRa公司;pMD19-T载体、Solution I购自Promega公司;质粒提取试剂盒购自天根公司;大肠杆菌DH5α感受态购自全式金公司;胶回收试剂盒、荧光定量PCR管购自Axygen公司;Mastercycle ep realplex 4荧光定量PCR仪购自德国Eppendorf公司;紫外超微量分光光度计购自美国热电公司。
1.2 方法
1.2.1 PCR引物设计与合成 使用DNAStar软件对本实验室保存的病毒RHDV(GenBank登录号: DQ205345.1)和RHDV2(GenBank登录号: KM878681.1),并在数据库进行同源性分析,找出两者的保守序列,并设计了1对与两个模板都特异性结合的引物。引物由上海生工合成,理论可扩增的长度为184 bp。RHDV-F:5'-TTGTTTGTGAT GGCMTCGGGT-3';RHDV-R:5'-GCGAACAT GATGGGTGTGTTCTT-3'。
1.2.2 模板制备 分别以pBL-RHDV和pUC-RHDV2-VP60为模板克隆出VP60基因序列,扩增体系(50 μL):模板DNA 2.0 μL、Primix TaqTM(Ex TaqTMVersion)25 μL、上/下游引物(10 pmol/μL)各2 μL、加灭菌ddH2O补足50 μL。PCR反应条件: 94℃预变性3 min;94℃变性1 min,56℃延伸30 s,72℃延伸1 min 45 s,35个循环;72℃ 延伸10 min。PCR扩增产物用琼脂糖凝胶电泳鉴定,利用切胶回收试剂盒回收目的片段,并将回收的目的片段克隆至pMD19-T载体中,转化DH5α感受态细胞,PCR鉴定阳性重组质粒送上海华津生物有限公司测序。提取鉴定结果正确的重组质粒作为荧光定量的模板使用。将重组质粒分别命名为pMD-19T-RHDVVP60、pMD-19T-RHDV2-VP60。按以下公式计算重组质粒绝对拷贝数:copies/μL=(6.02×1023)×(ng/μL×10-9)/(DNA长度×660)。
1.2.3 荧光定量PCR最佳条件选择 最佳条件选择主要指PCR退火温度和PCR引物浓度。首先设置退火温度为55~65℃梯度筛选出最佳退火温度,然后进行优化引物浓度,找到最小的样本Ct值以及最高荧光值,提高反应的稳定性及可信度。
1.2.4 标准曲线建立 取OD280/OD260介于1.8~2.0的阳性重组质粒作为标准品,测定核酸含量。根据公式:copies/μL=(6.02×1023)×(ng/μL×10-9)/(DNA长度×660),计算拷贝数,根据实际测得浓度将核酸进行10倍梯度稀释,稀释至102~109copies/ μL,然后进行荧光定量PCR绘制标准曲线。
1.2.5 熔解曲线建立 以上述优化的PCR反应条件进行荧光定量PCR。反应体系:2×SYBR GreenⅡreal-time PCR Master Mix 10 μL、上下游引物各0.5 μL、模板1.0 μL、补充灭菌ddH2O至20 μL,待PCR反应循环结束后收集荧光信号后建立溶解曲线。
1.2.6 特异性试验 将分别提取的兔轮状病毒、兔水疱性口炎病毒核酸作为模板进行特异性实验,同时设立阴性对照。
1.2.7 敏感性试验 将标准品稀释至102~109copies/ μL,每个反应添加模板2 μL,进行荧光定量PCR反应,用来确定所能检测的最小拷贝数。
2 结果
2.1 目的基因片段的扩增 成功克隆出经典RHDV的VP60序列,对克隆产物连接pMD19-T载体,测序结果正确,并利用该重组载体为模板特异性扩增出184 bp的基因片段(图1)。
2.2 荧光定量PCR反应条件优化 经过实验条件的优化,最终确定荧光定量PCR最佳的反应条件:94℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,共30个循环;最后72℃延伸10 min。琼脂糖凝胶电泳分析扩增效率,确定该反应体系的最佳退火温度为60℃。PCR反应体系:SYBR Green Ⅱ10 μL、上下游引物(10 pmol/μL)各1 μL、模板各1 μL,补加灭菌ddH2O至20 μL。
2.3 荧光定量PCR标准曲线的建立 将pMD-19TRHDV-VP60和pMD-19T-RHDV2-VP60的质量浓度转化为拷贝数,并稀释为同一拷贝数,标准品稀释至1×102~1×109copies /μL,利用最佳扩增条件进行定量扩增(图2)。结果显示(图3),标准品质粒在1×102~1×109copies /μL之间具有良好的线性关系。pMD-19T-RHDV-VP60的相关系数: R2=0.999,线性关系式:y=-4.5648x+45.879;pMD-19T-RHDV2-VP60的相关系数:R2=0.9999,线性关系式:y=-4.0313x+44.178;产物熔解曲线单一,表明产物为特异性扩增。
2.4 熔解曲线分析 从熔解曲线所得到的的特异峰可以看出:pMD-19T-RHDV2-VP60的熔解温度为(86.3±0.1)℃,pMD-19T-RHDV-VP60的熔解温度为(85.1±0.1)℃;扩增产物的熔解曲线只出现1个单特异性峰(图4)。
2.5 特异性 本研究建立的方法只能特异检测到RHDV,而对兔的其他病毒类疾病的检测结果均为阴性(图5),说明该对引物能够很好的检测RHDV,并对其进行分型。
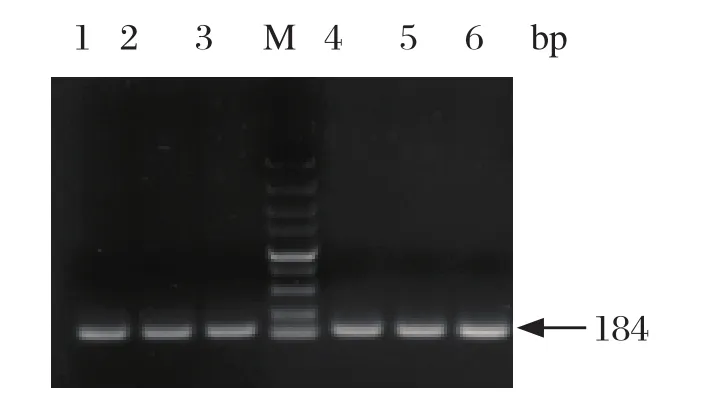
图1 目的基因PCR扩增产物Fig.1 PCR products of target gene1~3∶ pMD19T-RHDV-VP60, 浓度依次为103、105、107copies/ μL; 4~6∶ pMD19T-RHDV2-VP60, 浓度依次为103、105、107copies/μL; M∶ DNA分子量标准(DL2000)1-3∶ The concentration of pMD19T-RHDV-VP60 were 103, 105, 107copies/μL in turn; 4-6∶ The concentration of pMD19TRHDV2-VP60 were 103, 105, 107copies/μL in turn; M∶ DNA Marker(DL2000)
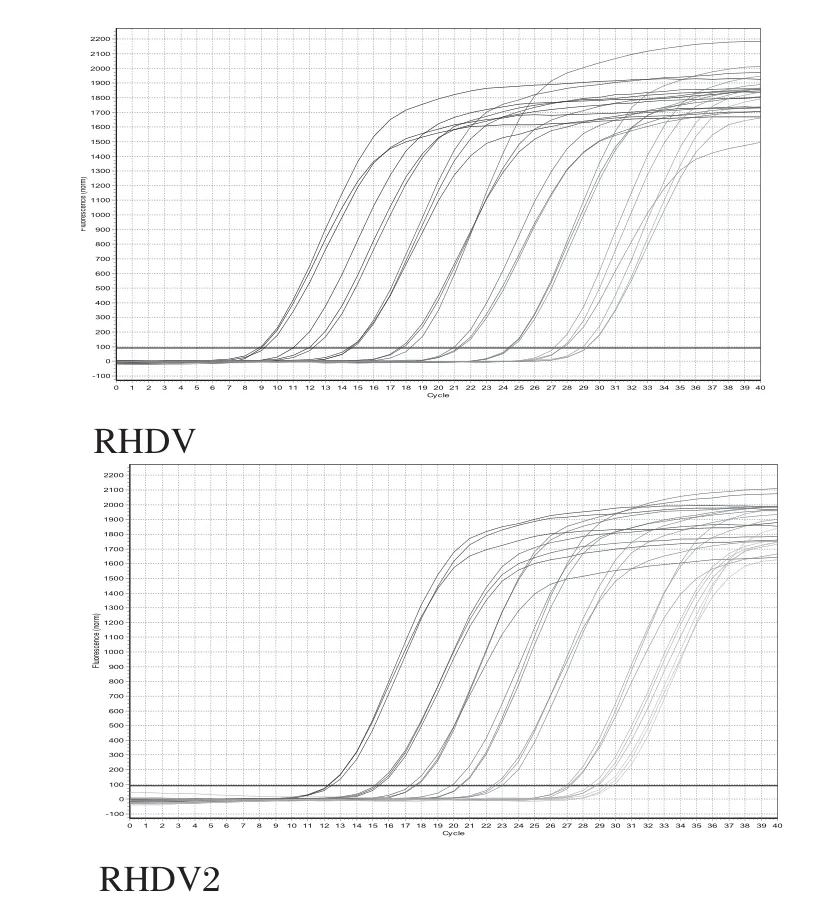
图2 荧光定量PCR扩增曲线Fig.2 Kinetic curve of real-time PCR
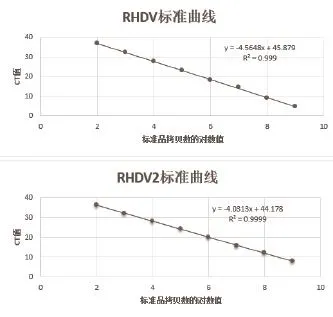
图3 荧光定量PCR标准曲线Fig.3 Standard curve of real-time PCR

图4 荧光定量PCR熔解曲线的建立Fig.4 Melting curve of real-time PCR
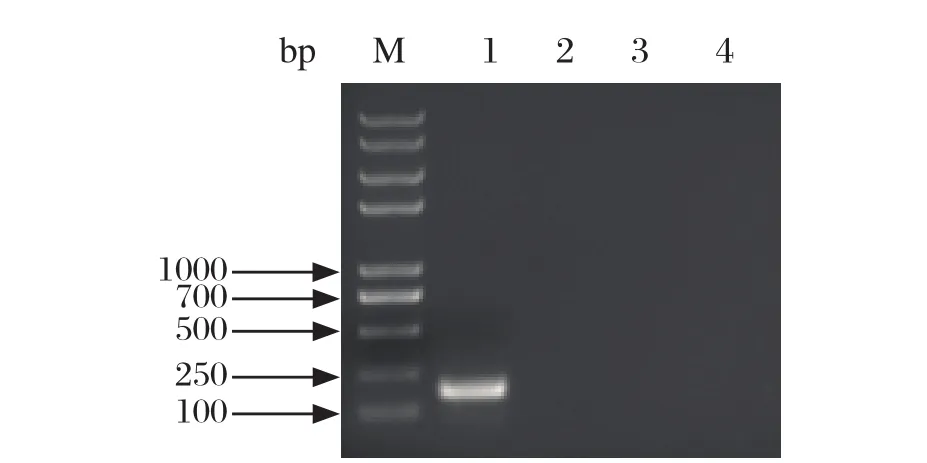
图5 PCR特异性结果分析Fig.5 Specifi city test of real-time PCR for RHDV1∶ RHDV/ RHDV2; 2∶ 兔轮状病毒; 3∶ 兔水泡性口炎病毒; 4∶ 阴性对照; M∶ DNA分子量标准(2k plus II)1∶ RHDV/ RHDV2; 2∶ Lapine rotavirus(LaRV); 3∶ Rabbit Vesicular stomatitis(RVSV); 4∶ Negative control; M∶ DNA Marker (2k plus II)
3 讨论
目前,在RHDV的鉴别方面已有ELISA方法鉴别两株不同的RHDV,该方法原理是利用筛选的特异性单克隆抗体能够识别不同亚型RHDV,从而能够鉴别出不同亚型的兔出血症病毒[11]。也有学者利用TaqMan荧光探针的方法检测RHDV2[12],该方法仅能够检测已发生疫情是否含有新型兔病毒性出血症病毒。
本研究建立的基于SYBR Green II的荧光定量PCR结合熔解曲线法能够同时鉴别出两种不同亚型的RHDV,对RHDV流行病学调查以及防控具有重要意义。目前虽然RHDV2已经在欧洲广泛流行,并有取代经典RHDV的趋势,但我国还没有公开报道有RHDV2感染爆发,我们实验室也没有收集到RHDV2的病料,所以建立的该方法在应用方面还未得到检验,这是本实验的不足之处。
[1] 刘胜江, 薛华平, 浦伯清, 等. 兔的一种新病毒病—兔病毒性出血症[J]. 畜牧与兽医, 1984(6)∶ 253-255.
[2] Le Gall-Recule, Zwingelstein G F, Boucher S, et al. Detection of a new variant of rabbit haemorrhagic disease virus in France[J]. Vet Rec, 2011, 168(5)∶ 137-138.
[3] Abrantes J, Lopes A M, Dalton K P, et al. New variant of rabbit hemorrhagic disease virus, Portugal, 2012-2013[J]. Emerg Infect Dis, 2013, 19(11)∶ 1900-1902.
[4] Le Gall-Recule G, Lavazza A, Marchandeau S, et al. Emergence of a new lagovirus related to Rabbit Haemorrhagic Disease Virus[J]. Vet Res, 2013, 44∶ 81.
[5] Puggioni G, Cavadini P, Maestrale C, et al. The new French 2010 Rabbit Hemorrhagic Disease Virus causes an RHD-like disease in the Sardinian Cape hare (Lepus capensis mediterraneus) [J]. Vet Res, 2013, 44∶ 96.
[6] Baily J L, Dagleish M P, Graham M, et al. RHDV variant 2 presence detected in Scotland[J]. Vet Rec, 2014, 174(16)∶ 411.
[7] Lopes A M, Marques S, Silva E, et al. Detection of RHDV strains in the Iberian hare (Lepus granatensis)∶ earliest evidence of rabbit lagovirus cross-species infection[J]. Vet Res, 2014, 45∶ 94.
[8] Westcott D G, Frossard J P, Everest D, et al. Incursion of RHDV2-like variant in Great Britain[J]. Vet Rec, 2014, 174(13)∶ 333.
[9] Duarte M, Henriques M, Barros S C, et al. Detection of RHDV variant 2 in the Azores[J]. Vet Rec, 2015, 176(5)∶130.
[10] Dalton K P, Abrantes J, Lopes A M, et al. Complete genome sequence of two rabbit hemorrhagic disease virus variant b isolates detected on the Iberian Peninsula[J]. Arch Virol, 2015, 160(3)∶ 877-881.
[11] Barcena J, Guerra B, Angulo I, et al. Comparative analysis of rabbit hemorrhagic disease virus (RHDV) and new RHDV2 virus antigenicity, using specific virus-like particles[J]. Vet Res, 2015, 46∶106.
[12] Duarte M D, Carvalho C L, Barros S C, et al. A real time Taqman RT-PCR for the detection of rabbit hemorrhagic disease virus 2 (RHDV2) [J]. J Virol Methods, 2015, 219∶90-95.
DIFFERENTIATION OF SUBTYPES OF RABBIT HEMORRGAGIC DISEASE VIRUS USING SYBR GREEN II REAL-TIME PCR AND DIFFERENT MELTING CURVES
TAN Yong-gui, LIU Teng, ZHU Jie, GUO Hui-min, WU Qiao-mei, LI Qi, MIAO Qiu-hong, CHEN Zong-yan , LI CHUAN-feng , LIU Guang-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The real - time fl uorescence PCR in combination of unique melting curves was developed to distinguish Rabbit hemorrhagic disease virus(RHDV) and RHDV2. A pair of specifi c primers were designed according to the published GenBank database of RHDV and RHDV2 capsid protein VP60 and labeled with SYBR Green fl uorescent dye II. The melting temperatures of RHDV and RHDV2 were (86.3 + 0.1) ℃ and (85.1-0.1) ℃, respectively, and single specifi c peaks were observed. These results indicated that the method developed here was able to quickly identify RHDV and RHDV2.
Rabbit hemorrhagic disease virus; Real - time fl uorescence PCR; melting curve; differentiation
S852.659.6
A
1674-6422(2017)01-0007-05
2016-05-06
国家重点研发计划项目(2016YFD0500108);国家自然科学基金项目(31502068);上海市科技兴农重点攻关项目
谭永贵,男,硕士研究生,预防兽医学专业
刘光清,E-mail:liugq@shvri.ac.cn
——一道江苏高考题的奥秘解读和拓展

