肺表面活性蛋白A及鸡SP-A功能研究进展
黄 琪,陈鸿军
(中国农业科学院上海兽医研究所,上海 200241)
·综述·
肺表面活性蛋白A及鸡SP-A功能研究进展
黄 琪,陈鸿军
(中国农业科学院上海兽医研究所,上海 200241)
本文简述了肺表面活性蛋白A(surfactant protein A,SP-A)的生物学功能研究进展。人、动物和鸡的SP-A在先天性免疫防御中发挥着重要作用,不仅具有降低肺表面张力,防止因肺容量过低而导致塌陷的生理功能,还具有结合特异性微生物,增强巨噬细胞吞噬与杀伤的抗感染免疫功能。因此开发利用鸡SP-A对鸡呼吸道传染病防控具有良好的应用前景。
肺表面活性蛋白A;功能;先天性免疫;鸡
鸡肺表面活性蛋白A(chicken surfactant protein A,cSP-A)是肺泡上皮分泌的一种亲水性糖蛋白,在机体呼吸系统先天性免疫防御中发挥重要作用。cSP-A属于胶原凝集素的一种,与哺乳动物肺表面活性蛋白A同源。研究表明凝集素(collectin)属于可溶性的模式识别受体,存在于动物不同的组织中,与不同的微生物表面多糖相互作用。目前为止,共发现了六种不同的凝集素:甘露糖结合凝集素(MBL)、表面活性蛋白A(SP-A)、胶原凝集素10(COLEC10)、胶原凝集素11(COLEC11)、胶原凝集素12(COLEC12)、肺凝集素(LL)和纤维胶凝蛋白(FCN)[1]。与人类相比,大多数鸡凝集素的结构和功能尚未完全清楚。
由于鸡呼吸道缺乏MBL和补体系统,天然免疫分子cSP-A则起着更为主要的、不可替代的作用[2]。与其他组织细胞相比较,cSP-A在肺脏中分布较多,因此它们主要在肺部起天然免疫防御作用。其他部位中别的免疫分子含量则较高,cSP-A的免疫作用居于次要地位。本文主要对哺乳动物SP-A及鸡SP-A的生物学特性、抗病毒抗细菌的作用以及在炎症反应中的调节作用进行综述。
1 cSP-A的生物学特性
cSP-A主要由肺泡上皮细胞合成与分泌,是目前在家禽呼吸系统中最为重要的蛋白。cSP-A基因编码222个多肽,蛋白质分子量为24.72 kDa,等电点为5.09,蛋白具有较高的亲水性。分析cSP-A基因序列发现,与哺乳动物的SP-A相似,从N端到C端依次为5个结构域:短的N-端区、胶原样区(collagen-like region,CLR)、未知区(unknown)、茎区(neck domain)和凝集素糖识别区(carbohydrate recognition domain,CRD),具有C型凝集素家族的共同结构特征[3]。cSP-A共由4个外显子编码而成:外显子1编码信号肽、N端和小部分胶原样区域,外显子2编码未知区、颈区和CRD区分别由外显子3和4编码。cSP-A单体的CLR为一多聚化三联螺旋体结构,与人SP-A的CLR相比,它相对较短,是SP-A与磷脂相互作用的部位[4];CRD为球状结构区,cSP-A在CRD区域氨基酸组成与其他哺乳动物CRD区域同源性在39.5%~45.7%,较为保守,并有2个糖基化位点、2个钙离子结合位点、1个结合甘露糖的基序(Glu215-Pro216-Asn217),这一基序的存在可能会使CRD结合病原微生物糖蛋白的作用更为显著。有研究报道显示完整的SP-A分子是同质三肽链结构单位的寡聚体,多至六聚体,但只有三聚体以上的寡聚体才具有生物学活性[5]。
cSP-A组织表达相对广泛,但主要在呼吸系统,例如气管、喉头、鸣管、气囊等,此外,在胸腺和头状骨也有少量表达[6]。cSP-A在呼吸系统的高水平表达,可能与家禽呼吸道巨噬细胞在生理状态下较少活跃有关,推测cSP-A在鸡呼吸系统可能起着主要的天然免疫防御作用,当病原体入侵时,可借这些部位的cSP-A立即启动吞噬行为,而无须等待特异性抗体的产生。这种免疫防御作用可能是除肺部免疫球蛋白、补体介导的吞噬活动之外,又一种新的清除病原体的机制,且似乎对肺脏更为有利[3]。几种鸡凝集素蛋白在脏器中的表达情况如下(表1)。
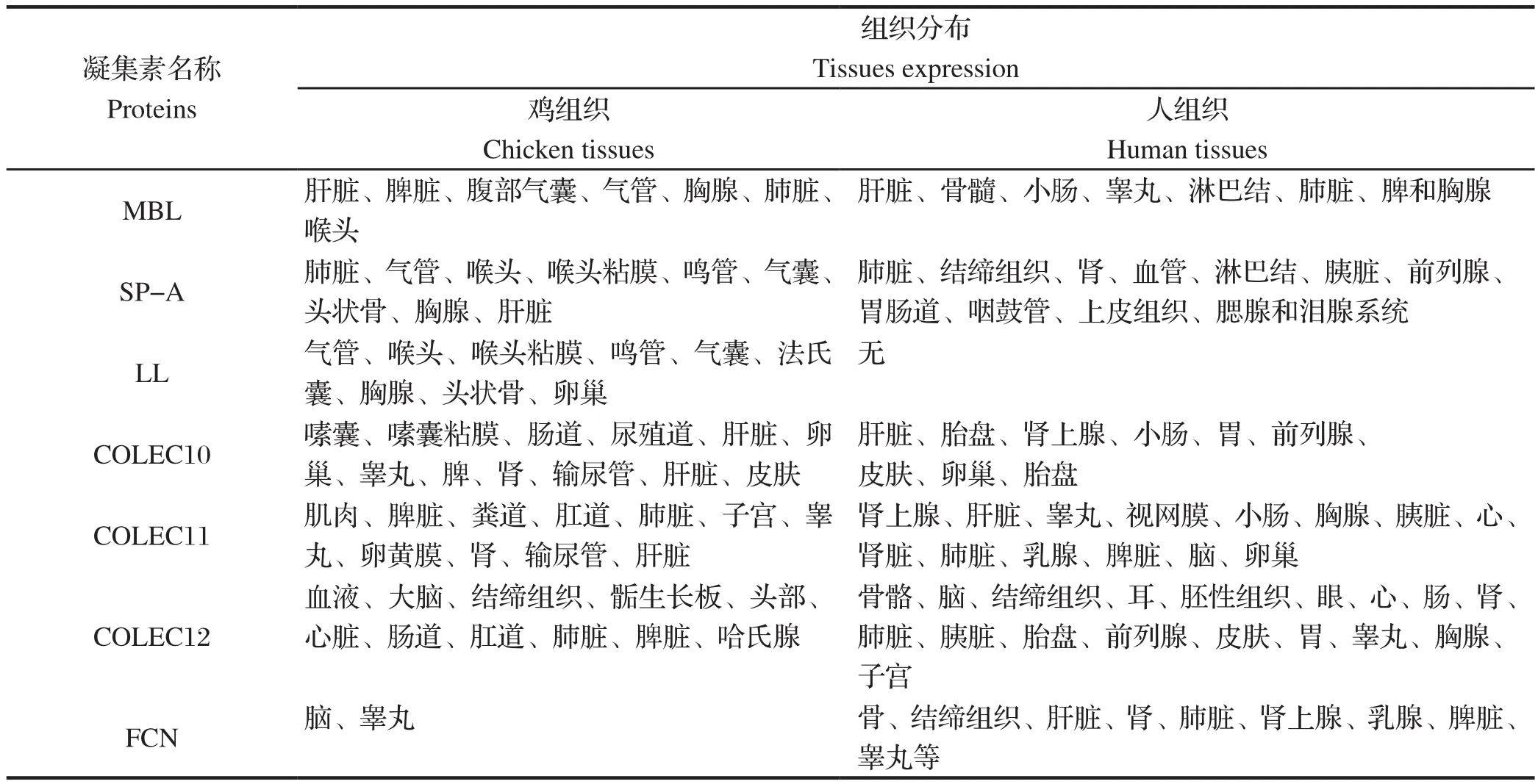
表1 人和鸡凝集素在脏器中的分布Table 1 Issue expression of chicken collagenous lectins
2 SP-A抗感染免疫作用
SP-A参与肺表面活性物质(pulmonary surfactant,PS)的形成与代谢,维持细胞内外PS的水平,同时作为广谱调理素,参与局部防御、调节免疫和炎性反应,维护肺泡结构和功能,在先天性免疫防御中发挥重要作用。SP-A主要通过两种途径抵抗病原体的侵入:直接的抗病原体作用和通过免疫反应的调节作用。
2.1 直接抗病原体作用 动物的SP-A属于天然免疫分子,也是模式识别分子,依靠其CRD结合细菌或病毒等病原体表面的特异性碳水化合物,如G+脂磷壁酸和肽多糖或者G-的内毒素(脂多糖)以及某些病毒的主要结构蛋白—糖蛋白,如甲型流感病毒的HA蛋白,从而发挥中和病毒及阻抑细菌粘附的直接效应。研究发现,感染甲型流感病毒(Influenza A virus,IAV)后,缺失SP-A的小鼠与野生型小鼠相比,病毒滴度增加,肺部炎性细胞和促炎细胞因子浓度也增加[7]。研究表明,感染H9N2 IAV后,鸡肺中cLL和cSP-A的mRNA表达水平呈下调趋势,而在气管中则成上调趋势[8]。目前cLL已被证实能够抑制人源的A型流感病毒的红细胞凝集活性,由于cSP-A和cLL的分子结构与哺乳动物源的SP-A基本相同,因此推测其功能也相似。此外,SP-A还通过增加病原体细胞膜的通透性,抑制某些细菌的生长。SP-A缺陷小鼠在感染致肾盂肾炎大肠杆菌(UPEC)后,对尿路感染表现出更高的易感性,表现在细菌较高的CFU值以及更明显的中性粒细胞浸润等病理变化,同时还发现SP-A可以直接抑制UPEC的生长[9]。此外研究发现,与对照组(接种PBS)相比,接种大肠杆菌的小鼠肺中SP-A mRNA水平的表达量较对照组(接种PBS)明显降低。
2.2 SP-A在先天性免疫应答中的作用 先天性免疫防御系统是机体抵抗病原体入侵的第一道防线,是机体在暴露于病原,特异性免疫反应建立之前的最重要的防御阶段。SP-A通过调节免疫因子,或者吞噬细胞以及Toll样受体在先天性免疫防御中发挥抗感染作用。
SP-A通过CRD区与病原体糖基结合,刺激肺泡巨噬细胞和中性粒细胞的活性,增强其对病原菌的摄取,抑制多种细胞因子和炎症介质的合成和释放,以此调控肺泡水平的免疫作用[10]。与哺乳动物不同,在未感染状态下鸡呼吸系统的巨噬细胞数量远远小于同体重的家兔,但是在呼吸系统的主要部位却有cSP-A蛋白的表达,当病原菌入侵时,借助cSP-A可迅速启动吞噬行为。研究表明SP-A能以Ca2+依赖方式增强中性粒细胞对A型流感嗜血杆菌、绿脓杆菌、大肠杆菌、肺炎链球菌以及金黄色葡萄球菌等的摄取[11]。SP-A基因缺失小鼠感染B族链球菌后,吞噬细胞吞噬细菌的能力明显降低,加入外源性SP-A后,吞噬能力便可恢复。此外,SP-A可以提高巨噬细胞中NO的产量,刺激巨噬细胞产生氧自由基,促进杀菌[12]。SP-A与Toll样受体(Toll like receptors,TLRs)也有重要的相互作用,尤其是TLR2和TLR4。SP-A可抑制肺泡上皮细胞C1q介导的补体活化和炎症反应,并直接绑定到TLRs。TLR2和TLR4主要参与呼吸道合胞病毒(Respiratory Syncytial virus,RSV)的感染以及H5N1引起的急性肺损伤的调节[13,14]。Kawai等[15]证实SP-A通过CRD促进CD14与TLR-4结合形成复合物,以激活下游转录因子(如NF-κB、p38 MAPK)的激活,增加炎症因子的释放,介导炎症反应。但SP-A与该受体的相互作用机制还不清楚。
2.3 SP-A在获得性免疫应答中的作用 SP-A抑制T淋巴细胞的增殖,降低IL-2的产生和淋巴细胞的活性,这可能与转化生长因子在SP-A合成时出现有关[16]。SP-A对T细胞活性的调节随激活信号的强弱表现不同:高信号强度时抑制T细胞的激活,弱信号时增强他们的活化与增殖[17]。通过与SP-A的结合,低反应状态的肺泡淋巴细胞保护肺实质避免炎症引起损伤[18]。SP-A通过调节肺泡中T细胞的活性,进而影响适应性免疫应答反应,直接或间接地与病原体、细胞因子(如转化生长因子-β、TGF-β)相互作用,进而调节炎症反应。在正常生理状态下,SP-A绑定无活性的 TGF-β,肺损伤发生时,TGF-β脱离SP-A,发挥一级炎症级联反应的作用[16]。此外,在呼吸道病毒感染的免疫反应中,树突状细胞发挥着重要作用,研究表明,SP-A有调节树突状细胞的作用[14]。
2.4 SP-A免疫调节作用 SP-A通过CRD与上皮细胞以及吞噬细胞表面的受体结合,激活TLR-4引起下游转录因子NF-κB、p38 MAPK以及IRF3的激活,来调节炎性反应[19]。在肺部正常生理状态下,SP-A通过CRD头部与巨噬细胞表面的信号调节蛋白结合,抑制p38 MAPK激活以及减少各种细胞介质产物的释放。一旦病原菌入侵,SP-A胶原尾部便与钙网蛋白/CD91相结合,进而激活p38 MAPK磷酸化以及NF-κB的活化作用,导致细胞因子与趋化因子产物的增加,如TNF-α、IL-8和MCP-1。
SP-A既能够直接协同IgG激活细胞的配体,也上调肺泡巨噬细胞表面的甘露糖受体,以增强细胞的吞噬功能。SP-A通过外源性病原体存在与否,决定SP-A与何种受体结合,进而发挥不同作用[20]。这有利于清除入侵的病原体,又能防止炎症反应过度,对维持免疫稳态有着重要意义。
3 应用前景
目前的研究表明,哺乳动物SP-A在抗感染免疫反应中发挥了重要的作用,因此,开发禽源肺免疫活性物质(cSP-A)用于预防和治疗鸡多病因呼吸综合征具有重要意义。外源性的肺表面活性物质替代疗法治疗ALI/ARDS已经获得较好效果,成为治疗的首选疗法之一。目前用于临床的PS制剂,多为哺乳动物源的SP-B和SP-C。以此作为借鉴,如能进行cSP-A原核或真核表达[21],提取和浓缩获得cSP-A纯品,制备气雾剂PS,通过雾化吸入方式对禽群进行群体预防,极有可能控制鸡呼吸道传染病。
[1] Hamzić E, Pinard-van der Laan M H, Bed'Hom B, et al. Annotation and genetic diversity of the chicken collagenous lectins[J]. Mol Immunol, 2015, 65(2)∶ 277-286.
[2] 苏培瑜, 杨洪军, 李韶菁. 表面活性蛋白A, D抗病毒作用的研究进展[J]. 经济发展方式转变与自主创新——中国科学技术协会年会, 2010.
[3] 刘红梅, 崔尚金, 潘玲, 等. 鸡肺相关凝集素及其天然免疫机制[J]. 中国免疫学杂志, 2013, 29(3)∶ 327-330.
[4] Veldhuizen E J Avan, Eijk M, Haagsman H P. The carbohydrate recognition domain of collectins[J]. FEBS J, 2011, 278∶ 3930-3941.
[5] van Eijk M, White M R, Batenburg J J, et al. Interactions of influenza a virus with sialic acids present on porcine surfactant protein D[J]. Am J Respir Cell Mol Biol, 2004, 30∶ 871-879.
[6] Hogenkamp A, van Eijk M, van Dijk A. Characterization and expression sites of newly identified chicken collectins[J]. Mol Immunol, 2006, 43(10)∶ 1604-1616.
[7] LeVine A M, Hartshorn K, Elliott J, et al. Absence of SP-A modulates innate and adaptive defense responses to pulmonary[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 282(3)∶ L563-572.
[8] Reemers S S, Veldhuizen E J, Fleming C, et al. Transcriptional expression levels of chicken collectins are affected by avian influenza A virus inoculation[J]. Vet Microbiol, 2010, 141(3-4)∶ 379-384.
[9] Hu F, Ding G, Zhang Z, et al. Innate immunity of surfactant proteins A and D in urinary tract infection with uropathogenic Escherichia coli [J]. Innate Immun, 2016, 22(1)∶ 9-20.
[10] Haagsman H P, Hogenkamp A, Eijk M, et al. Surfactant collectins and innate immunity[J]. Neonatology, 2008, 93(4)∶ 288-294.
[11] Hogenkamp A, van Eijk M, van Dijk A. Characterization and expression sites of newly identified chicken collectins[J]. Mol Immunol, 2006, 43(10)∶ 1604-1616.
[12] Pasula R, Wright J R, Kachel D L, et al. Surfactant protein A suppresses reactive nitrogen intermediates by alveolar macrophages in response to Mycobacterium tuberculosis[J]. J Clin Inv, 1999, 103(4)∶ 483-490.
[13] Murawski M R, Bowen G N, Cerny A M, et al. Respiratory syncytial virus activates innate immunity through Toll-like receptor 2[J]. J Virol, 2009, 83∶ 1492-1500.
[14] Imai Y, Kuba K, Neely G G, et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury [J]. Cell, 2008, 133∶235-249.
[15] Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J]. Immunity, 2011, 34(5)∶ 637-650.
[16] Kunzmann S, Wright J R, Steinhilber W, et al. TGF-beta 1 in SP-A preparations influence immune suppressive properties of SP-A on human CD4+T lymphocytes[J]. Am J Physiol∶ Lung Cell Mol Physiol, 2006, 291(4)∶ 747-756.
[17] Mukherjee S, Giamberardino C, Thomas J, et al. Surfactant protein A integrates activation signal strength to differentially modulate T cell proliferation[J]. Immunol, 2012, 188(3)∶ 957-967.
[18] Pastva A M, Mukherjee S, Giamberardino C, et al. Lung effector memory and activated CD4+ T cells display enhanced proliferation in surfactantprotein A-deficient mice during allergen-mediated inflammation[J]. Immunol, 2011, 186(5)∶ 2842-2849.
[19] 牛伟静, 丁国华, 胡凤琪. 表明活性蛋白A在固有免疫中的作用及机制[J]. 武汉大学学报, 2014, 35(2)∶ 202-205.
[20] Gardai S J, Xiao Y Q, Dickinson M, et al. By binding SIRP alpha or calreticulin/CD91, lung collectins act as dual function surveillance molecules to suppress or enhance inflammation [J]. Cell, 2003, 115(1)∶ 13-23.
[21] 黄 琪, 汪凯, 潘玲, 等. 鸡肺表面活性蛋白A的可溶性表达及活性检测[J]. 中国兽医科学, 2015, 5(11)∶ 1196-1200.
PROGRESSES ON PULMONARY SURFACTANT PROTEIN A AND CHICKEN SP-A
HUANG Qi, CHEN Hong-jun
(Shanghai Veterinary Research Institute, CAAS,Shanghai 200241, China)
This paper briefl y describes research progress the pulmonary surfactant protein A (SP - A) biological function. SP-A from human, animal and chicken plays an important role in innate immunity by maintaining alveolar integrity and preventing alveolar collapse at low lung volumes, and binding several pathogens, enhancing phagocytosis and chemotaxis of alveolar macrophages. Chicken SP-A (cSP-A) is one of chicken lung lectins, which is the most abundant protein of surfactant. Therefore, cSP-A shows broad application prospects in bioengineering and prevention of avian infectious diseases.
Pulmonary surfactant protein A; physiological functions; innate immunity; chicken
S852.42
A
1674-6422(2017)01-0075-05
2016-03-07
安徽省自然科学基金(1408085MC49);国家自然基金面上项目(31572502);中央公益性单位专项经费(2015JB15);中国农业科学院动物流感病原生态学创新团队专项经费
黄琪,女,硕士研究生,预防兽医学专业
陈鸿军,E-mail:vetchj@shvri.ac.cn

