鼠隐藏管状线虫烯醇化酶基因的克隆与序列分析
陈 宁,王 平,程 田,龚振兴,谢天柱,李俊鹏,张延忠,王晓炜,鲁 艺
(1. 深圳市药品检验研究院,深圳 518057;2. 华南农业大学兽医学院,广州 510642;3.中国农业科学院兰州兽医研究所,兰州 730046;4.深圳市瑞鹏宠物医院,深圳 518000)
·研究论文·
鼠隐藏管状线虫烯醇化酶基因的克隆与序列分析
陈 宁1,王 平1,程 田2,龚振兴3,谢天柱1,李俊鹏1,张延忠4,王晓炜1,鲁 艺1
(1. 深圳市药品检验研究院,深圳 518057;2. 华南农业大学兽医学院,广州 510642;3.中国农业科学院兰州兽医研究所,兰州 730046;4.深圳市瑞鹏宠物医院,深圳 518000)
为获得鼠隐藏管状线虫(Syphacia obvelata)烯醇化酶结构及其功能,采用同源克隆方法结合RACE技术克隆获得了烯醇化酶基因cDNA序列,并对其进行了序列分析。测序结果显示,扩增获得的鼠隐藏管状线虫烯醇化酶基因大小序列为1603 bp,包含全长为1311 bp的开放阅读框(open reading frame,ORF)序列,共编码436个氨基酸,推导分子量为47.428 kDa。序列分析结果显示,鼠隐藏管状线虫烯醇化酶含有10个丝氨酸激酶磷酸化位点、3个苏氨酸激酶磷酸化位点和4个酪氨酸激酶磷酸化位点,1个潜在的跨膜螺旋结构,无信号肽剪切位点;在亚细胞水平,预测其主要定位于胞浆;二级结构主要以α-螺旋和无规则卷曲为主,其中α-螺旋占34.86%,无规则卷曲占30.50%,延伸链占24.08%,β-转角占10.55%。Swiss-Model模建的3D结构显示,鼠隐藏管状线虫烯醇化酶为一“哑铃”样结构,包含氨基端和羧基端两个结构域,结构域之间为Linker区。每个结构域由多个α-螺旋、β-折叠和卷曲所构成桶形结构,催化中心和Mg2+结合位点位于桶形结构的中心。本研究结果为鼠隐藏管状线虫烯醇化酶基因的功能研究奠定基础。
鼠隐藏管状线虫;烯醇化酶;克隆;生物信息学分析
鼠隐藏管状线虫(Syphacia obvelata)又称鼠蛲虫,是寄生于啮齿类实验动物体内最普遍的寄生虫之一,对实验动物健康、抗体制备以及动物实验结果等影响巨大[1]。与其他寄生虫相似,鼠隐藏管状线虫缺少典型的或仅具有不完整的有氧氧化途径,也不能利用脂肪酸和蛋白质进行供能,糖酵解代谢(glycolysis metabolism)是其获取能量最重要的途径。烯醇化酶(enolase)是糖酵解途径中的关键酶之一,主要功能为催化2-磷酸-D-甘油酸生成磷酸烯醇丙酮酸。烯醇化酶广泛存在于各种寄生虫中,结构具有高度保守性,在寄生虫生化代谢途径中发挥重要功能,还能与细胞骨架蛋白和多聚核苷酸结合[2],并可参与寄生虫的入侵[3]、调节寄生虫的生长发育[4]及免疫保护[5,6]等。截至目前,鼠隐藏管状线虫的烯醇化酶研究尚无相关报道,因此,本研究通过对鼠隐藏管状线虫烯醇化酶编码基因的克隆和序列分析,为其功能的进一步研究以及探索烯醇化酶在鼠隐藏管状线虫病的诊断、药物及疫苗研究中的应用奠定了基础。
1 材料和方法
1.1 虫种、工具酶与试剂 鼠隐藏管状线虫为本实验室保种;DNA Marker(DL 2000)、琼脂糖(Agarose)、胶回收试剂盒 ( Agarose Gel DNA Extraction Kit)、pMD18-T Vector 连接试剂盒、E.coli Competent Cells DH5α购自大连宝生物公司;DNA 聚合酶(DNA Taq)、RNA提取试剂盒(RNA Extraction Kit)、dCTP、PrimeScript RT reagent Kit、SMARTScribe TM Reverse Transcriptase 购自大连TaKaRa 公司;5' RACE System for Rapid Amplification of cDNA Ends,Version 2.0 试剂盒、SUPERSCRIPT II RT购自美国 Invitrogen 公司;3' SMARTer TM RACE cDNA Amplification Kit 试剂盒购自美国 Clontech 公司;PCR引物合成与测序均由深圳华大基因有限公司合成。
1.2 鼠隐藏管状线虫烯醇化酶全长 cDNA 序列的克隆
1.2.1 鼠隐藏管状线虫烯醇化酶基因 EST 序列的获得 利用RNA 提取试剂盒提取鼠隐藏管状线虫总RNA,1%琼脂糖凝胶电泳检测总 RNA质量。依据 GenBank 数据库中已知的猪蛔虫(ADQ00605.1)、异尖线虫(AJ496792.1)、马来布鲁线虫(XM_001896246.1)、旋盘尾丝虫(AF532606.1)、旋毛虫(AF363629.1)和秀丽新杆线虫(NM_001027178.2)烯醇化酶基因设计了5对引物。F1:5'-GAGGCAATGCGTATGGGTTC -3',R1:5'-GATGCGAAACCATTACTCCCC-3'。获得烯醇化酶基因的 EST 序列,测序并鉴定比对。
1.2.2 5'RACE 和3'RACE技术获得烯醇化酶的全长序列 根据获得的已知片段序列和5'RACE、3' RACE 的要求设计引物,引物由华大基因合成。5'端序列是由用SUPERSCRIPT II RT 酶和引物GSP1∶5'-CCATCCCTATTGACAC-3' 对总RNA进行目的基因第一链cDNA的合成,在其末端加上多聚 C;使用引物GSP2∶ 5'-GTGTATCCGGCTAGAGCAAT-3' 和桥连锚定引物 AAP 进行 PCR 第 1 轮扩增,再使用引物GSP3:5'-CCAATCCTTCCTTGTTGTCTT-3' 和桥连通用扩增引物 AUAP 进行巢式 PCR;PCR 产物纯化后进行T克隆、转化和PCR鉴定,对PCR鉴定为阳性的克隆进行测序分析。
3'RACE 是利用引物3'CDS primer A 对总 RNA 进行逆转录合成cDNA;用引物 3'P1∶5'-TGGCAGAAGTTCCACTCCAACACGC-3'和UPM 对 cDNA 模板进行第1 轮 PCR 扩增;然后用引物 3' P2:5'-AACCCTAAACGCATTCAAATGGCAA -3'和 UPM 进行第 2轮 PCR 扩增;胶回收PCR产物,T克隆、转化和PCR鉴定后对阳性克隆进行测序分析。将5'RACE和3'RACE扩增获得的序列重叠拼接,获得烯醇化酶基因的cDNA序列,并进行验证。验证引物Eno-F1∶ 5'-CGGGA TCCATGCCAATTACAAAAATTC-3'和Eno-R1∶5'-CCGCTCGAGTCGCTTGAGGGT TGCGGA-3'。
1.3 鼠隐藏管状线虫烯醇化酶基因的生物信息学分析 根据烯醇化酶基因的克隆结果,利用 NCBI 中的 ORF Finder(http∶/ /www.ncbi.nlm.nih.gov/gorf/ gorf.html)预测烯醇化酶基因的开放阅读框,从而推导其氨基酸顺序;利用ProtParam在线软件(http∶/ / web.expasy.org/protparam/)分析其基本理化性质;利用NCBI数据库,BLAST搜索其他物种的烯醇化酶序列,利用在线比对分析软件http∶//www.ebi.ac.uk/ tools/clustalW进行比对分析。利用在线工具对鼠隐藏管状线虫烯醇化酶基因的亲疏水性、信号肽、二级结构及三级结构等进行预测分析。
2 结果
2.1 鼠隐藏管状线虫烯醇化酶基因的全长cDNA克隆及验证 利用5'RACE 和3'RACE技术对烯醇化酶基因分别扩增,测序结果显示,扩增获得5'和3'端的序列,分别为840 bp(图1A)和607 bp(图1B),拼接后获得全长为1603 bp的cDNA序列,其全长ORF序列为1311 bp(图1C),推导其编码436个氨基酸。
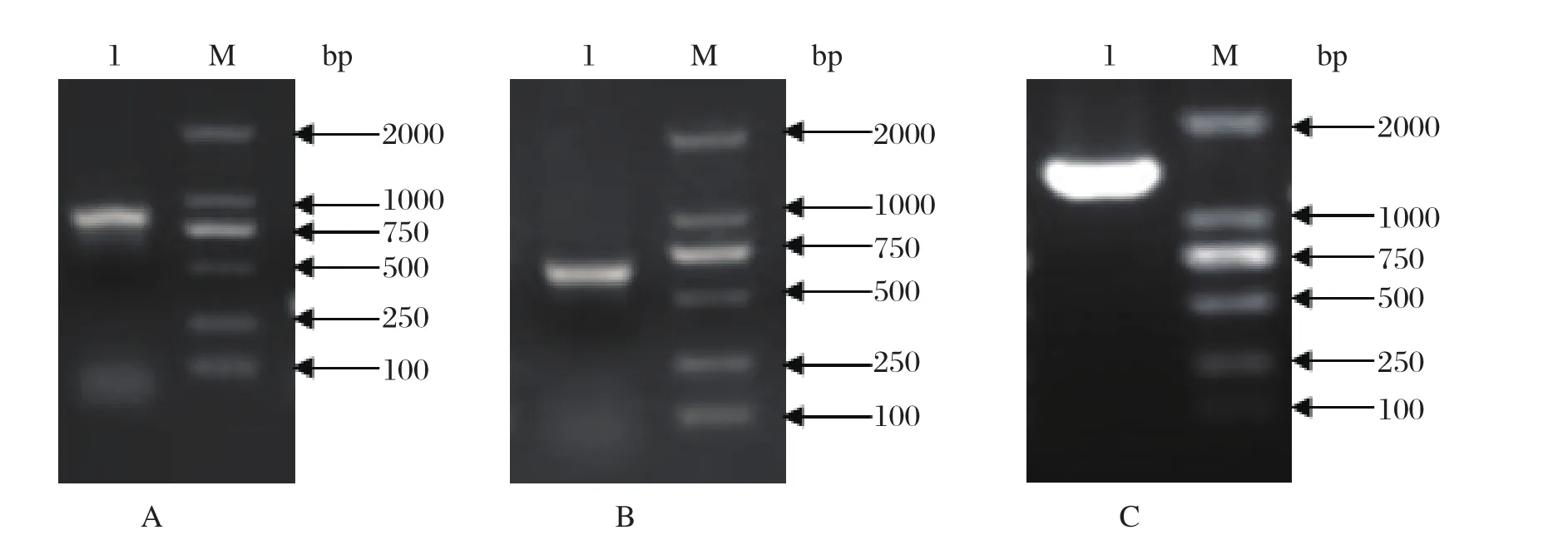
图1 烯醇化酶基因5' RACE、3' RACE和ORF序列的PCR扩增Fig.1 PCR-amplifi ed enolase gene from S.obvelataM∶ DNA分子量标准(DL2000); A∶ 5'RACE的PCR产物; B∶ 3'RACE的PCR产物; C∶ ORF序列M∶ DNA Marker(DL2000); A∶ PCR products of 5'RACE; B∶ PCR products of 3'RACE; C∶ PCR products of ORF
2.2 鼠隐藏管状线虫烯醇化酶基因理化性质及氨基酸序列分析
2.2.1 基因理化性质分析 鼠隐藏管状线虫烯醇化酶基因核苷酸序列经在线ProtParam软件分析发现,该基因编码436个氨基酸(图2),蛋白分子量为47.428 kDa,含有48个强碱性氨基酸(K、R),55个强酸性氨基酸(D、E),161个疏水性氨基酸(A、I、L、F、W、V),95个极性氨基酸(N、C、Q、S、T、Y),等电点为5.93,pH值为7.0时的静电荷为-5.165。
在组成鼠隐藏管状线虫烯醇化酶基因蛋白的20种氨基酸中,丙氨酸(Ala)所占比例最高,达到 10.6%。而半胱氨酸和色氨酸含量最低,为5%和4%,负电荷氨基酸残基(天冬氨酸和谷氨酸)56个,正电荷氨基酸残基(精氨酸和赖氨酸)49 个。烯醇化酶编码多肽的原子组成为C2096H3330N578O643S16。烯醇化酶的不稳定系数是37.81,由此说明该蛋白是一个较稳定蛋白,脂肪系数为85.96,总平均亲水性为-0.269,说明该蛋白的疏水性较强。
2.2.2 氨基酸序列同源性分析 利用NCBI的BLAST搜索与鼠隐藏管状线虫烯醇化酶具有同源性的其他物种的氨基酸序列,并用在线工具http∶//www.ebi.ac.uk/ tools/clustalW 将烯醇化酶与其他物种(白纹伊蚊(KXJ70801.1)、马来布鲁线虫(AHI18146.1)、秀丽新杆线虫(NP_001022349.1)、钩口线虫(EYB81234.1)、捻转血矛线虫(CDJ96217.1))的烯醇化酶氨基酸序列进行比对分析。红色框线标识出烯醇化酶的保守motif区域,其中aa343~356“LLLKVNQIGSVTES”为烯醇化酶的基因标签位点,蓝色框线标识出酶结合位点,绿色框线标识出酶活性位点(图3)。

图2 烯醇化酶全长cDNA序列及其ORF编码的氨基酸序列Fig. 2 Full-length cDNA sequence of enolase and the amino acid sequence encoded by ORF
2.3 鼠隐藏管状线虫烯醇化酶基因的信号肽、疏水性和跨膜区分析 利用在线工具http∶//www.expasy. ch/tools/protscale.html对鼠隐藏管状线虫烯醇化酶蛋白的疏水性进行分析(图4),发现该基因编码蛋白的氨基酸残基疏水性最大值为2.8,氨基酸序列内含有较多的疏水区域,表明该基因编码蛋白可能为疏水性蛋白。结合其疏水性、脂肪系数与总平均亲水性来综合分析,可以判定鼠隐藏管状线虫烯醇化酶是一个疏水性蛋白。同时我们也用在线分析软件SignalP 3.0(http∶//www.cbs.dtu.dk/services/ SignalP/)分析信号肽序列,发现鼠隐藏管状线虫烯醇化酶不含信号肽序列。利用在线软件https∶//www. predictprotein.org/ 进行跨膜区分析发现在aa108~125有一个潜在的跨膜螺旋结构(图5)。
2.4 结构和功能域分析 用在线软件InterPro scan http∶//www.ebi.ac.uk/interpro/scan.html扫描一级结构中包含的结构和功能域特征序列(图6),其蛋白质序列中含有烯醇化酶的典型结构域和保守位点,包含氨基端(aa3~138)和羧基端(aa128~434)两个结构域,并含有烯醇化酶aa343~356的保守位点。
2.5 模体(Motif)分析 利用在线软件http∶//myhits. isb-sib.ch/cgi-bin/Motif_scan对鼠隐藏管状线虫烯醇化酶基因的Motif结构进行分析,发现该蛋白有6个保守的Motif结构,这些都与烯醇化酶的结构和功能相关,见图7。
2.6 潜在磷酸化位点分析 根据 NetPhos2.0 http∶// www.cbs.dtu.dk/services/NetPhos/对鼠隐藏管状线虫烯醇化酶中丝氨酸激酶、苏氨酸激酶与酪氨酸激酶的磷酸化位点进行分析(图8),结果显示,该烯醇化酶含有10个丝氨酸激酶磷酸化位点(第14、105、177、241、271、294、352、356、365、376 位氨基酸)、3个苏氨酸激酶磷酸化位点(第 41、88、237 位氨酸)和4个酪氨酸激酶磷酸化位点(第12、131、189、252位氨基酸),可能成为相应蛋白激酶磷酸化的位点,烯醇化酶可能通过相应位点的磷酸化修饰来实现对其功能的调控。
2.7 亚细胞定位分析 利用亚细胞定位分析软件PSORT http∶//psort.hgc.jp/form.html对鼠隐藏管状线虫烯醇化酶基因进行亚细胞定位分析(表1),预测结果显示该基因主要定位于胞质中。
2.8 鼠隐藏管状线虫烯醇化酶二级结构预测 采用SOPMA https∶//npsa-prabi.ibcp.fr/cgi-bin/ secpred_ sopma.pl对鼠隐藏管状线虫烯醇化酶基因预测二级结构,结果如图9所示,上行为氨基酸序列,下行为其所对应的二级结构,其中 h 代表α-螺旋(alpha helix)、e代表延伸链(extended strand)、t 代表 β-转角(beta turn)、c代表无规则卷曲(randomcoil)。预测结果表明烯醇化酶二级结构组分中,h占34.86%,e占24.08%,t占10.55%,c占30.50%。

图3 烯醇化酶氨基酸序列比对分析Fig. 3 Amino acid sequence alignment of enolase using Clustal W

图4 鼠隐藏管状线虫烯醇化酶基因疏水性分析Fig. 4 Hydrophobicity analysis of enolase from S.obvelata

图5 鼠隐藏管状线虫烯醇化酶跨膜双螺旋结构预测Fig.5 Transmembrane helices prediction for enolase from S.obvelata

图6 烯醇化酶的功能结构域Fig.6 The domains of enolase

图7 鼠隐藏管状线虫烯醇化酶基因的Motif分析Fig.7 Motif analysis of enolase from S.obvelata1∶ N端糖基化位点; 2∶ 酪蛋白激酶II磷酸化位点; 3∶ 十四酰化位点; 4∶ 蛋白激酶C磷酸化位点; 5∶ 酪氨酸磷酸化位点; 6∶ 烯醇化酶1∶ ASN glycosylation site; 2∶ CK2 phosphorylation site; 3∶ Myristyl; 4∶ PKC phosphorylation site; 5∶ TYR phosphorylation site; 6∶ Enolas

图8 鼠隐藏管状线虫烯醇化酶基因磷酸化位点分析Fig.8 Phosphorylation site analysis on enolase of Syphacia obvelata

表1 由PSORT Prediction预测的亚细胞定位Table1 Subcellular localization of enolase predicted by PSORT prediction program

图9 烯醇化酶的二级结构预测Fig.9 Secondary structure prediction of enolase from S.obvelata
2.9 鼠隐藏管状线虫烯醇化酶三级结构预测 用Swiss-Model http∶//swissmodel. expasy.org/对鼠隐藏管状线虫烯醇化酶编码氨基酸的三级结构进行预测。鼠隐藏管状线虫烯醇化酶三级结构呈现哑铃样,由linker连接两个结构域,每个结构域是由一个小的N端和一个大的C端组成,多个α-螺旋、β-折叠和卷曲所构成的桶形结构,有4个Mg2+结合位点和2个磷酸根结合位点,并位于桶形结构的中心(图10)。红色圆圈出部分即是两个催化中心,两边两个绿色点代表4个Mg2+结合位点,棒状三角锥结构代表磷酸根结合位点。

图10 鼠隐藏管状线虫三级结构预测Fig.10 3D structure of enolase in S.obvelata
3 讨论
烯醇化酶作为生物体内广泛存在的一种古老而又高度保守的基因,近几年渐渐成为研究的热门,目前在寄生虫领域研究比较多的是原虫,包括疟原虫[7,8]、弓形虫[9]、利氏曼原虫[10]、锥虫[10]等;线虫有猪蛔虫[6]、广州管圆线虫[11]、捻转血矛线虫[12]等;绦虫有细粒棘球蚴绦虫[13]、牛带绦虫[14]、亚洲带绦虫[15]等及吸虫[16]。
本研究采用RACE技术获得了长为1603 bp的鼠隐藏管状线虫的烯醇化酶基因序列,含有一个长度为1311 bp的完整ORF,预计编码436个氨基酸,蛋白分子量为47.428 kDa。经NCBI网站Blast在线分析,我们所获的基因序列与 GenBankTM中猪蛔虫和弓首蛔虫Enolase基因最接近,推测为鼠隐藏管状线虫Enolase基因,并含有完整的开放阅读框,是一个全长 cDNA 序列。
鼠隐藏管状线虫烯醇化酶的信号肽和疏水性分析表明,烯醇化酶编码的氨基酸序列中没有信号肽结构,疏水性较强。通过对其功能结构域进行分析,发现含有烯醇化酶的典型结构域和保守位点。跨膜双螺旋结构分析显示有一个潜在的跨膜双螺旋结构(aa108~125),这与Gan等[13]的研究结果一致。Gan等[13]在获得细粒棘球绦虫烯醇化酶全长序列后预测其氨基酸序列中含有一段跨膜区(aa104~124),并对绦虫烯醇化酶的免疫学特性分析,发现该酶含有大量线性B细胞表位和细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)表位。在这些表位中有2个重要肽段,即aa49~aa57和aa228~aa 236。这两个肽段均同时含有B细胞和CTL表位,分别位于跨膜区的两侧,能刺激体液免疫和细胞免疫应答。无论这种蛋白质的拓扑结构如何变化,它均可介导绦虫对宿主的免疫刺激作用,说明烯醇化酶具有较好的免疫诊断和疫苗应用前景。
Motif 是指蛋白质或 DNA 序列中局部的保守区域,或者是一个序列集中共有的一小段序列模式,也译为基序。一个蛋白质家族所有的或大多数的成员共同拥有的Motif极可能是该家族执行重要功能或组成结构不可缺少的部分。识别出一个蛋白质家族共同的Motif就能够刻画该蛋白质家族特征,从而可以利用这些特征来发掘蛋白家族新成员等[17]。通过鼠隐藏管状线虫烯醇化酶包括该蛋白motif结构以及保守区域分析发现该蛋白高度保守,且有6种Motif结构,分别是N端糖基化位点、酪蛋白激酶II磷酸化位点、十四酰化位点、蛋白激酶C磷酸化位点、酪氨酸磷酸化位点和烯醇化酶保守结构域。对其进行进一步的分析,发现有10个丝氨酸激酶磷酸化位点和3个苏氨酸激酶磷酸化位点和4个酪氨酸激酶磷酸化位点,可能成为相应蛋白激酶磷酸化的位点,说明烯醇化酶可能通过相应位点的磷酸化来实现其功能的调控。
作为重要的糖酵解催化酶,烯醇化酶存在于很多真核和原核细胞的细胞质和细胞表面,如植物乳杆菌[18]、炭疽杆菌[19],疟原虫[7,8],利士曼原虫[20]、日本血吸虫[16],尽管它不具备经典表面蛋白所拥有的信号肽,跨膜区等特点,但它还是能够在细胞表面表达,而且能在猪蛔虫的排泄/分泌物(ES)中被检测出来[21]。
本研究用PSORT软件亚细胞定位结果预测,表明烯醇化酶主要存在于细胞质,其次在过氧化物酶体,线粒体基质间隙和溶酶体上。研究表明,烯醇化酶属于一种新类型的表面蛋白,不具有表面蛋白的典型的表面转运功能,但可以通过一种未知的机制,被转运到细胞表面[22]。分布在表膜的蛋白有可能成为药物的靶分子,或是诊断抗原的候选分子。
Zhang等[11]发现广州管圆线虫烯醇化酶并不像预期所示存在于虫体表皮和真皮层中,而是大多存在于细胞质,如壁肌肉、生殖道、神经环和消化道中,这与本研究预测的烯醇化酶主要存在于细胞质中的发现一致。同时,Zhang等[11]研究发现,广州管圆线虫烯醇化酶也能在细胞核表达,表明它可能参与机体生长和发育过程的调节,可能参与其他的生物功能,而不是作为纤溶酶原的受体或者分泌性抗原组分。Ghosh等[7]发现烯醇化酶存在于疟原虫生命周期的每一个阶段。除了细胞质之外,烯醇化酶还与细胞核、食物泡、细胞骨架和离子体膜形成有关。烯醇酶的多样化定位表明,除了在糖酵解的催化作用之外,烯醇化酶可能参与许多其他生物机体的调节功能。
基于烯醇化酶在病原体物质与能量代谢、生长发育及其与免疫保护等方面的重要性,研究分析烯醇化酶的亚细胞定位和生物信息学功能预测,将有助于进一步了解鼠隐藏管状线虫的入侵机制、致病机理、能量代谢等,为鼠隐藏管状线虫病的预防、免疫诊断和药物研发等提供坚实的科学依据。
[1] Bazzano T, Restel T I, Pinto R M, et al. Patterns of infection with the nematodes Syphacia obvelata and Aspicularis tetraptera in conventionaly maintainedlaboratory mice[J]. Mem Inst Oswaldo Cruz, 2002,97(6)∶ 847-853.
[2] Carneiro C R,Postol E,Nomizo R, et al.Identification of enolase as a laminin-binding protein on the surface of Staphylococcus aureus[J]. Microbes Infec, 2004, 6(6)∶604-608.
[3] Pérez Sánchez R, Valero M L,Ramajo Hernández A, et al. A proteomic approach to the identification of tegumental proteins of male and female Schistosoma bovis worms[J]. Mol Biochem Parasitol, 2008,161(2)∶112-123.
[4] Wang X, Chen W, Hu F, et al. Clonorchis sinensis enolase∶ identification and biochemical characterization of a glycolytic enzyme from excretory/secretory products[J]. Mol Biochem Parasitol, 2011, 177(2)∶ 135-142.
[5] Wang X, Chen W, Tian Y, et al. RNAi-mediated silencing of enolase confirms its biological importance in Clonorchis sinensis[J]. Parasitol Res, 2014, 113(4)∶1451-1458.
[6] Chen N, Yuan Z G, Xu M J, et al. Ascaris suum Enolase is a potential vaccine candidate against Ascarisis in mice[J]. Vaccine, 2012, 30(23)∶ 3478-3482.
[7] Ghosh A K, Marcelo J L. Surface-expressed enolases of Plasmodium and other pathogens [J]. Mem Inst Oswaldo Cruz, 2011, 106(01)∶ 85-90.
[8] Pal-Bhowmick I, Mehta M, Coppens I, et al. Protective properties and surface localization of Plasmodium falciparum enolase[J]. Infect Immun, 2007,75(11)∶ 5500-8.
[9] Ruan J, Mouveaux T, Light S H, et al. The structure of bradyzoite-specific enolase from Toxoplasma gondii reveals insights into its dual cytoplasmic and nuclear functions[J]. Acta Crystallogr D Biol Crystallogr, 2015, 71(Pt 3)∶ 417-426.
[10] Avilán L, Gualdrón-López M, Quiñones W, et al. Enolase∶ a key player in the metabolism and a probable virulence factor of trypanosomatid parasites-perspectives for its use as a therapeutic target[J]. Enzyme Res, 2011, 932549∶ 1-14.
[11] Zhang J, Yu C, Wang Y, et al. Enolase of Angiostrongylus cantonensis∶ more likely a structural component[J]? Parasitol Res, 2014,113(11)∶ 3927-3934.
[12] Han K, Xu L, Yan R, et al. Molecular cloning, expression and characterization of enolase from adult Haemonchus contortus[J]. Res Vet Sci, 2012,92(2)∶ 259-265.
[13] Gan W, Zhao G, Xu H, et al. Reverse vaccinology approach identify an Echinococcus granulosus tegumental membrane protein enolase as vaccine candidate[J]. Parasitol Res, 2010, 106(4)∶ 873-882.
[14] 戴佳琳, 黄江, 廖兴江. 生物信息学分析牛带绦虫烯醇酶基因及其蛋白的结构和特性[J]. 热带医学杂志, 2010, 10(10)∶ 1169-1172.
[15] 黄艳, 黄江, 胡旭初, 等. 亚洲带绦虫烯醇酶基因及其蛋白质的结构与功能[J]. 中山大学学报(医学科学版), 2008, 29(5)∶ 575-580.
[16] 邱春辉. 日本血吸虫重组烯醇化酶研究[D]. 福建:福建农林大学,2009.
[17] 杜春娟,朱云平,贺福初, 等. 蛋白质家族模体(motif)的评价策略[J]. 北京生物医学工程,2005(2)∶ 19-24
[18] Salzillo M, Vastano V, Capri U, et al. Identification and characterization of enolase as a collagen-binding protein in Lactobacillus plantarum[J]. J Basic Microbiol, 2015, 55(7)∶ 890-897.
[19] Agarwal S, Kulshreshtha P, Bambah Mukku D, et al. alpha-Enolase binds to human plasminogen on the surface of Bacillus anthracis[J]. Biochim Biophys Acta, 2008, 1784(7-8)∶ 986-994.
[20] Quiñones W, Peña P, Domingo-Sananes M, et al. Leishmania mexicana∶ molecular cloning and characterization of enolase [J]. Exp Parasitol, 2007,116(3)∶ 241-251.
[21] Andrade M A, Siles-Lucas M, López-Abán J, et al. Antigens from Ascaris suum trigger in vitro macrophage NO production[J]. Parasite Immunol, 2005, 27(6)∶ 235-242.
[22] Pancholi V. Multifunctional a-enolase∶ its role in diseases[J]. Cell Mol Life Sci, 2001, (58)∶ 902-920.
CLONING AND SEQUENCE ANALYSIS OF ENOLASE GENE IN SYPHACIA OBVELATA
CHEN Ning1, WANG Ping1, CHENG Tian2, GONG Zhen-xing3, XIE Tian-zhu1, LI Jun-peng1, ZHANG Yan-zhong4, WANG Xiao-wei1, LU Yi1
(1.Shenzhen Institute for Drug Control, Shenzhen 518057, China; 2. College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642, China; 3. Lanzhou Veterinary Research Institute, CAAS, Lanzhou 730046, China; 4. Shenzhen Ruipeng Pet Hospital, Shenzhen 518000, China)
To learn the structure and function of the enolase gene of Syphacia obvelata, we fi rst obtained the full-length cDNA of enolase by using homology-based cloning together with RACE technology. The cDNA sequence was then analyzed by bioinformatics databases and software. The full-length cDNA of enolase was 1611 bp in length, with a coding region of 1311 bp. This sequence encoded a protein of 436 amino acids with a molecular weight of 47.428 kDa. The enolase contained ten serine phosphorylation sites,three threonine phosphorylation sites,four tyrosine phosphorylation sites and a potential transmembrane helices region, but no signal peptide was found in the protein. At the subcellular level, the enolase protein was mainly localized to the cytoplasm, peroxisome, mitochondrial matrix space and lysosome. The secondary structure of enolase was mainly composed of alpha helix, consisting of 34.86% helix, 30.50% random coil,24.08% extended strand, and 10.55% beta turn. Swiss-Model modulated predicted that 3D structure was like dumbbell with a linker in the middle, each substrate unit was comprised of alternatively arranged α helix-β sheet and forms a barrel, the active sites, Mg2+binding sites closely located in the center of barrel. By cloning the enolase gene and predicting its structure, character and functions,we have obtained valuable information which can be used to study the relationship between parasite and host in the future.
Enolase; Syphacia obvelata; cloning; bioinformatics analysis
S852.731
A
1674-6422(2017)01-0050-09
2016-04-19
深圳市科技研发资金知识创新计划项目(JCYJ20130402144215888)
陈宁,女,博士,主要从事药理毒理学及寄生虫病的防控
陈宁,E-mail∶ cn82cn@163.com

