PEDV和TGEV双重TaqMan荧光定量一步法RT-PCR检测方法的建立及应用
侯月娥,伍建敏,李中圣
(广东海大畜牧兽医研究院有限公司,广州 511400)
·研究论文·
PEDV和TGEV双重TaqMan荧光定量一步法RT-PCR检测方法的建立及应用
侯月娥,伍建敏,李中圣
(广东海大畜牧兽医研究院有限公司,广州 511400)
本文通过对猪腹泻病毒(Porcine epidemic diarrhea virus,PEDV)和猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)基因组生物信息学分析,分别在两种病毒基因保守区设计特异性探针和Real-Time PCR引物,并建立了检测PEDV和TGEV的双重实时荧光定量RT-PCR方法。结果表明,本研究建立的方法对其他常见病毒无交叉检出,具有较强的特异性;应用本方法对PEDV和TGEV检测灵敏度均可达101个拷贝。应用本法组装PEDV和TGEV双重实时荧光定量PCR试剂盒,该试剂盒批次内、批次间的变异系数CV(coefficient of variation,CV)分别低于0.58%和3.7%。应用该试剂盒对97份病例进行检测,阳性率提高了14.93%。本研究建立的一步法荧光定量RT-PCR方法具有快速、特异性好、灵敏度高、定量且重复性和稳定性好等优点,在PEDV和TGEV感染的快速鉴别诊断,以及流行病学调查方面都有广阔的应用前景。
猪流行性腹泻病毒;猪传染性胃肠炎病毒;双重TaqMan实时荧光定量RT-PCR
猪流行性腹泻(porcine epidemic diarrhea, P E D)和猪传染性胃肠炎(t r a n s m i s s i b l e gastroenteritis, TGE)二者均为高度接触性肠道疾病,主要发生在冬季和春季等寒冷季节,主要引起猪的呕吐、腹泻、食欲下降和脱水,各年龄段的猪均易感染。其病原分别是猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)和传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV),这两种病毒均可以破坏小肠上皮细胞而引起肠绒毛萎缩[1],对哺乳仔猪的致死率分别为30%~80%、80%~100%[2-5]。由于二者引起的临床症状、病理变化和流行病学极为相似,且往往混合感染,单凭临床症状和组织病理学难以鉴别诊断[5],近几年已成为当前常见引起猪严重腹泻的病毒,给养猪业造成了巨大的经济损失。
PEDV和TGEV两种病毒的分离、免疫组织化学和电镜等常规的诊断技术操作繁琐,耗时长且成本较高。随着分子生物学的发展,PCR检测方法,应用越来越广泛[6-11]。实时荧光定量PCR(Real-time fluorescent quantitative PCR)以及后续的TaqMan荧光探针技术,是近年来发展起来的新一代检测方法。将PCR与荧光检测方法结合,不仅特异性更强,灵敏度更高,需求的样品量更少,而且还能准确测定样品中的病毒拷贝数,在病原诊断及病理分析方面有更为广阔的应用前景。目前,国内学者也建立了PEDV和TGEV的实时荧光定量PCR检测方法[12-14],但尚未见一步法双重实时荧光定量RT-PCR技术同时检测PEDV和TGEV的报道。本研究利用TaqMan探针上不同荧光基团可以检测不同病毒的特点,将传统的RT-PCR扩增两步法合为一步,建立了能在一个反应体系中同时快速检测PEDV和TGEV的TaqMan双重荧光一步法RT-PCR检测方法。该方法不仅大大缩短了检测时间,而且也减少了检测时的操作步骤,为快速准确的掌握这两种病毒实际感染情况及预防控制提供了更加可靠的科学依据。
1 材料与方法
1.1 病毒、菌株及质粒 PEDV、猪瘟病毒(Classical swine faver virus,CSFV)、猪圆环病毒Ⅱ型(Porcine circovirus,PCV2)、TGEV、猪伪狂犬病毒(Pseudorabies virus,PRV)以及猪繁殖与呼吸综合征病毒(Porcine reproductine and respiratory synarome virus,PRRSV)均由广东海大畜牧兽医研究院保存;大肠杆菌DH5α和pMD18TM-T Vector购自宝生物工程(大连)有限公司。
1.2 主要试剂及主要仪器 体液病毒DNA/RNA小量制备试剂盒购自Axygen公司;Ribonuclease Inhibitor、M-MLV Reverse Transcriptase购自Promega公司;Premix Ex TaqTM(Probe qPCR)、αNTP均购自TaKaRa公司;琼脂糖凝胶DNA纯化回收试剂盒以及普通质粒小量提取试剂盒均购自Omega公司;T7体外转录试剂盒(In vitro Transcription T7 Kit)购自TaKaRa公司;Bio-rad C1000 荧光定量PCR扩增仪;核酸蛋白检测仪(Thermo)。
1.3 引物和探针的设计及合成 通过对PDEV和TGEV所有已知序列利用MegAlign进行同源性分析,确定其保守序列,然后根据PEDV(Genbank登录号: KJ645708)和TGEV(Genbank登录号:AF209745)的保守核酸序列,利用Beacon Designer 7设计软件,设计特异性引物和荧光探针(表1),其中标准品引物设计时在5' 端引入了T7启动子序列(加粗部分),扩增的双链DNA片段可以在T7 RNA聚合酶作用下经体外转录形成单链RNA,纯化后用作标准品RNA。引物探针由上海Invitrogen公司合成。
1.4 PEDV和TGEV总核酸提取 参照体液病毒DNA/ RNA小量制备试剂盒说明书提取PEDV和TGEV所感染细胞的总RNA,-80℃保存备用。
1.5 PEDV和TGEV标准品制备 取1.4中提取的总RNA反转录制备cDNA。应用PEDV引物PEDVT7-F/PEDV-T7-R和TGEV引物TGEV-T7-F/TGEVT7-R(见表1),以上述反转录的PEDV和TGEV基因组cDNA为模板,分别进行PEDV和TGEV目的基因扩增。扩增条件:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸45 s,共40个循环;72℃延伸10 min。反应结束后,取5 μL PCR反应产物进行琼脂糖凝胶电泳,扩增出PEDV(166 bp)和TGEV(191bp)目的基因。将获得的两者PCR产物琼脂糖凝胶电泳后,切胶回收纯化,分别克隆至pMD18-T载体中,转化到DH5α感受态细胞,筛选阳性克隆重组质粒,送Invitrogen公司测序鉴定。对于鉴定正确的重组质粒,分别命名为pMD-PEDVT7和pMD-TGEVT7[15]。按照大连宝生物公司生产的T7反转录试剂盒说明书,分别以纯化后的两种质粒为模板进行体外转录。获得体外转录RNA,将体外转录产物用RNA提取试剂盒纯化后,进行浓度测定、拷贝数计算,分装,-80℃保存备用。
1.6 TaqMan荧光定量一步法RT-PCR扩增 以提取的PEDV和TGEV的核酸RNA为模板,反应体系如下: M-MLV Buffer 2 μL、M-MLV 0.25 μL、Ex TaqTMHS 0.3 μL、2.5×dNTP 1.5μL,将引物PEDV-F、PEDV-R、TGEV-F、TGEV-R和探针稀释至终浓度为0.1~0.6 μmol/mL,模板RNA为1.5 μL,无RNase的水补足反应体系为10 μL。TaqMan实时荧光定量一步法RT-PCR扩增程序:37℃孵育5 min,95℃预变性1 min,然后95℃变性10 s,退火温度55℃~65℃30 s,40个循环。按照不同体系,不同浓度配比,不同的退火温度进行一步法实时荧光定量RT-PCR反应条件优化,筛选出最好的体系、引物、探针浓度及退火温度。
1.7 TaqMan荧光定量RT-PCR标准曲线的建立 将1.5制备的PEDV和TGEV的RNA标准品做10倍系列稀释,用不同稀释梯度的RNA作为模板,每个梯度的RNA设立3个重复。使用摸索出来的反应体系进行实时荧光定量RT-PCR扩增。荧光定量RT-PCR的反应条件:37℃孵育5 min,95℃预变性1 min,95℃变性10 s,退火温度根据1.6摸索出来的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.8 双重TaqMan荧光定量RT-PCR敏感性、特异性和稳定性试验
1.8.1 敏感性试验 将测定好RNA浓度的模板进行10倍系列稀释,用已建立的双重TaqMan荧光定量RTPCR测定其敏感性。
1.8.2 特异性试验 分别以提取的PEDV、TGEV、PRRSV、CSFV核酸RNA以及PCV2、PRV的DNA为模板,分别进行RT-PCR/PCR扩增,验证其特异性。
1.8.3 稳定性试验 在上述已经稀释好的样品中选取1×106copies/μL~1×101copies/μL,进行3次重复性试验,每个梯度浓度均做3个重复,然后比较批次内和批次间的变异系数。
1.9 临床样本的检测试验 选取经过普通PCR检测验证的PEDV和TGEV共同阳性、单独PEDV阳性或TGEV阳性,PEDV和TGEV可疑的样品分别为13份和8份,另外其他病毒也阳性的部分样品,其中动物组织31份、血清26份、感染不同代次的细胞19份,共累计样本97份。分别采用该双重TaqMan荧光定量RT-PCR检测方法进行样品阴阳性鉴定,从而验证该方法的灵敏性和特异性。
2 结果
2.1 RNA标准品的制备 应用含有T7启动子序列的PEDV-T7-F/PEDV-T7-R、TGEV-T7-F/TGEVT7-R的引物分别进行相应病毒的PCR扩增,PCR扩增产物采用2%的琼脂糖凝胶进行检测。将切胶纯化的PCR产物分别与pMD18-T载体连接,构建重组质粒pMD-PEDVT7和pMD-TGEVT7,转化至DH5α感受态细胞中,将阳性的重组质粒测序鉴定。结果显示,两对引物均能扩增出相应的目的片段(图1)。
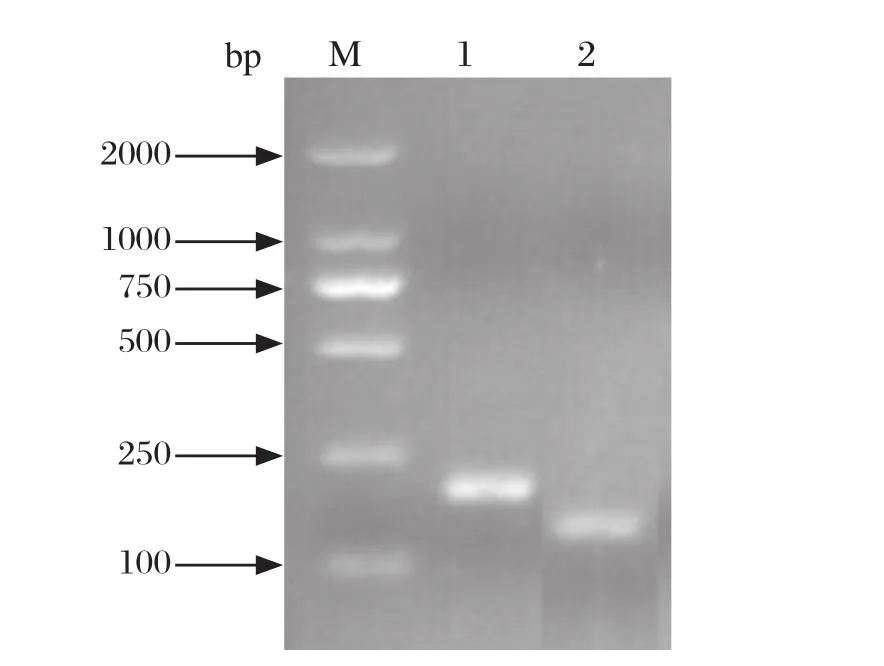
图1 PEDV和TGEV阳性重组质粒鉴定结果Fig.1 Identifi cation results of PEDV and TGEV positive recombinant plasmidsM∶ DNA分子量标准(DL2000); 1∶ TGEV基因的PCR产物; 2∶PEDV基因的PCR产物M∶ DNA Marker(DL2000); 1∶ PCR products of TGEV; 2∶ PCR products of PEDV
2.2 双重TaqMan荧光定量PCR扩增 通过对PEDV和TGEV单项和双重实时荧光定量RT-PCR的条件优化,PEDV-F/PEDV-R的终浓度为0.35 μmol/mL,探针终浓度为0.3 μmol/mL,TGEV-F/TGEV-R的终浓度为0.3 μmol/mL,探针终浓度为0.2 μmol/mL,退火温度为60℃时,对同一标准品的检测信号值最强,Ct值最小。
2.3 双重TaqMan荧光定量PCR标准曲线的建立 PEDV和TGEV的荧光定量PCR反应标准品,其RNA混合液的梯度浓度从1×106copies/μL~1×101copies/μL的6个线性梯度的检测标准曲线呈等距性和平行性,具有较好的梯度性(图2)。
2.4 双重TaqMan荧光定量PCR特异性、敏感性以及稳定性
2.4.1 特异性试验 以PRRSV、CSFV、PEDV、TGEV、PCV2、PRV的基因组为模板进行TaqMan荧光定量RT-PCR扩增,结果显示,仅有PEDV、TGEV二者相应病毒的荧光信号为阳性,其他病毒的检测均为阴性,说明此次构建的双重TaqMan荧光定量RT-PCR方法的特异性较强(图3)。
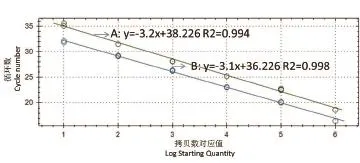
图2 PEDV(A)和TGEV(B)的Real-time RT-PCR标准曲线Fig.2 Real-time RT-PCR standard curve for PEDV(A) and TGEV(B)
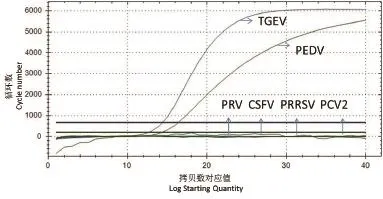
图3 双重荧光RT-PCR体系的特异性检测Fig.3 Specifi city test of the Real-time RT-PCR system for PEDV和TGEV detection
2.4.2 敏感性试验 将体外转录纯化后的PEDV和TGEV的RNA标准品,用核酸蛋白检测仪测定其浓度,计算其拷贝数,然后进行10倍系列梯度稀释,获得1×106copies/μL~1×101copies/μL,利用本研究建立的一步法PEDV和TGEV双重实时荧光定量进行扩增,得到PEDV和TGEV TaqMan探针法实时荧光定量RT-PCR的动力学扩增曲线(图4),在Ct<40范围内可以检出的最低RNA量为10 copies/μL,因此建立的此方法敏感性可以达到10 copies/μL。与本实验室前期构建的检测PEDV和TGEV普通PCR及SYBR Green Real-time PCR法相比较,是普通PCR法敏感性的100倍(图5),SYBR Green Real-time PCR敏感性的10倍,并且检测结果较SYBR Green Real-time PCR法方法稳定。
2.4.3 稳定性试验 荧光定量RT-PCR反应标准品的梯度浓度从1×106copies/μL~1×101copies/μL的6个浓度,通过每一个浓度样本的3次重复性试验测定的Ct值来检验该方法的稳定性。结果显示,同批内的变异系数分别为0.05%、0.58%、0.16%、0.09%、0.41%、0.32%;批间的变异系数分别为1.8%、2.7%、3.3%、2.4%、3.2%、3.7%(表2)。将混合好的标准品存放于-80℃,1个月后重复检测结果依然可信,验证了该方法具有良好的重复性和稳定性。

图4 荧光定量RT-PCR体系的敏感性检测Fig.4 Sensitivity of the Real-time RT-PCR for PEDV and TGEV detection注∶ PEDV (a至f) 和 TGEV (1至6)模板拷贝数依次∶ 1×106、1×105、1×104、1×103、1×102和1×10Note∶ PEDV (a to f) and TGEV (1 to 6), and the number of copies were 1×106, 1×105, 1×104, 1×103, 1×102and 1×10 copies,respectively
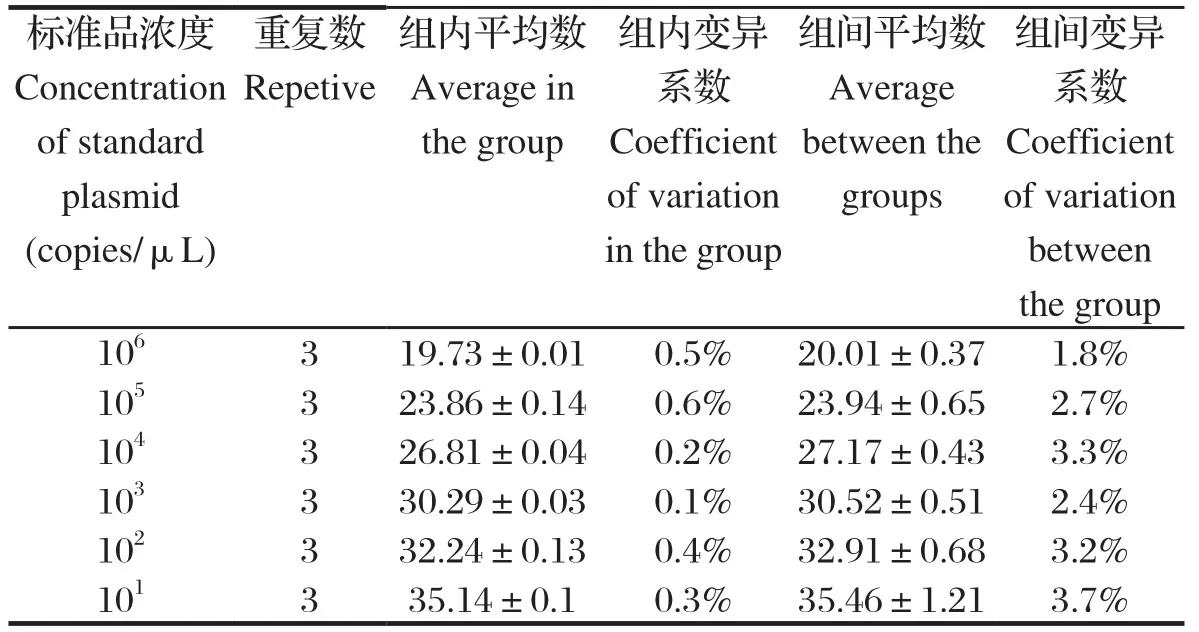
表2 PEDV和TGEV双重荧光定量PCR重复性试验Table 2 Repetitive and stability verifi cation of PEDV and TGEV duplex fl uorescence quantitative PCR
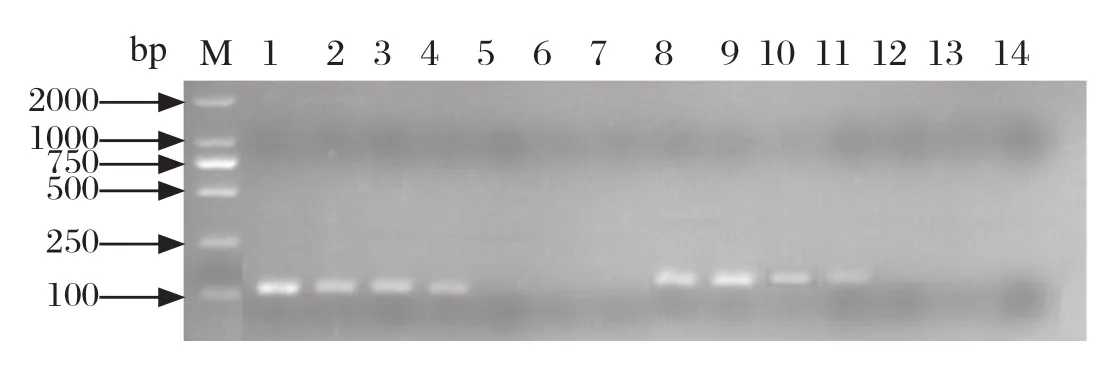
图5 普通RT-PCR PEDV和TGEV标准品敏感性检测Fig.5 Sensitivity test of the normal PCR for PEDV and TGEV注∶ PEDV(1至7)和TGEV(8至13)拷贝数依次为∶ 1×106、1×105、1×104、1×103、1×102、1×10; 14∶ 阴性对照; M∶ DNA分子量标准(DL2000)Note∶ PEDV(1 to 7) and TGEV(8 to 14), and the number of copies were 1×106, 1×105, 1×104, 1×103, 1×102, 1×10 copies, respectively; 14∶ Negative; M∶ DNA Marker(DL2000 )
2.5 临床样本检测结果 对76份普通PCR鉴定的已知临床病料和21份可疑临床病料进行检测结果显示,PEDV和TGEV共同阳性7份,病毒拷贝数在3.1×103~9.7×107copies/μL(超过以及等于106copies/μL的样品,均102倍稀释后再次检测),感染率为7.2%;单PEDV阳性的47份,病毒拷贝数为1.3×101~9.1×109copies/μL,感染率为48.45%;单TGEV阳性13份,病毒拷贝数为1.5×101~7.5×107copies/μL,感染率为13.4%;21份可疑的病料检测结果显示,感染PEDV的7份,感染TGEV的3份,其他样品为阴性,与已知样品结果的符合率为114.93%。
3 讨论
PEDV和TGEV作为猪病毒性腹泻的主要病原,近年来引起的猪病毒性腹泻在国内外的各大猪场反复爆发,给养猪业造成了巨大的经济损失。目前常规的病毒诊断方法有病毒分离、荧光抗体检测、血清学诊断方法和免疫组织化学以及PCR方法等,由于病毒分离困难,PCR方法具有快速、特异、准确等优点,现己经广泛应用于畜禽传染病的快速诊断。上述诊断方法在特异性上尚存在一定的缺陷,在敏感性方面对早期感染往往不能做出准确的判定。单一的RT-PCR方法用于多种病毒感染的临床鉴别诊断时,不能一次达到目的,并且因为需要对不同检测病毒分别进行扩增,样品需求量较大,耗时较长。疾病的严重程度与病毒的含量相关,传统的检测方法很难准确测定样品中的病毒含量,因此实时荧光定量RT-PCR方法不仅在定量研究中具有重要意义,而且在检测病毒存在及其在疾病发展过程中病毒对机体持续性作用方面的也起重要作用[16]。
PEDV和TGEV多重实时荧光定量RT-PCR的文献已有陆续的报道[17],而一步法PEDV和TGEV双重TaqMan实时荧光定量RT-PCR方法目前没有报道。本研究建立方法存在显著优势:不需要反转录,提取的RNA可以直接做为模板检测,并能一次确诊单一感染或混合感染,可以准确得知两种病毒在疾病感染中拷贝数的变化情况,达到诊断、鉴别和定量的多重目的,比传统检测方法更准确便快捷。
本研究对PEDV和TGEV分别设计1条探针和与探针匹配的2对特异性引物,通过优化单项试验选取与探针匹配更好的一对特异性引物,然后再对多重实时荧光定量RT-PCR反应条件进行优化。将提取的PRRSV、CSFV、PEDV、TGEV核酸RNA以及PCV2、PRV的DNA模板进行实验,仅有目的曲线扩增,其余均为阴性,说明具有良好的特异性。敏感性试验的结果显示可以检出的最低RNA量可达到101copies/μL,R2>99%,具有较好的标准曲线和线性关系。与常规的RT-PCR反应和已构建的SYBR Green方法比较,是普通RT-PCR的100倍,已构建的SYBR Green方法的10倍。稳定性试验的结果显示批次内的变异系数≤0.58%,批次间的变异系数均≤3.7%,说明该方法具有较好的重复性和稳定性。本研究建立的双重实时荧光定量RT-PCR方法只需要较少的样品就可以对PEDV和TGEV进行准确的定性和定量检测,弥补了传统检测方法在重复性和耗时长的不足,同时具有较高的特异性,可以避免临床样品中其他病原的干扰。临床发病中PEDV和TGEV二者混合感染比例较高,且在腹泻病例中占较高的比例,本研究所建立的方法适用于临床PEDV和TGEV的快速检测诊断及病理分析。
[1] Debouck P, Pensaert M. Experimental infection of pigs with a new porcine enteric coronavirus, CV777 [J]. Am J Vet Res, 1980, 41(2)∶ 219-223.
[2] 郑逢梅, 霍金耀, 赵军, 等. 2010~2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J]. 病毒学报, 2013, 2(29)∶197-205.
[3] Shibata I, Ono M, Mori M. Passive protection against porcine epidemic diarrhea (PED) virus in piglets by colostrums from immunized cows [J]. J Vet Med Sci, 2001, 63(6)∶ 655-658.
[4] Pritchard G C, Paton D J, Wibberly G, et al. Transmissible gastroenteritis and porcine epidemic diarrhoea in Britain [J]. J Vet Res, 1999, 144(22)∶ 616-618.
[5] Chae C, Kim O, Cho C, et al. Prevalence of porcine epidemic diarrhoea virus and transmissible gastroenteritis virus in Korea pigs [J]. J Vet Res, 2000,147∶ 606-608.
[6] Song D S, Kang B K, Oh J S, et al. Multiplex reverse transcription PCR for rapid differential detection of porcine epidemic diarrhea virus, transmissible gastroenteritis, and porcine group A rotavirus [J]. J Vet Diagn Invest, 2006, 18(3)∶ 278-281.
[7] Kim S Y, Song D S, Park B K. Differential detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus by duplex RT-CR [J]. J Vet Diagn Invest, 2001, 13(6)∶ 516-520.
[8] Kwon C H , Lee J G, Han M G, et al. Rapid diagnosis of porcine epidemic diarrhea virus infection by polymerase chain reaction [J]. J Vet Med Sci, 1997, 59(3)∶ 231-232.
[9] Rodak L, Smid B, Nevorankova Z, et al. Verification of sensitivity and specificity of group A rotavirus detection in piglets faeces with monoclonal blocking ELISA methods [J]. J Vet Med B, 2004, 51(4)∶160-165.
[10] Rodak L, Valicek L, Smid B, et al. An ELISA optimized for porcine epidemic diarrhoea virus detect ion in faeces [J]. Vet Microbiol, 2005, 105(1)∶ 9-17.
[11] Elsch N M, Prudlo J, Hotzel H, et al. Nested reverse transcriptase polymerase chain reaction for the detection of group A rotavirus [J]. J Vet Med, 2002, 49(2)∶ 77-81.
[12] 王金良, 郭显坡, 魏凤, 等. SYBR Green实时荧光定量PCR检测猪流行性腹泻病毒方法的建立及应用[J]. 中国兽医学报, 2010, 30(10)∶ 1286-1290.
[13] 张雪, 杨倩, 于红欣, 等. 猪传染性胃肠炎病毒实时荧光定量PCR检测方法的建立与应用[J]. 中国兽医科学, 2015(6)∶ 644-648.
[14] 刘邓, 袁秀芳, 冉多良, 等. TaqMan荧光定量PCR检测猪流行性腹泻病毒方法的建立与初步应用[J]. 中国动物传染病学报, 2010, 18(1)∶ 28-34.
[15] 侯月娥, 伍建敏, 何永龙, 等. 猪PRRSV和PCV2双重TaqMan荧光定量PCR检测方法的建立及应用[J].中国预防兽医学报, 2016, 38(3)∶ 221-225.
[16] 陈小金. PEDV、TGEV、PORV、SYBR GreenI 实时荧光PCR诊断方法的探索[D]. 北京∶ 中国农业科学院,2010.
[17] Seong H K, In J K, Hyun M P, et al. Multiplex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus [J]. J Virol Methods, 2007, 146(1-2)∶ 172-177.
DEVELOPMENT OF ONE STEP DUPLEX TAQMAN REAL-TIME PCR ASSAY FOR DETECTION OF PORCINE EPIDEMIC DIARRHEA VIRUS AND TRANSMISSIBLE GASTROENTERITIS VIRUS
HOU Yue-e, WU Jian-min, LI Zhong-sheng
(Guangdong Haid Institute of Animal Husbandry & Veterinary, Guangzhou 511400, China)
In the present study, one step duplex TaqMan fl uorescent real-time RT-PCR assay of PEDV and TGEV was developed to detect and differentiate Porcine epidemic diarrhea virus, (PEDV) and Transmissible gastroenteritis virus, (TGEV). The specifi c primers and TaqMan fl uorescent probes of these viruses were designed based on the bio-information analysis and then the amplifi cation condition and the concentration of each virus were optimized. The result showed that the detection limits were 101copies for both PEDV and TGEV and there was no cross reaction with other common viruses. Subsequently, one step Duplex TaqMan Real-time PCR assay was assembled into the PEDV and TGEV Detection Kit. The inter and intra-assay trials demonstrated that the variations were less than 0.58% and 3.7%, respectively, indicating its good reproducibility. Total 97 samples were examined using this kit and the positive rate of PEDV and TGEV was 14.93% higher than the current PCR method. These results demonstrated that this assay was a rapid, specifi c and sensitive method for detection of PEDV and TGEV. In conclusion, the method established in the present study can be used for rapid detection and epidemiology study of PEDV and TGEV.
Porcine epidemic diarrhea virus; Transmissible gastroenteritis virus; duplex TaqMan real-time RT-PCR
S852.659.6
A
1674-6422(2017)01-0019-07
2016-05-03
广东省科技计划项目——猪伪狂犬突变株的鉴定及新型、高效猪伪狂犬疫苗开发与产业化(2015B020203006)
侯月娥,女,硕士,主要从事畜禽和水产疫病及病疫防治技术方面的研究
李中圣,E-mail:Lizs@haid.com.cn

