绿原酸对人白血病阿霉素耐药株K562/ADM细胞多药耐药的影响及其机制
任秀敏,贾秀红,朱聪,段培锋(滨州医学院附属医院,山东滨州 256603)
绿原酸对人白血病阿霉素耐药株K562/ADM细胞多药耐药的影响及其机制
任秀敏,贾秀红,朱聪,段培锋
(滨州医学院附属医院,山东滨州 256603)
目的 观察绿原酸对人白血病阿霉素耐药株K562/ADM细胞多药耐药的影响,进一步探讨其作用机制。方法 取对数生长期的人白血病细胞株K562细胞和K562/ADM细胞,将不同浓度(2~64 μmol/L))的绿原酸作用于K562/ADM 细胞24 h后,采用MTT法检测绿原酸内在细胞毒性及对阿霉素(Adr)的增敏作用,并计算逆转倍数;流式细胞术检测经绿原酸处理后K562/ADM 细胞内Adr和罗丹明123平均荧光强度;Western blotting法检测细胞多药耐药相关蛋白(MRP1)、P糖蛋白(P-gp)、t-Akt、p-Akt蛋白表达。结果 筛选出细胞抑制率<10%时的绿原酸浓度为4 μmol/L以内,即为无毒剂量。绿原酸2、4 μmol/L及Adr作用K562/ADM细胞后的逆转倍数分别为1.65、2.21倍。K562/ADM细胞内Adr平均荧光强度为184±22,用2、4 μmol/L绿原酸处理K562/ADM细胞,加入Adr后,其荧光强度分别为223±26、326±35,绿原酸干预前后荧光强度比较,P均<0.05。绿原酸干预K562/ADM后细胞内MDR1、p-Pg、t-Akt、p-AKT蛋白表达受抑(P均<0.05),2、4 μmol/L绿原酸处理K562/ADM细胞24 h后,MRP1、P-gp、p-Akt蛋白相对表达量分别为(77.34±1.143)%、(59.63±0.658)%、(37.41±0.575)%和(66.12±1.102)%、(51.33±0.658)%、(32.41±0.575)%。结论 绿原酸体外可有效逆转K562/ADM细胞多药耐药,其相关分子机制可能通过下调P13K/Akt信号通路抑制MRP1、P-gp蛋白表达实现。
白血病;绿原酸;多药耐药;K562/ADM细胞
白血病占所有恶性肿瘤的4%,目前治疗的主要手段仍是化疗,但由于多药耐药(MDR)的产生,白血病5年生存率仅为50%,因此,逆转MDR是白血病治疗中亟待解决的问题[1]。绿原酸是由咖啡酸与奎尼酸形成的缩酚酸,是植物在有氧呼吸过程中经莽草酸途径产生的苯丙素类化合物,具有抗氧化、抑菌、抗炎、降糖、免疫调节等多种功效[2]。近年研究发现,绿原酸能抑制乳腺癌、结直肠癌、肝癌等肿瘤细胞的生长[3~6],但绿原酸是否具有逆转白血病MDR功能,目前尚不明确。2015年10月,我们体外观察绿原酸对人慢性髓系白血病细胞阿霉素耐药株K562/ADM MDR的逆转作用,并分析相关作用机制,为绿原酸与其他化疗药物联合治疗白血病提供理论依据。
1 材料与方法
1.1 材料绿原酸(纯度>98%,大连美仑生物技术有限公司),人慢性髓系白血病细胞株K562(滨州医学院中心实验室),人慢性髓系白血病细胞阿霉素耐药株K562/ADM (中国医学科学院血液学研究所),RPMI1640培养基、胎牛血清(美国Hyclone公司),四甲基唑蓝(MTT,美国Sigma公司),用PBS配成5 g/L、4 ℃避光保存,罗丹明123(Rhl23,华美公司),二甲基亚砜(DMSO,美国Gibco公司),阿霉素(Adr,北京博奥森生物技术有限公司),兔抗多药耐药相关蛋白(MRP1)、P糖蛋白(P-gp)、t-Akt、p-Akt、GADPH多克隆抗体(美国Abcam公司)。
1.2 耐药倍数测定 采用MTT法。将K562、K562/ADM细胞置于含10%胎牛血清、100 U/mL青霉素、链霉素的RPMI1640培养基中,培养于37 ℃、5%CO2、饱和湿度的无菌培养箱,每2~3 d传代1次,用4 μg/mL的Adr维持K562/ADM细胞的耐药性,实验开始前1周用不含Adr的RPMI1640培养基进行常规培养。取对数生长期的K562细胞和K562/ADM细胞,接种于96孔板,每孔细胞数均为4×103/孔,分别加入不同浓度Adr(K562细胞:0.2~3.2 mg/L,K562/ADM细胞:8~128 mg/L),每个浓度设5个平行复孔,另设空白组(未加药),放于37 ℃、5%CO2、饱和湿度的无菌培养箱培养24 h后,每孔加入MTT(5 g/L)20 μL溶液培育4 h,4 ℃平板离心机离心10 min后,弃上清,每孔加入DMSO 150 μL,避光振荡裂解15 min后,于570 nm波长处检测各孔吸光度(A)值。计算半数抑制浓度(IC50)和耐药倍数(耐药倍数=耐药细胞株IC50/敏感细胞株IC50),独立重复实验3次。
1.3 绿原酸无毒剂量的筛选 取对数生长期的K562/ADM细胞,随机分为实验组与对照组,接种于96孔培养板中,细胞数4×103/孔,实验组加入不同浓度的绿原酸(2、4、8、16、32、64 μmol/L)100 μL,对照组予等量RPMI1640培养基,培养24 h后,测570 nm波长处的A值。计算绿原酸各个浓度下的细胞抑制率:细胞抑制率(IR)=[1-(实验组A均值/对照组A均值)]×100%,筛选出细胞抑制率<10%时的绿原酸浓度,即为无毒剂量。独立重复实验3次。
1.4 逆转耐药倍数检测 采用MTT法。K562/ADM细胞接种和培养方法同1.2,每孔加入不同浓度的Adr(2、4、8、16、32 μg/mL),分单用Adr组,Adr与不同浓度绿原酸(2、4 μmol/L)合用组,MTT法测定吸光度(A)值。计算逆转倍数,逆转倍数=单用Adr IC50/Adr与绿原酸合用IC50。
1.5 Adr胞内蓄积实验 参考文献[7,8]方法,取对数生长期K562/ADM细胞,调整细胞浓度2×105/mL,随机分为四组,K562/ADM组、K562/ADM+Adr组、K562/ADM+绿原酸(2 μmol/L)+Adr组、K562/ADM+绿原酸(4 μmol/L)+Adr组加入相应浓度药物,接种于6孔板,置于37 ℃、5%CO2无菌培养箱中避光培育1 h,加入终浓度为3 mg/L Adr,继续培养1 h后,用冷PBS洗涤2次除去游离Adr,用流式细胞仪检测细胞内Adr激发的平均荧光强度,激发波长485 nm,发射波长585 nm,以相对荧光强度表示Adr浓度。独立重复实验3次。
1.6 P-gp功能检测 采用罗丹明蓄积和外排实验,对照组加入终浓度为2 mg/L 罗丹明123(Rh123),实验组在对照组基础上分别加入浓度为2、4 μmol/L的绿原酸,放于37 ℃、5%CO2培养箱中避光孵育1.5 h后,冷PBS洗涤2次除去游离Rh123,流式细胞仪测定细胞内Rh123被激发的相对荧光强度(激发波长485 nm,发射波长535 nm),以平均荧光强度(MFI)表示Rh123浓度。独立重复实验3次。
1.7 MRP1、P-gp、t-Akt,p-Akt表达检测 采用Western blotting法。取对数生长期K562/ADM细胞,5×105/孔接种于6孔板,不加或加不同浓度(2、4 μmol/L)的绿原酸培养24 h后,提取细胞总蛋白,煮蛋白后取50 μg进行电泳,转膜,用7.5%的脱脂奶粉封闭2 h后,TBST洗膜,加1∶200稀释的兔抗人多克隆抗体P-gp、MRP1、p-Akt及1∶500稀释的兔抗人多克隆抗体GADPH,置4 ℃摇床过夜,用化学发光试剂显色,使用Chemiscope 软件分析图像,MRP1、P-gp、t-Akt、p-Akt蛋白的相对表达量用MRP1、P-gp、t-Akt、p-Akt灰度值/GADPH灰度值表示。独立重复实验3次。
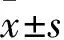
2 结果
2.1 K562/ADM细胞的耐药倍数 K562、K562/ADM细胞经Adr处理24 h后,IC50分别为(1.68±0.79)、(61.38±2.23)μmol/L,与敏感株K562细胞相比,耐药株K562/ADM细胞对Adr的杀伤作用表现出明显的耐受性,耐药倍数为36.54倍。
2.2 筛选出的绿原酸无毒剂量 绿原酸在所有测试剂量下对K562/ADM细胞的生长抑制作用呈剂量依赖性,浓度为2 μmol/L生长抑制率<5%,浓度为4 μmol/L生长抑制率<10%。筛选出细胞抑制率<10%时的绿原酸浓度为4 μmol/L以内,即为无毒剂量。
2.3 绿原酸对K562/ADM细胞耐Adr的逆转倍数 相同Adr浓度剂量下,与绿原酸合用后,Adr对K562/ADM耐药株的细胞抑制作用提高,Adr对耐药白血病细胞的毒性增强,且增强效果与绿原酸呈浓度依赖性。K562/ADM + Adr组、K562/ADM+绿原酸(2 μmol/L)+ Adr组、K562/ADM +绿原酸(4 μmol/L)+ Adr组IC50分别为(55.98±2.31)、(32.54±1.48)、(25.38±0.98)μmol/L,K562/ADM +绿原酸(2 μmol/L)+ Adr组、K562/ADM+绿原酸(4 μmol/L)+Adr组逆转倍数分别为1.65、2.21倍。
2.4 细胞内Adr激发的平均荧光强度比较 K562细胞内Adr平均荧光强度明显高于K562/ADM细胞,K562/ADM细胞内Adr平均荧光强度为184±22。用2、4 μmol/L绿原酸处理K562/ADM细胞,加入Adr后,其荧光强度分别为223±26、326±35,2、4 μmol/L绿原酸可显著增加K562/ADM细胞内Adr蓄积,分别为对照组1.21和1.77倍,呈剂量依赖性。
2.5 P-gp功能变化 将K562/ADM与Rh123共同孵育后,K562/ADM细胞内Rh123荧光强度为513±18,绿原酸处理K562/ADM细胞,加入Rh123后,测定其荧光强度,分别为713±25、929±37,绿原酸各浓度(2、4 μmol/L)均可显著增加K562/ADM细胞内Rh123蓄积,分别为对照组的1.39、1.81倍,并呈剂量依赖性。
2.6 绿原酸干预后K562/ADM细胞MRP1、P-gp、p-Akt蛋白表达变化 绿原酸干预后细胞内MDR1、p-Pg、t-Akt、p-AKT蛋白表达受抑,绿原酸(2、4 μmol/L)处理K562/ADM细胞24 h后,MRP1、P-gp、p-Akt蛋白相对表达量分别为(77.34±1.143)%、(59.63±0.658)%、(37.41±0.575)%和(66.12±1.102)%、(51.33±0.658)%、(32.41±0.575)%。
3 讨论
白血病是严重威胁人类健康的恶性肿瘤,化学疗法为其治疗的重要手段,白血病细胞MDR的产生是导致化疗失败的主要原因[9],探讨白血病的MDR相关机制并寻找有效的逆转剂有重要意义。中药毒性低,能与化疗药物联合使用,是近年国内研究的热点[10]。绿原酸存在于高等双子叶植物和蕨类植物中,具有广泛的药理作用。研究发现,绿原酸对乳腺癌、结直肠癌、肝癌具有抑制作用[3~6],抗肿瘤作用逐渐被重视,但其是否能逆转白血病MDR尚不清楚。K562/ADM细胞株由逐步增加培养基中阿霉素浓度建立的人白血病耐药细胞株,能稳定表达P-gp。本实验结果显示,K562/ADM细胞经浓度为 2~64 μmol/L的绿原酸处理 24 h 后,细胞生长均不同程度受抑制,并呈剂量依赖性。用MTT法检测浓度分别为2、4 μmol/L 的绿原酸与阿霉素联合处理K562/A02细胞后,IC50明显下降,逆转倍数分别为1.65、2.21倍,胞内阿霉素和Rh123蓄积实验显示,2、4 μmol/L 的绿原酸能增加细胞内阿霉素、Rh123蓄积。上述结果提示绿原酸具有逆转白血病MDR的作用,但具体作用机制仍不明确。
目前研究表明,化疗药物外排增加是产生MDR的原因之一,其主要机制为ABC转运子表达增多,如P-gp、MRP1等[8,11]。P-gp位于细胞膜上,是由ABCBl(MDRl)基因编码的有机阳离子泵,能与蒽环类及鬼臼碱类药物等多种药物结合,以耗能方式主动将药物从细胞泵出,降低细胞内药物浓度,使其免受化疗药物的杀伤而产生耐药性;MRP1由MRP1基因编码,同P-gp具有结构相似性,亦具有将多种化疗药物由胞内转运至胞外的功能,与临床耐药有关[12]。P13K/Akt是细胞内重要的信号传导通路,在白血病MDR中发挥重要作用,研究发现,在肿瘤细胞中,高活化P13K/Akt信号通路通过上调ABC结合膜蛋白促进药物外排,尤其与P-gp和 MRP1密切相关,阻断PI3K/Akt信号通路导致下游P-gp和 MRP1表达下调,增强肿瘤细胞对化学药物的敏感性[13]。Rh123是P-gp特异性荧光底物,能间接反映化合物与P-gp结合活性及对P-gp功能抑制作用。我们将绿原酸与阿霉素联合处理K562/ADM细胞后,可增加Rh123在K562/ADM细胞内的蓄积,提示P-gp的外排功能受到抑制,继而采用Western blotting法在蛋白水平探究绿原酸对P-gp及MRP1表达的影响,结果显示联合处理后的K562/ADM细胞内P-gp蛋白和MRP1蛋白表达降低,p-Akt表达降低,提示绿原酸通过PI3K/Akt信号通路下调P-gp和MRP1表达。
综上所述,绿原酸能抑制K562/ADM细胞生长并逆转其MDR,作用机制可能是通过PI3K/Akt信号通路下调P-gp和MRP1表达实现。
[1] Cao R, Wang Y, Huang N. Discovery of 2-Acylaminothiophene-3-Carboxamides as Multitarget Inhibitors for BCR-ABL Kinase and Microtubules[J]. J Chem Inf Model ,2015,55(11):2435-2442.
[2] 吴卫华,康桢,欧阳冬生,等.绿原酸的药理学研究进展[J].天然产物研究与开发,2006,18(4):691-694.
[3] 孙秋艳,刘艳,汪茜,等.绿原酸对Lewis肺癌小鼠及人A549 肺癌的实验研究[J].华西药学杂志,2010,25(5):536-538.
[4] 刘馨,陈晓群,李佳,等.绿原酸对MCF一7细胞增殖的影响及机制探讨[J].山东医药,2010,50(47):12-14.
[5] 叶晓林,刘艳,邱果,等.绿原酸对小鼠EMT一6乳腺癌抑制作用研究[J].中药药理与临床,2012,28(1):5l-52.
[6] 萧海容,刘艳,孙秋艳,等.绿原酸抗小鼠CT26结肠癌作用的研究[J].华西药学杂志,2012,27(3):269-271.
[7] Tsai CF, Yeh WL, Chen JH, et al. Osthole suppresses the migratory ability of human glioblastoma multiforme cells via inhibition of focal adhesion kinase-mediated matrix metalloproteinase-13 expression[J]. J Int J Mol Sci, 2014,15(3):3889-3903.
[8] Xu XM, Zhang Y, Qu D, et al. Osthole suppresses migration and invasion of A549 human lung cancer cells through inhibition of matrix metalloproteinase-2 and matrix metallopeptidase-9 in vitro[J]. J Mol Med Rep, 2012,6(5):1018-1022.
[9] Xu X, Zhang Y, Li W, et al. Wogonin reverses multi-drug resistance of human myelogenous ieukemia K562/A02 cells via downregulation of MRP1 expression by inhibiting Nrf2/ARE signaling pathway[J]. J Biochem Pharmacol, 2014,92(2):220-234.
[10] 田春艳,张凤春,林玉梅,等.中药功劳木逆转K562/ADM,MCF7/ADM细胞的作用[J].第四军医大学学报,2004,25(3):236-239.
[11] Wang XB, Wang SS, Zhang QF, et al. Inhibition of tetramethylpyrazine on P-gp, MRP2,MRP3 and MRP5 in multidrug resistanthuman hepatocellular carcinoma cells[J]. J Oncol Rep, 2010,23(1):211-215.
[12] Cao H, Dronadula N, Rao GN. Thrombin induces expression of FGF-2 via activation of PI3K-Akt-Fra-1 signaling axis leading to DNA synthesis and motility in vascular smooth muscle cells[J]. J Am Physiol Cell Physiol, 2006,290(1):C172-182.
[13] Mathisen MS, Kantarjian HM, Cortes J, et al. Mutant BCR-ABL clones in chronic myeloid leukemia[J]. J Haematologica, 2011,96(3):347-349.
山东省自然科学基金资助项目(ZR2014HL032);山东省医药卫生科技发展计划项目(2014WS0183)。
贾秀红(E-mail:jiaxiuhong001@163.com)
10.3969/j.issn.1002-266X.2017.25.014
R733.7
A
1002-266X(2017)25-0045-03
2016-11-06)

