青蒿琥酯对人肺腺癌细胞系A549增殖的抑制作用及机制
马宏境,曾妮,黄少祥(天津市第五中心医院,天津300450)
青蒿琥酯对人肺腺癌细胞系A549增殖的抑制作用及机制
马宏境,曾妮,黄少祥
(天津市第五中心医院,天津300450)
目的 观察青蒿琥酯对人肺腺癌细胞系A549增殖的抑制作用,并探讨其作用机制。方法 常规培养A549细胞后,不同浓度(0、25、50、75、100 μmol/L)的青蒿琥酯作用A549细胞,采用CCK-8法检测青蒿琥酯对A549细胞的增殖抑制率,Western blotting法检测mTOR信号通路关键分子和自噬相关蛋白p62、LC3B表达变化。结果 25 μmol/L及以上浓度的青蒿琥酯可抑制A549细胞增殖,并呈时间和浓度依赖性(P均<0.05)。不同浓度(0、25、50、75、100 μmol/L)的青蒿琥酯作用A549细胞48 h可降低p62表达,增加LC3B表达,并降低mTOR信号通路关键分子的表达,并呈剂量依赖性。青蒿琥酯联合自噬抑制剂3-MA可增加A549细胞的生存率(P<0.05)。结论 青蒿琥酯可能通过下调mTOR信号通路关键分子表达、诱导A549细胞发生自噬从而抑制A549细胞增殖。
肺肿瘤;青蒿琥酯;细胞自噬;细胞增殖;雷帕霉素靶蛋白
青蒿琥酯是从黄花蒿叶中提取的单体成分[1],能治疗疟疾,具有抗肿瘤的功效。研究表明,青蒿琥酯主要通过促进肿瘤细胞凋亡、产生氧化应激反应、减少局部肿瘤组织的血管形成、诱导细胞发生自噬反应及增强机体免疫力等途径发挥抗肿瘤作用[2~5]。多项研究表明,不同的试验条件下,自噬能促进细胞存活或抑制细胞生长[6~9],因此,可通过调节自噬的发生及程度来促进人体正常细胞的存活,诱导肿瘤细胞死亡。哺乳动物雷帕霉素靶蛋白(mTOR)是细胞能量代谢研究领域一个重要调节靶点,位于PI3K/Akt信号通路的下游,在自噬调节中发挥重要作用[10]。mTOR能感知细胞内的营养状况,根据细胞内氨基酸和ATP含量的变化来调节细胞本身的自噬水平[11]。核糖体蛋白S6是mTOR复合物1(mTORC1)下游的主要效应分子,通过其表达变化能说明mTOR活性表达水平[12]。目前国内外研究多采用p62及微管相关蛋白1轻链3(LC3)作为自噬发生的分子标记物[13,14]。2015年6月~2016年6月,本研究观察了青蒿琥酯对人肺腺癌细胞系A549增殖的抑制作用,并探讨其作用机制。
1 材料与方法
1.1 材料 青蒿琥酯由广东新南方青蒿科技有限公司提供,用倍比稀释法调整药物浓度。人肺腺癌细胞系A549购于北京协和基础医学研究所细胞中心。胎牛血清购于Gibco公司;DMEM基础培养液购于美国Hyclone 公司;自噬抑制剂3-MA购于Sigma公司;β-actin抗体购于北京中杉金桥生物技术有限公司;S6、phospho-S6、LC3B、P62抗体购于Cell Signaling Technology公司,HRP-标记的羊抗鼠/兔购于Santa Cruz公司,Cell counting kit-8(CCK-8试剂盒)购于日本同仁化学研究所。
1.2 细胞培养 A549细胞于含10% FBS的DMEM培养基中培养,培养条件为37 ℃、5% CO2,饱和湿度。间隔48~72 h传代。
1.3 A549细胞增殖抑制率检测 采用CCK-8法。制备A549细胞悬液,调整细胞为3×107/L,置于96孔板,每孔100 μL。于培养24 h细胞完全贴壁后随机分为两部分。一部分随机分为5组,分别加入0、25、50、75、100 μmol/L青蒿琥酯100 μL;另一部分随机分为5组,分别加入0、25、50、75、100 μmol/L青蒿琥酯,同时加入3 mmol/L 3-MA,各组均设置10个复孔。分别作用24、48、72 h,用CCK-8试剂盒检测A549细胞存活情况。用酶标仪测量波长450 nm的吸光度值,计算细胞增殖抑制率。细胞增殖抑制率=[1-(AX-A)/(A0-A)]×100%。AX为加药孔OD值,A为未加细胞,单纯药物的OD值;A0为未加药物的OD值。青蒿琥酯IC50使用SPSS17.0软件进行计算。
1.4 细胞内mTOR信号蛋白S6、自噬特异性蛋白p62、LC3B蛋白表达检测 采用Western blotting法。取指数生长期的细胞,制成细胞悬液后接种于6孔板,培养24 h,饥饿处理12 h后分别加入0、25、50、75、100 μmol/L青蒿琥酯各100 μL,作用48 h提取总蛋白,用BCA法定量,检测样品加入5×上样缓冲液后煮沸10 min,根据蛋白定量结果调整每份样品蛋白上样量,进行上样。以β-actin为内参,SDS-PAGE电泳分离后,转膜至PVDF膜。室温条件下常规封闭1 h,加入一抗,于4 ℃条件下孵育过夜。用HRP标记二抗,室温条件下继续孵育1 h,经TBST洗涤后,ECL化学发光法检测蛋白表达。用Imagine J软件进行检测。蛋白相对表达量(校正后)=蛋白灰度值/内参灰度值。
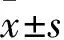
2 结果
2.1 青蒿琥酯对A549细胞增殖的影响 经0、25、50、75、100 μmol/L青蒿琥酯单独作用24 h,A549细胞增殖抑制率分别为7.1%、15.0%、35.7%、46.3%、60.2%;作用48 h,A549细胞增殖抑制率分别为7.7%、20%、46%、53%、70%;作用72 h,A549细胞增殖抑制率分别为8.3%、25.0%、53.0%、55.7%、73.4%。A549细胞增殖抑制率随药物浓度的增加而增加、随作用时间的增加而增加。24、48、72 h青蒿琥酯的IC50分别为(46.2±5.4)、(75.0±6.7)、(124.4±5.6)μmol/L。经0、25、50、75、100 μmol/L青蒿琥酯与3-MA共同作用24 h,A549细胞增殖抑制率分别为7%、14.2%、34.9%、49.3%、62.2%;作用48 h,A549细胞增殖抑制率分别为7.5%、16.1%、40.7%、43.1%、62.0%;作用72 h,A549细胞增殖抑制率分别为8.0%、20.0%、48.9%、50.1%、65.7%。同时点同浓度的青蒿琥酯加入3-MA后,A549细胞增殖抑制率降低(P均<0.05)。
2.2 青蒿琥酯对mTOR信号蛋白S6活性的影响 经0、25、50、75、100 μmol/L青蒿琥酯单独作用48 h,结果显示,当药物作用浓度为25 μmol/L以上时,随着药物浓度的增加,p-S6蛋白相对表达量降低,S6蛋白表达水平不变,p-S6蛋白相对于S6蛋白表达量分别为1.41±0.12、1.40±0.09、1.25±0.11、1.02±0.07、0.70±0.06;差异有统计学意义(P均<0.05)。
2.3 青蒿琥酯对自噬特异性蛋白p62、LC3B表达的影响 经0、25、50、75、100 μmol/L青蒿琥酯单独作用48 h,p62蛋白相对于内参β-actin的相对表达量分别为0.98±0.10、0.81±0.08、0.70±0.06、0.64±0.04、0.57±0.04,LC3BⅡ/Ⅰ分别为0.43±0.05、0.78±0.09、1.22±0.11、1.59±0.14、1.98±0.17。与未加药物相比,p62表达随青蒿琥酯浓度增强而降低(P均<0.05)。LC3B表达增强,LC3BⅡ/Ⅰ值增加,LC3BⅠ向LCBⅡ转化增多,细胞自噬增强(P<0.01)。
3 讨论
研究表明,青蒿琥酯能在体外培养环境下抑制多种肿瘤细胞生长[15~17]。其机制可能为通过诱导细胞自噬来抑制肿瘤细胞生长[5]。自噬这种可导致细胞死亡的反应方式,在肺部肿瘤的基础研究领域逐渐受到重视。
本研究选取A549细胞为实验对象,观察青蒿琥酯对细胞自噬的诱导作用。自噬主要参与细胞的能量代谢,依赖于生存环境的不同来发挥对细胞的双向调节功能[7,18],即促进细胞生存或死亡。PI3K/Akt/mTOR信号通路已经被证实在细胞内对自噬发挥最直接的调控作用[10],S6是mTOR下游的靶分子,通常通过其磷酸化水平来反映该信号通路的活性。mTOR信号减弱可以导致细胞进一步发生自噬。本研究结果显示,经不同浓度的青蒿琥酯作用后,p-S6蛋白表达减低,这提示青蒿琥酯可能通过下调mTOR信号通路活性促进细胞自噬体形成。
p62在自噬发生早期可调节细胞自噬体的构成,在末期其在细胞内的表达逐渐减少。通常可通过检测p62在细胞内的表达水平来表示自噬发生的程度。在自噬反应发生的初期,LC3参与了自噬反应的主要效应器即自噬溶酶体的构成,LC3(微管相关蛋白1轻链3)的表达水平可表示自噬的发生程度,通过测算LC3BⅡ与LC3BⅠ的比值可表示自噬体的数量和自噬发生的程度。即LC3BⅡ/Ⅰ越高,自噬的程度越高。本研究结果显示,经不同浓度的青蒿琥酯作用后,p62蛋白表达减低,LC3B蛋白表达升高,LC3BⅡ/Ⅰ值增加,提示青蒿琥酯诱导A549细胞发生自噬,而且自噬反应的程度随药物作用浓度、作用时间的增加而逐渐加强。本研究加入细胞自噬抑制剂3-MA后细胞增殖抑制率降低,进一步说明细胞自噬能抑制细胞生存。
综上所述,青蒿琥酯能抑制A549细胞增殖,其机制可能是下调mTOR信号通路的活性,促进细胞发生自噬。
[1] 王玮琴,周慧君,陈欢欢,等.青蒿琥酯抑制新生血管生成的作用[J].中国药理学与毒理学杂志,2004,18(1):32-36.
[2] 王玮琴,殷红.青蒿琥酯对人白血病 K562,K562/ADM细胞凋亡的作用及对NF-κB p65表达的影响[J].中国药师,2014,20(5):729-731.
[3] 赵君宁,何一然,张振玉,等.青蒿琥酯对人胃癌细胞增殖及凋亡的影响[J].中国癌症杂志,2005,15(4):347-350.
[4] 吴方红,戈伟,周学军,等.青蒿琥酯对胃癌细胞系HGC27细胞增殖、凋亡的影响及其机制[J].中国医药导报,2014,11(5):9-12.
[6] Yorimitsu T, Klionsky DJ. Autophagy: molecular machinery for self-eating[J]. Cell Death Differ, 2005,12(Suppl 2):1542-1552.
[7] Kurzrock R. Autophagy as a target for anticancer therapy[J]. Nature Reviews Clinical Oncology, 2011,8(9):528-539.
[8] Dong Y, Undyala VV, Gottlieb RA, et al. Autophagy: definition, molecular machinery, and potential role in myocardial ischemia-reperfusion injury[J]. J Cardiovasc Pharmacol Ther, 2010,15(3):220-230.
[9] Kimmelman AC. The dynamic nature of autophagy in cancer[J]. Genes Dev, 2011,25(19):1999-2010.
[10] Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Lett, 2010,584(7):1287-1295.
[11] Alers S, Loffler AS, Wesselborg S, et al. Role of AMPK-mTOR-Ulk1/2 in the regulation of autophagy: cross talk, shortcuts, and feedbacks[J]. Mol Cell Biol, 2012,32(1):2-11.
[12] Hay N, Sonenberg N. Upstream and downstream of mTOR[J]. Genes Dev, 2004,18(16):1926-1945.
[13] Tanida I, Minematsu-Ikeguchi N, Ueno T, et al. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy[J]. Autophagy, 2005,1(2):84-91.
[14] Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. J Biol Chem, 2007,282(33):24131-24145.
[15] Du J, Zhang H, Ma Z, et al. Artesunate induces oncosis-like cell death in vitro and has antitumor activity against pancreatic cancer xenografts in vivo[J]. Can Chem Pharmacol, 2010,65(5):895-902.
[16] Jiao Y, Ge CM, Meng QH, et al. Dihydroartemisinin is an inhibitor of ovarian cancer cell growth[J]. Acta Pharmacologica Sinica, 2007,28(7):1045-1056.
[17] 郑全芳,杨志刚,孙红祥.青蒿素及其衍生物药理作用研究进展[J].中国兽药杂志,2006,40(5):40-44.
[18] Das G, Shravage BV, Baehrecke EH. Regulation and function of autophagy during cell survival and cell death[J]. Cold Spring Harb Perspect Biol, 2012,4(6):997-1001.
天津市滨海新区卫计委项目(2012BWKY007)。
黄少祥(E-mail:13820759588@163.com)
10.3969/j.issn.1002-266X.2017.25.013
R734.2
A
1002-266X(2017)25-0042-03
2017-04-02)

