miR-219-5p对胰腺癌细胞增殖、凋亡和侵袭的影响及机制
李丽平,徐丹,叶俊,吴舜,马松林( 华中科技大学同济医学院附属武汉中心医院新洲院区,武汉430000; 华中科技大学同济医学院附属武汉中心医院)
miR-219-5p对胰腺癌细胞增殖、凋亡和侵袭的影响及机制
李丽平1,徐丹2,叶俊1,吴舜1,马松林2
(1 华中科技大学同济医学院附属武汉中心医院新洲院区,武汉430000;2 华中科技大学同济医学院附属武汉中心医院)
目的 探讨miR-219-5p对胰腺癌细胞增殖、凋亡和侵袭的影响及机制。方法 采用实时荧光定量PCR技术(qPCR)检测miR-219-5p在胰腺癌细胞系Panc-1、AsPC-1及Bxpc-3和正常胰腺导管上皮细胞系HPDE6-C7中的表达。选取Panc-1细胞系,分成两组,对照组(NC组)转染阴性对照序列scramble,miR-219-5p组转染miR-219-5p mimics,MTT实验和流式细胞仪分析两组细胞增殖和凋亡情况,采用Transwell实验测定两组细胞侵袭能力,Western blotting法检测表皮生长因子受体(EGFR)和裂解型Caspase 3(Cleaved Caspase-3)蛋白表达。结果 miR-219-5p在胰腺癌细胞系Panc-1、AsPC-1及Bxpc-3中的相对表达量低于正常胰腺导管上皮细胞系HPDE6-C7(P均<0.01);miR-219-5p组在72、96及120 h 490 nm处的OD值低于NC组(P均<0.01),细胞凋亡率高于NC组(P均<0.01);miR-219-5p组、NC组细胞侵袭数分别为(75.3±6.9)、(172.5±10.5)个/视野,两组细胞侵袭数比较,P<0.01;miR-219-5p组、NC组EGFR相对表达量分别为0.31±0.09、1.0,两组比较,P<0.01;miR-219-5p组、NC组Cleaved Caspase 3蛋白相对表达量分别为2.7±0.15、1.0,两组比较,P<0.01。结论 miR-219-5p在胰腺癌细胞系中呈低表达,miR-219-5p过表达可抑制胰腺癌细胞增殖和侵袭,并诱导细胞凋亡;其机制可能与miR-219-5p下调EGFR蛋白和上调Cleaved Caspase-3蛋白表达有关。
胰腺癌;细胞增殖;细胞侵袭;细胞凋亡;微小RNA-219-5p
MicroRNA(miRNA)是一类天然存在的长19~25 nt的非编码小分子RNA,通常与靶基因mRNA 3′UTR结合而阻止转录或降解mRNA[1]。miRNA在细胞分化、生长、死亡等生长发育过程中发挥重要作用[2]。目前已证实,miRNA的异常表达与多种疾病有关,特别是在肿瘤领域。多数miRNA在肿瘤组织中表达下降,可能作为癌基因或抑癌基因与肿瘤发生发展密切相关[3]。胰腺癌是消化系统常见的恶性肿瘤之一,具有预后差、易转移、恶性程度高等特点,全球范围内胰腺癌在所有肿瘤中病死率占第八位,每年约有266 000例死于胰腺癌[4]。目前已发现有多种miRNA在胰腺癌中表达下调,如miRNA-96、miRNA-141等[5,6]。miRNA-96通过直接靶向KRAS降低胰腺癌细胞迁移和侵袭[5]。miR-141表达下调与胰腺癌肿瘤大小、TNM分期及转移有关[6]。研究发现,miR-219-5p过表达抑制胶质母细胞瘤等肿瘤细胞的增殖、侵袭、迁移过程[7]。miR-219-5p可能作为抑癌基因参与肿瘤的生长过程,但对于miR-219-5p是否参与胰腺癌发展,目前尚不清楚。2016年1月~2017年1月,我们观察了miR-219-5p在胰腺癌细胞系中表达及其对细胞增殖、侵袭、凋亡能力的影响,同时研究了对EGFR、Cleaved Caspase-3蛋白表达的调控作用。现报告如下。
1 材料与方法
1.1 材料 胰腺癌细胞系Panc-1、AsPC-1、Bxpc-3及正常胰腺导管上皮细胞系HPDE6-C7均购自武汉大学医学院实验医学中心,RPMI1640培养基、胎牛血清、胰蛋白酶及TRIzol均购自美国BD公司,EGFR、Caspase3及GAPDH均购自Cell signaling公司,羊抗兔二抗购自武汉博士德生物科技有限公司,miRNA-219-5p mimics及scramble均由上海吉玛生物科技有限公司合成。
1.2 细胞培养、转染及分组 将胰腺癌细胞系Panc-1、AsPC-1、Bxpc-3及正常胰腺导管上皮细胞系HPDE6-C7加入到RPMI1640培养基,于37 ℃、5% CO2培养箱中培养,经48 h后消化传代。将Panc-1细胞系分成两组,NC组和miR-219-5p组,采用Lipofectamine 2000 reagent (Invitrogen, USA)分别转染miRNA-219-5p scramble及mimics,miR-219 mimics 转染序列:miR-219-5p mimics sense 5′-AAAAGAATTCCCACTTCCCACTCCAGACATT-3′,antisense 5′-AAAGCGGCCGCCCCTCACTTCTCCGTAACCC-3′。
1.3 miR-219-5p表达检测 采用All-in-One microRNA抽提试剂盒提取Panc-1、AsPC-1、Bxpc-3及HPDE6-C7细胞系的miRNAs,ABI Prism 7700 system 的SYBR Green Reagents (TaKaRa, Tokyo, Japan)定量real-time PCR(qRT-PCR),在ABI 7500实时定量PCR仪中,以U6小核RNA作为内参,使用2-ΔΔCt方法定量,量化miR-219-5p相对表达水平。
1.4 细胞增殖情况检测 采用MTT法。将NC组和miR-219-5p组细胞经培养后消化成单细胞悬液,按2×103/孔接种于96孔板上,按200 μL每孔标准培养,在培养后0、24、48、72、96及120 h后,按每孔20 μL的标准加入MTT溶液,用酶标仪在490 nm波长处测定各孔的吸光度,绘制MTT增殖曲线。
1.5 细胞凋亡率测算 采用流式细胞术。用Annexin V/PI 染色检测,将NC组和miR-219-5p组细胞消化成单细胞悬液后,PBS清洗2次,并使用Binding Buffer重悬,加入相应比例的Annexin V抗体,避光染色10 min后加入适量PBS溶液及PI染料,流式细胞仪检测Annexin V阳性细胞比例确定细胞凋亡情况。
1.6 细胞侵袭情况检测 采用Transwell法。NC组和miR-219-5p组各取2×104个细胞,接种于碳酸磷脂表面,于37 ℃下培养24 h,用1%多聚甲醛与膜下面的细胞结合并用0.2%结晶紫溶液染色,随机取10个视野(200×),计算穿过膜的细胞数量,实验重复3次,取平均值。
1.7 EGFR和Cleaved Caspase-3蛋白表达检测 采用Western blotting法。将NC组和miR-219-5p组细胞经RIPA细胞裂解液冰上裂解30 min后,变性、上样,以每孔30 μg总蛋白上样,浓缩胶80 V电泳40 min,分离胶100 V电泳2 h。常规湿法转膜,加入EGFR、Cleaved Caspase-3及GAPDH一抗,浓度为1∶300,一抗孵育过夜,二抗(1∶500)于37 ℃孵育4 h,PBST漂洗3次,ECL液显影,Quantity One 1-D分析软件对蛋白质印迹条带进行定量。目的蛋白相对表达量=目的蛋白测定值/ GAPDH,实验重复3次,取平均值。
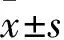
2 结果
2.1 不同胰腺癌细胞系中miR-219-5p表达比较 qPCR结果显示,胰腺癌细胞系Panc-1、AsPC-1及Bxpc-3 miR-219-5p的相对表达量分别为0.27±0.023、0.33±0.029、0.43±0.033,正常胰腺导管上皮细胞系HPDE6-C7中miR-219-5p相对表达量为1.0,胰腺癌细胞系Panc-1、AsPC-1及Bxpc-3中miR-219-5p的相对表达量均低于正常胰腺导管上皮细胞系HPDE6-C7(P均<0.01)。
2.2 各组细胞增殖情况及细胞凋亡率比较 qPCR测定miR-219-5p组miR-219-5p相对表达量为10.25±0.45,NC组为1.0,两组比较,P<0.01。MTT实验检测结果显示,miR-219-5p组与NC组0 h时490 nm处OD值分别为0.17±0.02、0.16±0.04,两组比较,P>0.05;24 h时OD值分别为0.28±0.05、0.27±0.04,两组比较,P>0.05;48 h时OD值分别为0.43±0.07、0.66±0.09,两组比较,P>0.05;72 h时OD值分别为0.73±0.09、1.49±0.13,两组比较,P<0.05;96 h时OD值分别为1.29±0.17、2.45±0.26,两组比较,P<0.01;120 h时OD值分别为2.22±0.21、3.83±0.29,两组比较,P<0.001。流式细胞术检测结果显示,miR-219-5p组、NC组细胞凋亡率分别为(15.75±2.42)%、(5.5±0.70)%,两组细胞凋亡率比较,P<0.01。
2.3 miR-219-5p组、NC组细胞侵袭情况比较 Transwell实验显示,200倍视野下,miR-219-5p组、NC组穿膜细胞数分别为(75.3 ± 6.9)、(172.5±10.5)个/视野,两组比较,P<0.01。
2.4 miR-219-5p组、NC组EGFR和Cleaved Caspase-3蛋白表达比较 miR-219-5p组、NC组EGFR相对表达量分别为0.31±0.09、1.0,两组比较,P<0.01;miR-219-5p组、NC组Cleaved Caspase-3蛋白相对表达量分别为2.7±0.15、1.0,两组比较,P<0.01。
3 讨论
胰腺癌是常见的恶性肿瘤之一,在癌症病死率中位列第四[8]。目前针对胰腺癌的治疗以传统手术、放疗、化疗为主,但缺乏更有效的治疗方式[9]。miRNA是一类与肿瘤密切相关的小分子RNA,目前已有多个miRNA被证实参与胰腺癌细胞转移、增殖、凋亡等过程,如miRNA-96、miRNA-141等[5,6]。miRNA-219-5p已被证实与多种肿瘤发生发展有关,通过靶向雌激素受体抑制甲状腺乳头状癌细胞增殖、迁移,促进凋亡[10];通过靶向PRKCI抑制舌鳞状细胞癌生长和转移[11]等。胰腺癌特异型性miRNAs及其靶点的识别有助于了解其在肿瘤发生中的作用。本研究发现miR-219-5p在胰腺癌细胞系中表达下降,过表达后能明显抑制胰腺癌细胞增殖和侵袭能力,并诱导细胞凋亡,这一机制是通过降低EGFR、提高Cleaved Caspase-3蛋白表达实现的。
信号转导通路紊乱可致细胞增殖失控,是肿瘤发生发展的重要原因[12]。PI3K/Akt、Ras/Raf/MEK信号转导通路通常在细胞内发挥抑制凋亡、促进增殖的作用,其过度激活极易导致肿瘤发生,他们往往是由发生基因突变的信号通路组成因子或上游的受体酪氨酸激酶所介导[13]。受体酪氨酸激酶包括EGFR、血小板衍化生长因子、纤维细胞生长因子、胰岛素受体等[14]。研究显示,45%的胶质母细胞瘤患者受体酪氨酸激酶介导的信号通路被激活是由于EGFR表达失调所致[7]。EGFR在胰腺癌等多种实体瘤中表达过度的现象广泛存在,表明其表达异常与肿瘤细胞增殖、转移、侵袭有关[15]。EGFR异常表达可能由miRNA失调引起,且已被验证为多个miRNA的靶基因。如在胶质母细胞瘤中,miRNA-7通过抑制EGFR表达和阻碍PI3K/Akt信号通路激活,从而降低细胞存活率和侵袭能力[16]。更重要的是,在胶质母细胞瘤中miR-219-5p通过直接绑定结合EGFR 3′UTR位点而降低EGFR表达,使EGFR介导的PI3K/Akt、Ras/Raf/MEK信号途径受抑制,由此降低细胞增殖、生长和转移能力[7]。本研究中,miR-219-5p过表达可引起EGFR蛋白水平降低,我们猜测在胰腺癌中miR-219-5p是直接与EGFR基因3′UTR位点特异性结合,负调控EGFR转录后水平,抑制了PI3K/Akt、Ras/Raf/MEK信号通路,因而减弱细胞增殖和侵袭能力。
细胞凋亡是细胞程序性死亡,是调控机体发育、清除受损细胞、维持内环境的重要机制,其失衡是肿瘤发生发展的一大重要因素。细胞凋亡主要通过死亡受体介导的细胞凋亡途径、线粒体途径、内质网途径三种方式[17]。Caspase-3是这三种通路的关键执行酶,细胞在受到刺激信号后经过一系列级联反应使无活性的Procaspase-3被激活,裂解为有活性的Caspase-3,最终诱导细胞凋亡[18]。本研究中,miR-219-5p过表达诱导胰腺癌细胞凋亡,同时Cleaved Caspase-3表达量上升,说明Caspase-3被激活,细胞凋亡被诱导。我们猜测,miR-219-5p诱导细胞凋亡可能是通过死亡受体途径、线粒体途径或内质网途径,亦可能同时执行两种或三种途径,但具体的作用途径还需进一步研究。
综上所述,miR-219-5p在胰腺癌中作为抑癌基因是通过上调EGFR蛋白、下调Caspase-3蛋白参与抑制细胞增殖和侵袭、促进细胞凋亡。该基因功能的鉴定有望为胰腺癌靶向治疗提供新的靶点,为肿瘤治疗提供新的途径。
[1] 叶振南,徐善水.miRNA 在胶质瘤组织和细胞中的表达及作用[J].山东医药,2013,53(33):100-102.
[2] Miska EA. How microRNAs control cell division, differentiation and death[J]. Curr Opin Genet Dev, 2005,15(5):563-568.
[3] Zhang B, Pan X, Cobb GP, et al. microRNAs as oncogenes and tumor suppressors[J]. Dev Biol, 2007,302(1):1-12.
[4] Peng W, Gao W, Feng J. Long noncoding RNA HULC is a novel biomarker of poor prognosis in patients with pancreatic cancer[J]. Med Oncol, 2014,31(12):1-7.
[5] Yu S, Lu Z, Liu C, et al. miRNA-96 suppresses KRAS and functions as a tumor suppressor gene in pancreatic cancer[J]. Cancer Res, 2010,70(14):6015-6025.
[6] Zhao G, Wang B, Liu Y, et al. miRNA-141, downregulated in pancreatic cancer, inhibits cell proliferation and invasion by directly targeting MAP4K4[J]. Mol Cancer Ther, 2013,12(11):2569-2580.
[7] Rao SAM, Arimappamagan A, Pandey P, et al. miR-219-5p inhibits receptor tyrosine kinase pathway by targeting EGFR in glioblastoma[J]. PLoS One, 2013,8(5):e63164.
[8] Hermann PC, Huber SL, Herrler T, et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J]. Cell Stem Cell, 2007,1(3):313-323.
[9] Biankin AV, Waddell N, Kassahn KS, et al. Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes[J]. Nature, 2012,491(7424):399-405.
[10] Huang C, Cai Z, Huang M, et al. miR-219-5p Modulates Cell Growth of Papillary Thyroid Carcinoma by Targeting Estrogen Receptor α[J]. J Clin Endocrinol Metab, 2014,100(2):E204-E213.
[11] Song KB, Liu WJ, Jia SS. miR-219 inhibits the growth and metastasis of TSCC cells by targeting PRKCI[J]. Int J Clinical Exp Med, 2014,7(9):2957.
[12] Steeg PS. Metastasis suppressors alter the signal transduction of cancer cells[J]. Nature Rev Cancer, 2003,3(1):55-63.
[13] De Luca A, Maiello MR, D′Alessio A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: role in cancer pathogenesis and implications for therapeutic approaches[J]. Expert Opin Ther Targets, 2012,16(Suppl2):S17-S27.
[14] Han DC, Tang-Long S, Jun-Lin G. The Grb7 family proteins: structure, interactions with other signaling molecules and potential cellular functions[J]. Oncogene, 2001,20(44):6315.
[15] Moore MJ, Goldstein D, Hamm J, et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase Ⅲ trial of the National Cancer Institute of Canada Clinical Trials Group[J]. J Clin Oncol, 2007,25(15):1960-1966.
[16] Kefas B, Godlewski J, Comeau L, et al. microRNA-7 inhibits the epidermal growth factor receptor and the Akt pathway and is down-regulated in glioblastoma[J]. Cancer Res, 2008,68(10):3566-3572.
[17] Timmins JM, Ozcan L, Seimon TA, et al. Calcium/calmodulin-dependent protein kinase Ⅱ links ER stress with Fas and mitochondrial apoptosis pathways[J]. J Clin Invest, 2009,119(10):2925-2941.
[18] Lakhani SA, Masud A, Kuida K, et al. Caspases 3 and 7: key mediators of mitochondrial events of apoptosis[J]. Science, 2006,311(5762):847-851.
Effects of miR-219-5p on proliferation, apoptosis, and invasion of pancreatic carcinoma cells
LILiping1,XUDan,YEJun,WUShun,MASonglin
(1TheCentralHospitalofWuhanAffiliatedtoTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan430000,China)
Objective To investigate the effects of miRNA-219-5p on the proliferation, apoptosis, and invasion of pancreatic carcinoma cells and its mechanism. Methods Real-time fluorescence quantitative PCR (qPCR) was carried out to determine miR-219-5p expression in the pancreatic carcinoma cell lines Panc-1, AsPC-1, and Bxpc-3 and normal pancreatic ductal epithelial cell line HPDE6-C7. Further, Panc-1 cells were chosen and were divided into two groups: the normal control group (NC group) (transfection with miR-219-5p scramble) and miR-219-5p group (transfection with miR-219-5p mimics). The cell proliferation and apoptosis were detected by MTT assay and flow cytometry. The invasion ability was checked by transwell assay. The expression of epidermal growth factor receptor (EGFR) and Cleaved Caspase-3 proteins was examined by Western blotting. Results MiR-219-5p expression was lower in pancreatic carcinoma cell lines Panc-1, AsPC-1, and Bxpc-3, as compared with that in the pancreatic ductal epithelial cell line HPDE6-C7 (allP<0.01). The OD490nm of the miR-219-5p group was significantly lower than that of the NC group at 72, 96, and 120 h (allP<0.01); the apoptosis rate was higher (allP<0.01). The invasive cells were (75.3±6.9)/Hp in the miR-219-5p group, which was significantly lower than that [(172.5±10.5)/Hp] in the NC group (P<0.01). The expressive level of EGFR in the miR-219-5p group was significantly lower than NC group (0.31±0.09 vs. 1.0,P<0.01). The expression of Cleaved Caspase-3 was up-regulated in the miR-219-5p group as compared with that of NC group (2.7±0.15 vs. 1.0,P<0.01).Conclusions The miR-219-5p is lowly expressed in pancreatic carcinoma cell lines. The over-expression of miR-219-5p can inhibit the proliferation and invasion of pancreatic carcinoma cells, and induce the apoptosis, possibly though the down-regulated protein expression of EGFR and up-regulated protein expression of Cleaved Caspase-3.
pancreatic carcinoma; cell proliferation; cell invasion; apoptosis; miRNA-219-5p
湖北省自然科学基金面上项目(CFB578);武汉市卫计委课题(WX14A04)。
李丽平(1977-),在读硕士,住院医师,主要研究方向为胰腺肿瘤的基础与临床。E-mail:lipingli2017@126.com
马松林(1979-),硕士,主治医师,主要研究方向为胰腺肿瘤的基础与临床。E-mail:songlinma8887@sina.com
10.3969/j.issn.1002-266X.2017.25.004
R735.9
A
1002-266X(2017)25-0012-04
2017-04-01)

