STEMI患者PCI术后左心室GLS、梗死面积变化及与主要不良心血管事件的关系
段洋,陆远,王志荣,徐晤,李承宗,王晓萍,韩曙光,Muhammad Shahzad
(1徐州医科大学附属医院,江苏徐州221000;2山东大学齐鲁医院)
STEMI患者PCI术后左心室GLS、梗死面积变化及与主要不良心血管事件的关系
段洋1,陆远1,王志荣1,徐晤1,李承宗1,王晓萍1,韩曙光1,Muhammad Shahzad2
(1徐州医科大学附属医院,江苏徐州221000;2山东大学齐鲁医院)
目的 观察急性ST段抬高型心肌梗死(STEMI)患者介入治疗(PCI)后6个月左心室整体纵向应变(GLS)及心肌梗死面积(IS)的变化,并探讨二者与PCI术后6~12个月主要不良心血管事件(MACE)发生情况的关系。方法 选择60例PCI术后STEMI患者(其中7例PCI术后6~12个月发生MACE)。PCI术后7 d、6个月分别采用二维超声心动图斑点追踪成像技术测算左心室GLS,采用延迟增强心磁共振技术测算左心室IS。结果 本组患者PCI术后7 d、6个月左心室GLS分别为-14%±3%、-17%±3%,IS分别为23%±7%、19%±6%。本组患者PCI术后6个月左心室GLS、IS均低于术后7 d,P均<0.05。相关性分析显示,本组患者PCI术后左心室GLS和IS呈负相关(r=-0.756,P<0.01)。本组患者PCI术后6个月左心室GLS较术后7 d降低2%~4%,中位数为3%。以PCI术后6个月左心室GLS较术后7 d降低幅度的中位数为界值将本组患者分为GLS明显降低组(降低幅度≥中位数)26例和GLS无明显降低组(降低幅度<中位数)34例,其中分别有0、7例患者随访过程中发生MACE,两组MACE发生率相比,P<0.05。本组患者PCI术后6个月IS较术后7 d降低2%~5%,中位数为3%。以PCI术后6个月IS较术后7 d降低幅度的中位数为界值将本组患者分为IS明显降低组(降低幅度≥中位数)21例和IS无明显降低组(降低幅度<中位数)39例,其中分别有0、7例患者随访过程中发生MACE,两组MACE发生率相比,P<0.05。结论 STEMI患者PCI术后6个月左心室GLS和IS低于术后7 d;STEMI患者PCI术后左心室GLS、IS有较好的相关性;STEMI患者PCI术后左心室GLS、IS明显降低者不易发生MACE。
心肌梗死;梗死面积;纵向应变;主要不良心血管事件
急性ST段抬高型心肌梗死(STEMI)是严重危害人类健康和生命的常见心血管急症之一,近年来发病率逐年上升[1]。急诊经皮冠状动脉介入治疗(PCI)可以有效修复STEMI患者缺血心肌,提高生存率[2,3],但心肌梗死后心室重塑会导致心力衰竭,导致病死率居高不下。目前临床上观察STEMI患者PCI术后左心室结构和功能主要通过超声心动图测量左心室射血分数、左心室舒张末期内径等,都不够准确。整体纵向应变(GLS)用二维超声斑点追踪成像(STE)技术测得,直接反映患者心肌收缩功能;心肌梗死面积(IS)用延迟增强心磁共振技术(DE-MRI)测得,是反映患者PCI术后患者心肌修复情况的直接指标。本研究通过GLS、IS这两个指标进一步观察STEMI患者PCI术后左心室结构和功能的变化,并分析STEMI患者PCI术后左心室GLS、IS变化与主要不良心血管事件(MACE)发生情况的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年2月~2016年12月行急诊PCI治疗,术后随访资料齐全的STEMI患者60例,其中男41例,女19例,年龄33~78(61±13)岁。所有患者全程接受规范药物治疗。入选标准:符合2015年中华医学会心血管分会制定的《急性ST段抬高型心肌梗死诊断和治疗指南》中的STEMI诊断标准[4],并成功行急诊PCI术,签署知情同意书。排除标准:既往有陈旧性心肌梗死者;心源性休克者;严重肝肾功能损害者;恶性肿瘤患者;预期寿命短于1年者;体内有其他金属不能行MRI检查者、图像采集不理想、无法完成满意随访者等。患者随访1年,7例患者PCI术后6~12个月出现MACE(包括死亡、再发心肌梗死、紧急血管重建术、新发的充血性心力衰竭)。
1.2 GLS测算方法 于PCI术后7 d及6个月采用二维超声心动图STE技术测算GLS。患者左侧卧位,平静呼吸,连接胸导联心电图,同步记录心电图,采集心尖部左室四腔、心尖二腔、心尖长轴的二维灰阶图像,均采集3个心动周期。保持图像间帧频数与心率大致相同。图像要求应包含完整的所要分析的心肌,并尽可能清晰显示心内膜与心外膜,三个短轴切面尽量呈圆形,置于图像中央。图像收集完毕,启动QLAB 9.1脱机处理,测量左室GLS。
1.3 IS测算方法 于PCI术后7 d及6个月采用心脏MRI检查测算IS。检查之前嘱患者进行反复吸气、呼气训练。嘱患者仰卧位,采用心电向量门控R波触发、吸气末屏气成像。通过1.5 T超导磁共振成像扫描仪采用门控真实稳态自由进动梯度回波序列(True FISP),获得行左室两腔心长轴、四腔心长轴、左室流出道切面以及6~8层左室短轴电影。对比剂增强心肌首过灌注以0.1 mmol/kg剂量、4~5 mL/s流速注射对比剂,完成后追加20 mL生理盐水,注射与扫描同时进行,采用TSENSE EPIGRE序列。心肌灌注完成以后立即以2 mL/s的流速追加0.1~0.15 mmol/kg剂量的对比剂,同时追加20 mL生理盐水,15 min以后行相位敏感反转恢复的T1WI扫描(PSIR),包括6~8层左室短轴切面,左室两腔心切面以及四腔心切面均各1层。打开Philips IntelligenceSpace Portal工作站心脏软件包,测算IS。
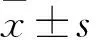
2 结果
本组患者PCI术后7 d、6个月左心室GLS分别为-14%±3%、-17%±3%,IS分别为23%±7%、19%±6%。本组患者PCI术后6个月左心室GLS、IS均低于术后7 d时(P均<0.05)。相关性分析显示,本组患者PCI术后左心室GLS和IS呈正相关(r=0.756,P<0.01)。
本组患者PCI术后6个月左心室GLS较术后7 d降低2%~4%,中位数为3%。以PCI术后6个月左心室GLS较术后7 d降低幅度的中位数为界值将本组患者分为GLS明显降低组(降低幅度≥中位数)26例和GLS无明显降低组(降低幅度<中位数)34例,其中分别有0、7例患者随访过程中发生MACE,两组MACE发生率相比,P<0.05。本组患者PCI术后6个月IS较术后7 d降低2%~5%,中位数为3%。以PCI术后6个月IS较术后7 d降低幅度的中位数为界值将本组患者分为IS明显降低组(降低幅度≥中位数)21例和IS无明显降低组(降低幅度<中位数)39例,其中分别有0、7例患者随访过程中发生MACE,两组MACE发生率相比,P<0.05。
3 讨论
急性心肌梗死的病理学基础是冠状动脉粥样硬化斑块破裂及继发血栓形成,继而引起冠状动脉阻塞。STEMI患者尽早开通罪犯血管,可以挽救濒死心肌,缩小坏死范围,改善预后。急诊PCI因其高再通率及低狭窄率成为当前最有效的STEMI治疗手段,大大降低了患者病死率[5],但STEMI患者心肌梗死后发生心室重构,可出现心腔扩大、心脏几何形状改变、心肌质量增加和心功能下降[6,7]。
斑点追踪超声心动图是一种全新超声定量分析技术[8,9],不受声束角度的限制,可实时自动追踪心肌在整个心动周期内的组织噪声斑点运动在图像中的位置,逐帧比较每个斑点的运动及斑点间的相对运动,对心室长轴的纵向、短轴的径向、环向、旋转及扭转运动进行定量检测[10],对评价心肌功能及深入了解心脏机械运动的机制有重要价值[11]。国内相关研究[12]表明,在反映心功能及心肌缺血方面,GLS较径向、圆周应变指标敏感。有学者[13]研究表明,急性心肌缺血后行PCI的患者,心肌纵向运动、圆周运动比径向运动在反映缺血心肌的局部功能方面更敏感。GLS在评价左心整体、局部功能方面有重要价值。本研究结果显示,本组STEMI患者PCI术后6个月左心室GLS低于PCI术后7 d,表明PCI术后STEMI患者左心功能逐渐恢复,PCI对改善STEMI患者心功能具有重要作用,与既往研究[14]结果基本一致。
心脏MRI检查可全方位评估STEMI患者的心脏状态,通过钆延时增强显像技术可以相对准确的测量心肌梗死面积[15]。动物模型实验证明,心脏延时显像可准确地反映心肌梗死的范围,甚至可以检测到小于1 g的心肌梗死,其对心内膜下梗死的敏感度也高于SPECT及PET[16]。研究[17]表明,心肌梗死早期MRI所测高度增强区域并不能准确反映实际的梗死面积,但这种变化可能是导致心律失常和不良预后的根源。有学者[5]认为梗死后1周有可能是评估心肌微循环的理想时间点。本研究结果显示,本组STEMI患者PCI术后6个月左心室IS低于PCI术后7 d,表明STEMI患者PCI术后6个月瘢痕面积小于急性期最初的梗死面积,这种现象的出现可能有以下几种原因:①急性心肌梗死后周围水肿带、炎症等因素存在造成对梗死面积的高估[18];②随着时间的推移,心肌纤维化和瘢痕回缩的结果[19]。本研究结果显示STEMI患者PCI术后GLS和IS之间有较好的相关性。表明PCI术后心脏结构和功能改变值之间有较好关联。
本组STEMI患者PCI术后6~12月有7例患者发生MACE。左心室GLS上升、IS明显降低的患者MACE发生率较低。有学者[20]研究证实IS与晚期MACE发生无明显相关性,与本研究结果不相符,分析原因可能是:①国外研究多为多中心大样本研究,且随访时间均较长,本研究为单中心研究,样本量较少,随访时间较短;②鉴于患者安全考虑,平均首次检查时间较国外晚,心肌水肿会缩小或消失,间接降低了心肌水肿导致的对IS的高估。
综上所述,STEMI患者PCI术后6个月左心室GLS和IS低于术后7 d时;STEMI患者PCI术后左心室GLS、IS有较好的相关性;STEMI患者PCI术后左心室GLS上升、IS明显降低者不易发生MACE。但由于本研究样本量较少,随访时间短,上述结论仍需进一步研究证实。
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2015》概要[J].中国循环杂志,2016,31(6):521-528.
[2] Huynh T, Perron S, O'Loughlin J, et al. Comparison of primary percutaneous coronary intervention and fibrinolytic therapy in ST-segmentelevation myocardial infarction: bayesian hierarchical meta analyses of randomized controlled trials and observational studies[J]. Circulation, 2009,119(24):3101-3109.
[3] Yeh RW, Sidney S, Chandra M, et al. Population trends in the incidence and outcomes of acute myocardial infarction[J]. N Engl J Med, 2010,362(23):2155-2165.
[4] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2015,43(5):380-392.
[5] 刘爽,马春燕,李阳,等.左心室整体纵向应变预测急性心肌梗死患者经皮冠状动脉介入术后左心室重构[J].中国医学影像技术,2016,32(3):363-366.
[6] Bodi V, Sanchis J, Nunez J, et al. Prognostic value of a comprehensive cardiac magnetic resonance assessment soon after a first ST-segment elevation myocardial infarction[J]. Cardiovasc Imaging J, 2009,2(7):835-842.
[7] Mondillo S, Galderisi M, Mele D, et al. Speckle-Tracking Echocardiography: A New Technique for Assessing Myocardial Function[J]. Ultrasound Med J, 2011,30(1):71-83.
[8] Fujimoto H, Honma H, Ohno T, et al. Longitudinal Doppler strain measurement for assessment of damaged and/or hibernating myocardium by dobutamine stress echocardiography in patients with old myocardial infarction[J]. J Cardiol, 2010,55(3):309-316.
[9] 孟媛媛,侯海军,李春玲,等.二维斑点追踪成像技术评价舒张期应变率对冠心病的诊断价值[J].中华老年心脑血管病杂志,2011(9):778‐780.
[10] Rosner A, Avenarius D, Malm S, et al. Persistent dysfunction of viable myocardium after revascularization in cORonic ischaemic heart disease: implications for dobutamine stress echocardiography with longitudinal systolic strain and strain rate measurements[J]. Eur Heart J, 2012,13(9):745-755.
[11] 松青,杨俊华.二维斑点追踪显像对冠心病患者经皮介入术前后左室心肌功能的定量评价[J].岭南心血管杂志,2011(s1):164-165.
[12] Winter R, Jussila R, Nowak J, et a1. STI is a sensitive tool for the detection of myocardial ischemia:a pilot study from the catheterization laboratory during PCI [J]. J Am soc Echocardiogr,2007,20(8):974-981.
[13] Lonborg J, Schoos MM, Kelba H, et al. Impact of system delay on infarct size, myocardial salvage index,and left ventricular function in patients with ST-segment elevation myocardial infarction[J].Am Heart J, 2012,164(4):538-546.
[14] Kim RJ, Wu E, Rafael A, et al .The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction[J]. N Engl J Med, 2000,343(20):1445-1453.
[15] Wagner A, Mahrholdt H, Holly TA, et al. Contrast-enhanced MRI and routine single photon emission computed tomography (SPECT) perfusion imaging for detection of subendocardial myocardial infarcts: an imaging study[J]. Lancet, 2003,361(9355):374-379.
[16] Rubenstein JC, Lee DC, Wu E, et al. A comparison of cardiac magnetic resonance imaging peri-infarct border zone quantifcation strategies for the prediction of ventricular tachyarrhythmia inducibility[J]. Cardiol J, 2013,20(1):68-77.
[17] Yan AT, Shayne AJ, Brown KA, et al. Characterization of the peri-infarct zone by contrast-enhanced cardiac magnetic resonance imaging is a powerful predictor of post-myocardial infarction mortality[J]. Circulation, 2006,114(1):32-39.
[18] Mewton N, Liu CY, Croisille P, et al. Assessment of myocardial fibrosis with cardiovascular magnetic resonance[J]. J Am Coll Cardiol, 2011,57(8):891-903.
[19] van den Borne SW, Diez J, Blankesteijn WM, et al. Myocardial remodeling after infarction: the role of myofibroblasts[J]. Nat Rev Cardiol, 2010,7(1):30-37.
[20] Husser O, Monmeneu JV, Bonanad C, et al. Head-to-head comparison of 1 week versus 6 months CMR derived infarct size for prediction of late events after STEMI[J]. Int J Cardiovasc Imaging, 2013,29(7):1499-1509.
王志荣(E-mail: xzzrw@163.com)
10.3969/j.issn.1002-266X.2017.27.031
R542.2
B
1002-266X(2017)27-0099-03
2016-12-14)

