科罗索酸下调MMP-2、MMP-9抑制结肠癌LoVo细胞的迁移与侵袭
张军要,梁树才,朱宝安
科罗索酸下调MMP-2、MMP-9抑制结肠癌LoVo细胞的迁移与侵袭
张军要,梁树才,朱宝安
目的 探讨科罗索酸对结肠癌LoVo细胞迁移、侵袭能力的影响及其机制。方法 设定空白组与不同浓度的科罗索酸组(5、10、20 μmol·L-1),观察LoVo细胞与不同浓度科罗索酸作用24 h的划痕愈合率。应用Transwell实验和Western blot检测科罗索酸对LoVo细胞侵袭能力和MMP-2、MMP-9的表达水平。结果 LoVo细胞划痕实验中,经5、10、20 μmol·L-1科罗索酸处理24 h后,空白组及用药各组迁移率分别为(72.01±6.88)%、(71.21±6.05)%、(48.36±5.69)%(与空白组相比P<0.05)及(29.18±5.57)%(与空白组相比P<0.01);Transwell实验空白及用药各组的穿膜细胞数依次为316.04±38.25、266.02±21.02、151.13±8.51(与空白组相比P<0.01)和147.68±7.90(与空白组相比P<0.01)。Western blot显示科罗索酸处理后LoVo细胞MMP-2、MMP-9表达水平呈降低趋势。结论 科罗索酸呈浓度依赖性地抑制结肠癌LoVo细胞迁移与侵袭,其可能与下调MMP-2、MMP-9的表达有关。
科罗索酸;结肠癌;MMP-2;MMP-9
科罗索酸(corosolic acid,CRA)是一种从中药猫人参中提取的五环三萜酸,也存在于大叶紫薇等多种植物中,起初发现CRA具有治疗肥胖症和Ⅱ型糖尿病的作用而引起重视,近年来有报道CRA对肿瘤细胞也具有一定的抑制作用。结肠癌是最常见的消化道恶性肿瘤之一,治疗以外科手术为主,但常因远处转移而错过最佳手术时机[1]。作者前期的研究发现CRA可通过抑制STAT3途径促进结肠癌LoVo细胞凋亡[2],鉴于STAT3途径与肿瘤细胞的转移机制有关,结合近期有文献报道CRA可减少小鼠移植瘤的远处转移,推测CRA可能对肿瘤细胞的迁移、侵袭能力有一定的影响[3]。本研究拟探讨不同浓度的CRA对结肠癌LoVo细胞迁移、侵袭能力的影响以及可能机制,现报道如下。
1 材料与方法
1.1 试剂与仪器 结肠癌LoVo细胞由漯河医学高等专科学校分子医学实验中心提供,CRA(批号:G0549)购自Sigma公司;RPMI-1640培养液(批号:1290220)、胰蛋白酶(批号:1395511)、胎牛血清(批号:934481)购自美国Gibco公司;兔抗人β-actin(批号:4967)、兔抗人MMP-2(批号:4022)、兔抗人MMP-9一抗(批号:2270)购自美国Sell Signaling公司;HRP标记的羊抗兔IgG二抗购自Promega公司(批号:W4021);Western blot化学发光试剂盒(批号:320001)购自中国上海贝博生物;Transwell小室(批号:3422)购自Corning公司;超净工作台(Thermo Scientific公司)。
1.2 CRA对LoVo细胞迁移能力的影响 取对数生长期的LoVo细胞,用完全培养液调整细胞密度为2×105个·mL-1,每孔0.5 mL接种于24孔板;培养24 h后,用10 μL移液枪头在单层细胞层上划“一”字形划痕,用PBS洗涤3次,分别加入含有0~20 μmol·L-1CRA的无血清培养液;继续培养24 h后,倒置显微镜下观察划痕宽度,并计算迁移率。划痕实验迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.3 CRA对LoVo细胞侵袭能力的影响 用不含血清的培养液按1∶5的比例稀释Matrigel基质胶,取Matrigel稀释液100 μL置于Transwell小室中,37 ℃静置1 h待用。LoVo细胞消化后以5×105个·mL-1的密度重悬于RPMI-1640无血清培养液中,取细胞悬液100 μL加入Transwell小室,24孔板下室加入600 μL含有10%胎牛血清的RPMI-1640培养液。37 ℃ 5% CO2培养箱中培养24 h后,用棉签拭去Matrigel以及上室内未穿过的细胞,4%多聚甲醛固定10 min,PBS洗涤3次,用0.1%结晶紫染色10 min,PBS洗涤3次,400倍显微镜下取5个不同的视野计算穿过Matrigel的细胞数。以穿过Matrigel的细胞数反映其侵袭能力。
1.4 Western blot检测MMP-2、MMP-9的表达 收集各组LoVo细胞,提取细胞总蛋白,BCA法测定蛋白浓度,调整各组蛋白浓度至浓度相同,取等量蛋白样品与2倍上样缓冲液等体积混合,SDS-PAGE电泳分离之后电转移至硝酸纤维薄膜上。5%脱脂奶粉封闭;加入稀释后的第一抗体(MMP-2、MMP-9一抗稀释比例1∶1 000;β-actin为1∶100),4 ℃孵育过夜,TBS洗膜3次,每次10 min;加入1∶5 000稀释的第二抗体,室温反应1 h;TBS洗膜3次,每次10 min;化学发光试剂盒显色。

2 结果
2.1 CRA对LoVo细胞迁移能力的影响 划痕实验显示,作用24 h后,空白组的迁移率为(72.01±6.88)%,用药各组的迁移率依次为(71.21±6.05)%、(48.36±5.69)%(与空白组相比,P<0.05)和(29.18±5.57)%(与空白组相比,P<0.01),随着CRA浓度增加,对LoVo细胞迁移能力的抑制作用逐渐增强,见图1。

图1 CRA对LoVo细胞迁移能力的影响(×40)
2.2 CRA对LoVo细胞侵袭能力的影响 Transwell实验显示,空白组每视野的穿膜细数为316.04±38.25,用药各组依次为266.02±21.02、151.13±8.51(与空白组相比,P<0.01)和147.68±7.90(与空白组相比,P<0.01)。随着CRA浓度增加,对LoVo细胞侵袭力的抑制作用逐步增强。见图2。
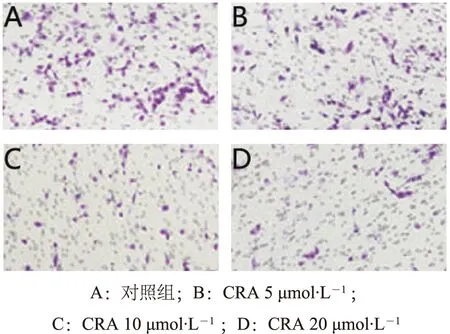
图2 CRA对LoVo细胞侵袭能力的影响(×100)
2.3 CRA对MMP-2、MMP-9表达的影响 Western blot结果显示,随着CRA药物浓度的升高,MMP-2、MMP-9蛋白表达水平逐渐下降,差异有统计学意义(P<0.05),见图3。
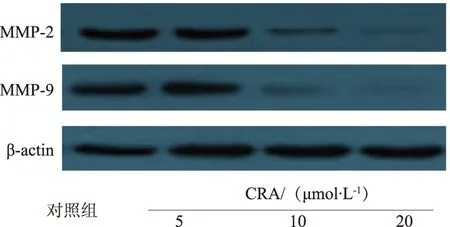
图3 CRA对LoVo细胞MMP-2、MMP-9的影响
3 讨论
细胞间的空隙由蛋白和蛋白聚糖组成的细胞外基质(extracellular matrix, ECM)填充,ECM构成复杂的网架结构固定细胞,限制细胞的自由移动。基质金属蛋白酶(matrix metalloproteinases, MMPs)是一类依赖锌离子的细胞外蛋白水解酶,能够水解ECM与基底膜中的Ⅳ型胶原蛋白,使肿瘤细胞突破ECM和基底膜的限制向周围组织浸润,并侵入淋巴管或血管,向远处转移。其中MMP-2和MMP-9被认为是与肿瘤侵袭转移最为直接和重要的MMP。研究发现MMP-2和MMP-9与结肠癌的淋巴结转移、TNM分期均呈正相关[4],结肠癌转移过程中Ⅳ型胶原的缺失也与MMP-2和MMP-9的过度表达有关[5]。
CRA是从猫人参、大叶紫薇等药用植物中提取的五环三萜类化合物,最初因其显著的降血糖、抗炎作用而引起重视[6],近年来发现CRA对胃癌[7]、肝癌[8]等细胞均有明显的抑制作用,Yoo等报道[9]CRA可抑制小鼠移植瘤瘤体内血管和淋巴管的生成,阻断肿瘤细胞的营养供应,进一步抑制肿瘤的生长,使得CRA在抗肿瘤方面的作用引起了广泛的重视。作者前期研究发现,CRA对结肠癌LoVo细胞亦有明显的抑制生长、促进凋亡的作用[2,10],其作用途径与CRA抑制信号传导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)的活化有关。近期有报道CRA能够抑制裸鼠移植瘤细胞向周围组织的浸润与肺部转移[2]。本研究显示CRA呈现剂量依赖性地抑制结肠癌LoVo细胞的迁移与侵袭,其作用可能与CRA抑制MMP-2、MMP-9的表达有关。
在MMP-2基因的启动子内存在具有高度亲和力的STAT3结合位点,活化的STAT3可直接调节MMP-2的表达。STAT3与MMP-9的作用途径目前尚不明确,但有报道证实,在结肠癌SW480细胞中沉默STAT3基因可使MMP-9的表达降低[11]。Horlad等[3]通过小鼠实验发现CRA能够抑制STAT3的活化并抑制肿瘤细胞向周围组织的浸润。这与本组前期相似,因此推测结肠癌LoVo细胞中,CRA可能通过抑制STAT3的活化下调MMP-2、MMP-9的表达,有待进一步证实。
综上所述,CRA下调MMP-2、MMP-9的表达,抑制结肠癌LoVo细胞的迁移与侵袭。CRA具有一定抑制肿瘤细胞增殖、促进细胞凋亡、抑制肿瘤血管生成等作用,使CRA有可能成为前景广阔的抗肿瘤药物,更多的生物功能及其作用途径有待更进一步研究。
[1] Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics 2016[J].CA Cancer J Clin,2016,66(4):271-289.
[2] 张军要,梁树才,朱宝安.科罗索酸调控STAT3信号通路诱导结肠癌LoVo细胞凋亡[J].医药导报,2016,35(1):31-34.
[3] Horlad H,Fujiwara Y,Takemura K,et al.Corosolic acid impairs tumor development and lung metastasis by inhibiting the immunosuppressive activity of myeloid-derived suppressor cells[J].Mol Nutr Food Res,2013,57(6):1046-1054.
[4] 郭世玉,郝昕.结肠腺癌组织中MMP-2和MMP-9的表达[J].肿瘤基础与临床,2015,28(4):289-290.
[5] Zeng ZS,Cohen AM,Guillem JG.Loss of basement membrane type IV collagen is associated with increased expression of metalloproteinases 2 and 9 (MMP-2 and MMP-9) during human colorectal tumorigenesis[J].Carcinogenesis,1999,20(5):749-755.
[6] Kim SJ,Cha JY,Kang HS,et al.Corosolic acid ameliorates acute inflammation through inhibition of IRAK-1 phosphorylation in macrophages[J].BMB Rep,2016,49(5):276-281.
[7] Lee MS,Cha EY,Thuong PT,et al.Down-regulation of human epidermal growth factor receptor 2/neu oncogene by corosolic acid induces cell cycle arrest and apoptosis in NCI-N87 human gastric cancer cells[J].Biol Pharm Bull,2010,33(6):931-937.
[8] Ku CY,Wang YR,Lin HY,et al.Corosolic acid inhibits hepatocellular carcinoma cell migration by targeting the VEGFR2/Src/FAK pathway[J].PLoS One,2015,10(5):e0126725.
[9] Yoo KH,Park JH,Lee DY,et al.Corosolic acid exhibits anti-angiogenic and anti-lymph angiogenic effects on in vitro endothelial cells and on an in vivo CT-26 colon carcinoma animal model[J].Phytother Res,2015,29(5):714-723.
[10]张军要,朱宝安,梁树才.科罗索酸对人结肠癌LoVo细胞裸鼠移植瘤的抑制作用研究[J].现代预防医学,2015,42(22): 4147-4149.
[11]Ao N,Liu Y,Bian X,et al.Ubiquitin-specific peptidase 22 inhibits colon cancer cell invasion by suppressing the signal transducer and activator of transcription 3/matrix metalloproteinase 9 pathway[J].Mol Med Rep,2015,12(2):2107-2113.
Corosolic Acid Down Regulate the Expression of MMP-2 and MMP-9 and Inhibit the Migration and Invasion of LoVo Cell
ZHANG Jun-yao, LIANG Shu-cai, ZHU Bao-an
(Department of Biochemistry,Luohe Medical College,Luohe 462002, China)
ObjectiveTo investigate the effect and mechanism of corosolic acid on cell migration and invasion of LoVo cells.MethodsLovo cells were divided into four groups and treated with 0, 5, 10 and 20 μmol·L-1of corosolic acid, and the scratch healing rate were tested when LoVo cells interacted with different concentrations of corosolic acid for 24h. Cell invasion was tested by transwell assay. Expression of MMP-2 and MMP-9 were tested by transwell and western blot.ResultsAfter treated with different concentration of corosolic acid, the healing rate of control and treated groups were (72.01±6.88)%, (71.21±6.05)%, (48.36±5.69)% (compared with control group,P<0.05) and (29.18±5.57)% (compared with control group,P<0.01) respectively. Transwell assay showed that the numbers of invasion cells of control and treated groups were 316.04±38.25, 266.02±21.02, 151.13±8.51 (compared with control group,P<0.01) and 147.68±7.90 (compared with control group,P<0.01). The expression of MMP-2 and MMP-9 showed a decreasing trend.ConclusionCorosolic acid inhibited the migration and invasion of LoVo cell in a dose dependent manner, it might be involved in the down regulation of the expression of MMP-2 and MMP-9.
corosolic acid;colon cancer;MMP-2;MMP-9
1672-688X(2017)01-0011-03
10.15926/j.cnki.issn1672-688x.2017.01.004
河南省基础与前沿科技计划项目(132300410466)
2016-12-09
漯河医学高等专科学校生物化学教研室,河南漯河 462002
张军要(1982—),男,河南许昌人,讲师,从事肿瘤信号通路及抗肿瘤药物筛选研究。
R735.3;R285.5
A

