槐定碱通过Caspase-3介导的人胰腺癌细胞株capan-1凋亡机制研究
任丽平,李先佳,金少举
·基础医学·
槐定碱通过Caspase-3介导的人胰腺癌细胞株capan-1凋亡机制研究
任丽平1,李先佳2,金少举1
目的 探讨槐定碱对人胰腺癌细胞株capan-1凋亡及Caspase-3信号通路的影响。方法 CCK-8检测槐定碱对capan-1细胞活力的影响,Hoechest 33342染色法观察细胞凋亡,分光光度法检测Caspase-3的活性。结果与对照组比较,槐定碱能明显抑制capan-1细胞生长(P<0.05),促进capan-1细胞凋亡(P<0.05),上调Caspase-3的活性(P<0.05)。结论 槐定碱抑制capan-1细胞增殖,促进细胞凋亡与下调Caspase-3的活性相关。
胰腺癌;capan-1;槐定碱;Caspase-3
槐定碱(sophoridine,SR)为中药苦豆子(sophora alopecuroides)中有效活性成分之一[1],对绒癌、恶性葡萄胎等恶性滋养细胞肿瘤具有较好的抑制作用[2]。研究证实Caspase-3信号通路在多种肿瘤的发生和发展中扮演着重要的角色[3]。本实验采用槐定碱对人胰腺癌细胞株capan-1诱导凋亡作用,通过分析Caspase-3活性及采用其抑制剂后细胞凋亡的变化,探讨其具体作用机制。现报道如下。
1 材料与方法
1.1 材料和仪器 槐定碱(宁夏盐池县医药公司提供,批号:060630,纯度>99%)。胎牛血清(杭州四季青生物技术公司,批号:140130);CCK-8细胞活力检测试剂盒(日本Dojindo);DMEM培养基(Dulbeco′s modified eagle medium,DMEM)(美国Hyclone公司,批号:NAE1396);Hoechst33342 荧光染料(碧云天生物技术有限公司,批号:1022);Caspase-3活性检测试剂盒(南京建成生物工程研究所,批号:20140312);Ac-DEVD-CHO(南京凯基生物公司,批号:20140914);TE2000型倒置荧光显微镜(日本Nikon公司);ST-360酶标仪(上海科华实验系统有限公司)。
1.2 方法 capan-1细胞株由漯河医专分子生物学实验室传代保种,用含10%胎牛血清的 DMEM培养基在37 ℃、5% CO2条件下培养,用 0.25%的胰蛋白酶-乙二胺四乙酸(eathylene diamine tetraacetic acid,EDTA)消化。槐定碱采用DMEM溶解至20 g·L-1,保存于-20 ℃ ,备用。
1.2.1 细胞活力检测 取对数期密度为1×104个·mL-1capan-1细胞悬液100 μL接种于96孔板,贴壁后24 h同步化,弃上清。参考前期[4]研究选择设立SR2.5 g·L-1组、SR5 g·L-1组、抑制剂+SR5 g·L-1组(简称抑制组)及对照组,对照组加10%胎牛血清的DMEM的培养基,SR2.5 g·L-1组和SR 5 g·L-1组分别加浓度为2.5 g·L-1、5 g·L-1槐定碱且含10%胎牛血清的 DMEM培养基,抑制剂+SR 5 g·L-1组加含10%胎牛血清、5 g·L-1槐定碱及100 μmol·L-1的Ac-DEVD-CHO的DMEM的培养基,阴性对照组给予等量培养液,每组设置3个复孔,37 ℃、5% CO2条件下培养48 h,加入CCK-8 10 μL/孔孵育2 h,酶标仪于570 nm检查光密度值,计算细胞活力。
1.2.2 capan-1细胞凋亡观察 采用Hoechest 33342染色法,参照“1.2.1”法设置各组,37 ℃、5%CO2温箱培养48 h后,弃去上清,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3次,每孔加入Hoechest 33342染色液10 μL,4 ℃,避光染色5 min,倒置荧光显微镜下观察细胞凋亡形态变化,并计数凋亡细胞,计算凋亡率。
1.2.3 分光光度法检测Caspase-3活性 参照“1.2.1”法设置各组。细胞培养48 h后终止培养,0.05%胰酶消化并收集细胞,PBS洗涤1次,按照每200万细胞50 μL的比例加入裂解液,冰浴裂解30 min,4 ℃12 000 r·min-1离心15 min,取上清,0.05%胰酶消化收集细胞, Bradford法测定蛋白的量,取50 μL含150 μg蛋白的细胞裂解上清,加入50 μL 2×反应液和5 μL Ac-DEVD-pNA,37 ℃避光孵育4 h,酶标仪在波长400 nm检测测定吸光度值。

2 结果
2.1 细胞活性检测 与对照组比较,2.5 g·L-1、5 g·L-1槐定碱能明显降低capan-1细胞活力(P<0.05)。抑制组细胞活力明显高于SR5 g·L-1组(P<0.05),见图1。

①与对照组比较,P<0.05,②与抑制组比较,P<0.05。图1 SR对capan-1活力的影响
2.2 capan-1细胞凋亡观察 图2显示,对照组细胞包膜完整,细胞核形态比较规则,细胞核和细胞质着色较深,发光均匀,呈现正常的蓝色。抑制组出现部分细胞破碎和少量的凋亡小体。SR组细胞核致密浓染,部分颜色发白,而SR5 g·L-1组部分细胞的细胞核碎裂,产生较多凋亡小体。

图2 capan-1细胞凋亡观察(Hoechet 33342, ×200)
2.3 细胞凋亡率和Caspase-3活性的比较 与对照组比较,抑制组细胞capan-1细胞凋亡率和Caspase-3活性明显升高,均有统计学差异(P<0.05);与抑制组比较,SR2.5 g·L-1组、SR5 g·L-1组capan-1细胞凋亡率和Caspase-3活性明显高于抑制组,均有统计学差异(P<0.05),见图3-4。
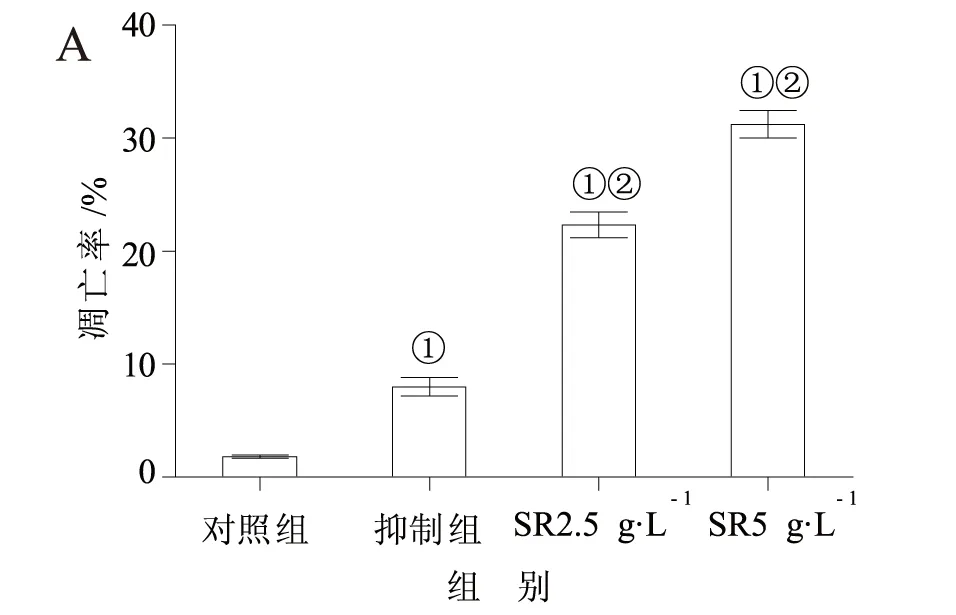
图3 细胞凋亡率的比较

①与对照组比较,P<0.05;②与抑制组比较,P<0.05。图4 Caspase-3活性的比较
3 讨论
胰腺癌为常见的恶性肿瘤,病死率较高,目前手术治疗为主,辅以放疗、化疗及中医疗法等多种方法,但治疗后的复发率和转移率依然没有得到有效控制。槐定碱是一种生物碱类活性成分,对癌细胞具有直接杀伤作用,且毒性较低[5]。本研究采用CCK-8法比较了槐定碱对胰腺癌细胞株capan-1活力的影响,结果表明,槐定碱有可能通过上调Caspase-3活性来抑制capan-1的活力,并促进了胰腺癌细胞株capan-1凋亡,产生碎片或变小。槐定碱与Caspase-3活力抑制剂联用时,槐定碱对capan-1的活力和凋亡的影响能力明显减弱,可能是由于抑制剂抑制capan-1细胞中Caspase-3信号通路,拮抗槐定碱通过线粒体路径诱导的细胞凋亡,同时降低capan-1的活力。
研究显示,胰腺癌的发生与细胞凋亡失衡有关,诱导细胞凋亡可以有效地治疗肿瘤[6]。本研究采用Hoechst33342染色显示,不同质量浓度的槐定碱作用后,部分细胞核发生碎裂,核染色质呈分叶、碎片状,提示槐定碱可能通过某种方式诱导并促进了胰腺癌细胞株capan-1凋亡。Caspase-3是Caspase家族重要成员之一,在多种刺激物诱导的凋亡中起到关键作用,为细胞凋亡的执行蛋白。一般而言,细胞在凋亡信号的刺激下,通过各种凋亡信号启动级联反应,其中proCasepase-3断裂产生具有活性的Cleaved Caspase-3,裂解多聚(ADP-核糖)聚合酶,同时诱发线粒体产生细胞色素C,并启动后续的线粒体凋亡。本研究结果显示,2.5 g·L-1、5 g·L-1槐定碱作用于capan-1细胞后,Caspase-3活性明显升高,细胞凋亡率明显增加,加入Caspase-3抑制剂后,capan-1细胞凋亡率明显降低,提示槐定碱通过Caspase-3途径诱导线粒体路径细胞凋亡。但在此过程中,槐定碱capan-1细胞线粒体功能的影响还有待进一步研究。
总之,槐定碱能通过调节Caspase-3信号通路中Caspase-3的表达水平,促进capan-1细胞凋亡,从而发挥较好的抗肿瘤效果。
[1] 许婷,严祥.苦豆子生物碱对消化系统炎性疾病的影响[J].国际消化病杂志,2015,53(1):52-54.
[2] 闫德祺,闫英男,阿力木·买买提,等.苦参活性成分的抗肿瘤作用机制研究进展[J].现代生物医学进展,2014,14(24):4776-4779.
[3] Carlisi D,D′Anneo A,Angileri L,et al.Parthenolide sensitizes hepatocellular carcinoma cells to TRAIL by inducing the expression of death receptors through inhibition of STAT3 activation[J].J Cell Physiol,2011,226(6):1632-1641.
[4] 任丽平,李先佳,金少举.槐定碱对人胰腺癌细胞株capan-1增殖及侵袭能力的影响[J].河南科技大学学报(医学版),2016,34(4):244-246.
[5] 严继贵,杨宇清,王雅洁,等.槐定碱抗骨癌痛作用及其机制研究[J].中国中药杂志,2013,59(23):4134-4137.
[6] 马佳,方斌斌,曾凡鹏,等.葡萄籽原花青素下调miR-27a表达抑制胰腺癌细胞生长[J].中南大学学报(医学版),2015,40(1):46-52.
Effect of Sophoridine on Apoptosis of Human Pancreatic Cancer Cell Line Capan-1 by Caspase-3 Signaling Pathway
REN Li-ping1, LI Xian-jia2, JIN Shao-ju1
(1.Department of Pharmacology,Luohe Medical College,Luohe 462002,China; 2.Department of Biochemistry,Luohe Medical College,Luohe 462002,China)
ObjectiveTo investigate the effects of sophoridine on apoptosis of human pancreatic cancer cell line capan-1 by Caspase-3 signaling pathway.MethodsCCK-8 was used to detect the effect of sophoridine on the viability of capan-1 cells. Apoptosis was observed by Hoechest 33342 staining. The expression of Caspase-3 was detected by spectrophotometry.ResultsCompared with the control group, sophoridine could significantly inhibit the growth of capan-1 cells(P<0.05), promote cell apoptosis(P<0.05), up-regulate the expression of Caspase-3(P<0.05).ConclusionSophoridine could inhibit the proliferation of capan-1 cells and promote cell apoptosis, which was related to the up-regulation of Caspase-3.
pancreatic cancer; capan-1; sophoridine; Caspase-3
1672-688X(2017)01-0001-03
10.15926/j.cnki.issn1672-688x.2017.01.001
2.河南省高等学校重点科研资助项目(16B310004)
2016-01-17
1.漯河医学高等专科学校药理教研室,河南漯河 462002 2.漯河医学高等专科学校生化教研室,河南漯河 462002
任丽平(1984—),女,河南舞阳人,讲师,从事肿瘤药理学研究。
金少举,博士,副教授,E-mail:37050573@qq.com
R966;R735.9
A
1.河南省科技攻关计划(社会发展领域)(162102310596)
3.漯河医学高等专科学校2016年度校级研究资助计划 项目(2016-S-LMC-13)

