不同碘剂对131I辐射致甲减大鼠抗氧化能力与食盐加碘安全性的研究
龚建瑜,陈雪梅,常锐碧,张建博,韩春妮,范 源
不同碘剂对131I辐射致甲减大鼠抗氧化能力与食盐加碘安全性的研究
龚建瑜1,陈雪梅1,常锐碧1,张建博1,韩春妮1,范 源2
目的 分析131I辐射导致SD大鼠甲减后,碘化钾、碘酸钾对大鼠抗氧化能力的影响,探讨不同剂型碘盐食用的安全性。方法 3月龄健康雄性SD大鼠43只,随机分为5组:空白对照组7只、对照组9只、甲状腺片组(优甲乐组)9只、碘化钾组9只、碘酸钾组9只。除空白对照组外,其余4组均给予131I灌胃2周建立甲状腺功能减退大鼠模型。其后,空白对照组、对照组给予生理盐水,其他组给予相应的药物。4周后测定大鼠血清中游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激(TSH)水平,同时测定血液中谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)以及过氧化氢酶(CAT)含量。结果 与对照组相比,甲状腺片组、碘化钾组、碘酸钾组GSH-Px水平均显著升高(均P<0.05);甲状腺片组、碘化钾组SOD水平均显著降低(均P<0.05),而碘酸钾组CAT 水平显著升高(P<0.05)。结论 碘化钾与甲状腺片均能减轻131I辐射甲状腺功能减退的氧化损伤;与碘酸钾相比,碘化钾能提高甲状腺组织抗氧化能力,提示碘化钾作为主要补碘制剂运用于食盐安全性较高。
131I;甲状腺功能减退;碘化钾;碘酸钾;抗氧化
131I治疗甲状腺功能亢进方法简便、安全、经济、疗效好及复发率低,被很多患者及医师接受。131I衰变为131Xe时放出β射线,使甲状腺组织产生炎症、萎缩,直至功能丧失等变化而达到治疗目的。甲状腺功能减退是131I治疗甲亢后最常见也是最严重的并发症,主要原因为辐射产生的自由基原发性与继发性损害甲状腺组织的综合作用结果,自由基的大量生成可导致细胞损伤、突变、癌症以及衰老等生物过程[1]。碘是合成人体或者动物体内甲状腺激素的最基本元素。碘的生理功能主要有促进生物氧化、调节蛋白质合成分解、调节糖和脂肪代谢、调节水盐代谢、促进生长发育等。缺碘会影响甲状腺,导致一系列甲状腺疾病[2-4],适当补碘可增强抗氧化能力和增强甲状腺功能。碘化钾(potassium iodide,KI)和碘酸钾(potassium iodate,KIO3)作为主要的补碘制剂,有着不同的化学性质和生物效应。2002年法国食品安全机构发现碘酸钾代替碘化钾作为主要的补碘制剂出现了问题。Bürgi等[5]综述了1941~2000年50多篇文献,也重申了碘酸钾盐的安全性。随着科学研究的不断深入,关于加碘剂型的争议日益增大。本研究用131I甲状腺功能减退模型分析碘化钾、碘酸钾对大鼠抗氧化能力与不同食用性碘盐的安全性,报道如下。
1 材料与方法
1.1 实验动物 清洁级雄性SD大鼠43只,体质量(220±20)g(合格证:0003429,许可证:scxk(川)2013-24),所有动物购回后适应性喂养1周,采用普通饲料,自来水喂养,无不良反应。
1.2 药物与试剂 左甲状腺素纳片(Merck KgaA,德国,证号:H20100524);碘化钠(Na131I)制备液购自云南省第一人民医院;游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free throxine,FT4)、促甲状腺激(thyrotrophic hormone,TSH)试剂盒均购自上海酶联生物科技有限公司(批号:201409)。
1.3 实验仪器 352型酶标仪(Labsystems Multiskan MS,芬兰);AC8洗板机(Thermo Labsystems,芬兰)。
1.4 药物制备 Na131I制备液:将131I混于0.9%生理盐水中制成。左甲状腺素钠制备液:左甲状腺素钠片研碎,按药物∶动物(18 μg∶1 kg)的比例称取,用生理盐水配成混悬液。碘化钾制备液按药物∶动物(230 μg∶1 kg)的比例称取,用生理盐水配成混悬液。碘酸钾制备液按药物∶动物(230 μg∶1 kg)的比例称取,用生理盐水配成混悬液。
1.5 动物分组与造模 适应性喂养1周后,将43只大鼠随机分成5组,空白对照组(n=7,本实验初选空白对照组9只,实验开始前死亡2只,故移除)、对照组(n=9)、甲状腺片组(n=9)、碘化钾组(n=9)、碘酸钾组(n=9)。造模组(对照组、甲状腺片组、碘化钾组、碘酸钾组)均灌胃Na131I溶液1 mL·100 g-1,空白对照组大鼠给予等体积生理盐水,每日1次连续2周后,由大鼠目眦取血1.5 mL,离心分离血清检测FT3、FT4、TSH。
1.6 各组给药 造模成功后,各组分别连续给予相应药物4周,每3 d称重以调整给药量,各组给药量具体如下:空白对照组、对照组按1 mL·100 g-1剂量,每日给予生理盐水1次;甲状腺片组:左甲状腺素纳制备液(10 μg·kg-1); 碘化钾组:给予碘化钾制备液(230 μg·kg-1);碘酸钾组给予碘酸钾制备液(230 μg·kg-1)。
1.7 生化检测 给药治疗4周后,将各组大鼠禁食、不禁水12 h,由大鼠目眦取血1.5 mL,离心,取血清,分别用以检测甲状腺功能TSH、FT3、FT4,用放射免疫法检测血清FT3、FT4,用双抗夹心法检测TSH水平。
1.8 抗氧化能力检测 给药治疗4周后,将各组实验大鼠禁食不禁水12 h,由大鼠目眦取血1.5 mL,离心,取血清,分别用化学发光法、比色测定法、钼酸铵显色法测定超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化物酶(catalase,CAT)的含量。

2 结果
2.1 空白对照组与造模组大鼠甲状腺功能比较 与空白对照组相比,对照组大鼠饮食及饮水减少,体质量减少,甲状腺功能减退组大鼠随着病程的进展甲状腺功能减退,大鼠体质量逐渐减轻。血清FT3、FT4降低及TSH升高。造模2周后与空白对照组比较,甲状腺功能减退模型组大鼠血清FT3、FT4显著下降,TSH明显升高,说明大鼠出现131I所致的甲状腺功能低下,造模成功,见表1。
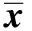
表1 空白对照组与甲状腺功能减退模型组比较(±s)
2.2 给药4周后大鼠甲状腺功能指标比较 与对照组相比甲状腺片组、碘化钾组、碘酸钾组GSH-Px水平均上升,差异有统计学意义(均P<0.05);与对照组相比甲状腺片组、碘化钾组CAT均无明显变化,而碘酸钾组明显上升,差异有统计学意义(P<0.05);与对照组相比甲状腺片组、碘化钾组SOD水平明显下降,差异有统计学意义(均P<0.05),碘酸钾组无明显变化,见表2。
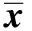
表2 各组大鼠甲状腺功能指标比较(±s) U·mL-1
注:SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;CAT:过氧化物酶。
3 讨论
食盐加碘是迄今为止消除碘缺乏病满足正常人生理功能需要的最佳战略。碘化钾易被氧化成碘或者被蒸发散失[5],碘酸钾化学性质稳定,有便于加工、运输、储存,不易潮解流失的优点,在发展中国家得到了广泛应用[6]。碘化钾的生物利用度高于碘酸钾,且在含碘的植物中碘化钾的作用强于碘酸钾[7-9]。甲状腺激素中含的碘为负一价的碘离子,当碘酸根正5价的碘离子摄入体内,不能直接参与合成甲状腺激素,它先要夺取相关组织的6个电子,才能合成甲状腺激素,发挥补碘作用[10]。在此过程中体内代谢需消耗GSH等含巯基的还原剂,有可能使体内氧化和抗氧化平衡失调,导致一系列自由基反应加剧,在补碘的同时也产生氧化损伤。国外研究发现,在实验研究中碘酸钾基因毒性的影响无法显示[11],也不能改善甲状腺组织脂质过氧化损伤程度[12]。因此部分研究人员对于碘酸钾作为主要补碘制剂产生质疑。
正常状态下,甲状腺机能受到两种机制的调节,即下丘脑—垂体腺轴的调节和甲状腺素的调节。碘、Fe2+、H2O2也会影响氧化还原平衡[13],是合成甲状腺激素的必需微量元素[14]。研究发现,细胞内的碘含量超过10-3M会阻碍甲状腺素合成[15],这一反应被称为午—蔡二式效应。甲状腺中碘过量这一效应对DNA、脂类、蛋白质等大分子物质存在潜在的毒性[13],可引起甲状腺功能减退。甲状腺功能减退会导致抗氧化酶合成降低[16],造成自由基冗余引起氧化损伤。有研究发现不论适量还是大剂量碘酸钾均比同剂量的碘化钾对机体的氧化损伤更加显著[17-19]。SOD、GSH-Px、CAT作为机体最主要的抗氧化酶可及时清除自由基,降低对生物膜的攻击,减少氧化损伤。碘化钾和碘酸钾作为主要的强化盐,存在潜在的毒性,酸钾盐的安全性受到了质疑。于志恒等[20]研究报道使用碘酸钾时,人群尿碘升高到300 μg·L-1,甲状腺肿大比例随之上升;而不使用碘酸钾时尿碘升高至400 μg·L-1,甲状腺肿大比例下降,只有尿碘升高到800 μg·L-1,甲状腺肿大比例才会升高,显示甲状腺对碘酸钾盐耐受性不高。
本实验表明131I辐射后甲状腺机能减退后补充碘剂后与对照组相比,其他给药组血清中SOD、GSH-Px、CAT水平均上升。说明补充碘剂后,甲状腺功能和抗氧化能力得到一定的恢复。其中,优甲乐组与碘化钾组SOD、GSH-Px、CAT水平上升明显(均P<0.05),而碘酸钾组变化不明显。使用同剂量的碘化钾和碘酸钾,碘化钾组甲状腺抗氧化物酶水平升高,碘酸钾对甲状腺组织的抗氧化损伤无明显的改善作用。造成这一结果的影响因素很多,首先可能是由于碘化钾与碘酸钾化学性质不同,I-只需要一步就氧化成I2;而IO3-则需要先氧化成I-再氧化成I2。这一过程需要更多的时间和能量,氧化损伤程度更深;其次无机碘能中和H2O2,阻止其在芬顿反应中分解成OH-,进一步减弱氧化损伤;也可能I-在线粒体水平上通过氧化或过氧化过程直接影响抗肿瘤作用[21]。除此之外,碘酸钾属于卤化盐,本身存在毒性[5]。
综上分析,碘化钾与甲状腺片均能减轻131I辐射甲状腺功能减退的氧化损伤。与碘酸钾相比,碘化钾能提高甲状腺组织抗氧化能力,提示碘化钾作为主要补碘制剂运用于食盐安全性较高。
[1] 李龙囡.抗氧化功能因子对高脂膳食小鼠脂代谢的调节作用及其机制研究[D].江南大学,2013.
[2] 孙尧,于杰,方学东.碘131在甲状腺疾病中的应用[J].中国地方病防治杂志,2012,5(27):391-392.
[3] Zimmermann MB,Andersson M.Assessment of iodine nutrition in populations:past,present,and future[J].Nutr REV,2012,70(10):553-570.
[4] Pearce EN,Andersson M,Zimmermann MB.Global iodine nutrition:where do we stand in 2013[J].Thyroid,2013,23(5):523-528.
[5] Bürgi HS,Chaffner TH,Seiler JP.The toxicology of iodate:a review of the literature[J].Thyroid,2001,11(5):449-456.
[6] 王伟,刘爽.碘化钾和碘酸钾对碘缺乏大鼠晶状体影响的对比研究[J].武警医学,2010,21(6):474-478.
[7] Li Q,Mair C,Schedle K,et al.Effect of iodine source and dose on growth and iodine content in tissue and plasma thyroid hormones in fattening pigs[J].Eur J Nutr,2012,51(6):685-691.
[8] Zhu YG,Huang YZ,Hu Y,et al.Iodine uptake by spinach (Spinacia oleracea L.) plants grown in solution culture:effects of iodine species and solution concentrations[J].Environ Int,2003,29(1):33-37.
[9] Voogt W,Holerda HT,Khodabaks R.Biofortification of lettuce (Lactuca sativa L) with iodine:the effect of iodine form and concentration in the nutrient solution on growth,development and iodine uptake of lettuce grown in water culture[J].J Sci Food Agric,2010,90(5):906-913.
[10]赵文德,邱明才.碘酸钾的氧化损伤作用及对甲状腺的影响[J].中国地方病学杂志,2013,32(3):343-346.
[11]Poul JM,Huet S,Godard T,et al.Lack of genotoxicity of potassium iodate in the alkine comet assay and in the cytokinesis-block micronucleus test.comparison to potassium bromate[J].Food Chem Toxcol,2004,42(2):203-209.
[12]Milczarek M,Stepniak J,Lewiński A,et al.Potassium iodide,but not potassium iodate,as a potential protective agent against oxidative damage to membrance lipids in porcine thyroid[J].Thyroid Res,2013,6(10):2-8.
[13]Karbownik-Lewinska M,Stepniak J,Stepniak J,et al.Protective effect of KI in porcine thyroid:comparison with KIO3and nDNAs[J].Eur J Nutr.2015,54(2):319-323.
[14]叶振坤,林来祥,孙毅娜,等.不同剂量碘酸钾对大鼠血液抗氧化能力的影响[J].环境与健康杂志,2007,24(7):195-197.
[15]Bürgi H.Iodine excess[J].Best Prace Res Clin Endocrinol Metab,2010,24(1):107-115.
[16]Venditti P,De Rosa R,Di Meo S.Effect of thyroid state on H2O2production by rat liver mitochondria[J].Mol cell Endocrinol,2003,205(1-2):185-192.
[17]杜琳琳,高金霞,刘守军,等.碘酸钾、碘化钾对小鼠脑组织抗氧化能力影响的动态对比研究[J].中国地方病防治杂志,2008,28(5):328-330.
[18]张翼,王海燕,李军延,等.不同剂量的碘化钾与碘酸钾对大鼠血浆抗氧化能力的影响[J].中国地方病防治杂志,2013,28(3):166-168.
[19]王路.不同剂量碘化钾与碘酸钾对大鼠血液抗氧化能力、血脂水平及甲状腺功能的影响[D].中国疾病预防控制中心,2012.
[20]于志恒,刘守军.关于碘干预性甲状腺问题的讨论[J].中国地方病学杂志,2001,20(5):388.
[21]Shrivastava A,Tiwari M,Sinha RA,et al.Molecular iodine induces caspase-independent apoptosis in human breast carcinoma cells involving the mitochondria-mediated pathway[J].J Biol Chem,2006,281(28):19762-19771.
Effects of Different Iodine on Antioxidative Ability of Hypothyroidism Rats Irradiated by131I and the Safety of Salt Iodization
GONG Jian-yu1, CHEN Xue-mei1, CHANG Rui-bi1, ZHANG Jian-bo1, HAN Chun-ni1, FAN Yuan2
(1.Yunnan University of Traditional Chinese Medicine,Kunming 650500,China; 2. First Affiliated Hospital of Yunnan University of Traditional Chinese Medicine,Kunming 650500,China)
ObjectiveTo analyze the security of different idodine salt according to antioxidative capacity of SD rat with hypothyroidism by131I radiation.MethodsForty three healthy SD rats(3 months old) were randomly divided into five groups: blank control group(7), conditional group(9), thyroid tablets group(9), potassium iodide group(9) and potassium iodate group(9). In addition to the blank control group, the other groups were given solution1311 orally for two weeks to obtain the model of hypothyroidism rat. Blank control group and conditional control group were given normal saline; the other groups were given the related drugs. The levels of free triiodothyronine(FT3), free thyroxine(FT4), thyroid stimulating bowel (TSH), glutathione peroxidase (GPx), superoxide dismutase (SOD) and catalase (CAT) in rat serum were detected after 4 weeks.ResultsCompared with control groups, the thyroid tablets group, potassium iodide group and potassium iodate group show a high level of GSH-Px (allP<0.05), and the thyroid tablets group and potassium iodide group show a low level of SOD (allP<0.05); the serum level of CAT increased in potassium iodate group (P<0.05).ConclusionThe potassium iodide and thyroid tablets could reduce the oxidative damage of hypothyroidism by131I radiation. Compared with potassium iodate, potassium iodide can increase the antioxidative capacity of thyroid tissue, which means potassium iodide had more security as salt iodization.
131I;hypothyroidism;potassium iodide;potassium iodate;antioxidants
1672-688X(2017)01-0007-04
10.15926/j.cnki.issn1672-688x.2017.01.003
云南省科技计划项目(2015-2-H-01365)
2016-11-15
1.云南中医学院,云南昆明 650500 2.云南中医学院第一附属医院,云南昆明 650500
龚建瑜(1991—),女,云南玉溪人,从事中药药理及应用研究。
范源,男,教授,E-mail:1647904799@qq.com
R581;R817.8
A

