单羟基咔咯锰(III)配合物的合成及其与DNA的相互作用
杨文聪, 莫婷婷, 林泽檀, 曾淑莹,方玉琦, 江 涛, 史 蕾
(广东第二师范学院 化学系,广东 广州 510303)
·快递论文·
单羟基咔咯锰(III)配合物的合成及其与DNA的相互作用
杨文聪, 莫婷婷, 林泽檀, 曾淑莹,方玉琦, 江 涛, 史 蕾*
(广东第二师范学院 化学系,广东 广州 510303)
以五氟苯基二吡咯烷烃为原料,与对羟基苯甲醛经缩合反应合成了单羟基自由咔咯(1); 1与醋酸锰反应合成了一种单羟基咔咯锰配合物——10-(4-羟基苯基)-5,15-二(2,3,4,5,6-五氟苯基)咔咯锰(III)配合物,其结构经UV-Vis和HR-MS(ESI)表征。通过紫外滴定、荧光滴定、圆二色谱和琼脂糖凝胶电泳实验探讨了其催化氧化DNA的活性。
五氟苯基二吡咯烷烃; 咔咯; 锰; DNA; 氧化断裂; 合成
咔咯是具有18-π电子结构的卟啉类大环化合物,咔咯典型的配位化学特征使其可与多种金属结合形成高价态金属配合物[1-2]。研究发现,咔咯及其金属配合物在人工核酸酶及抗肿瘤方面有巨大的应用前景[3-5]。咔咯锰配合物结构稳定、中心金属锰具有良好的氧化还原特性,预示着其在催化氧化DNA方面可能具有优良的活性[1]。
2007年,Gross课题组[6]合成了水溶性阳离子型金属咔咯锰配合物,利用圆二色光谱研究了其与DNA的相互作用模式。随后,一系列阴离子型磺化、羧基型咔咯及阳离子吡啶基咔咯锰配合物被合成,其催化氧化DNA活性及与DNA的结合模式被系统研究[7-10]。单羟基咔咯在抗肿瘤方面具有独特的优势[11-12],刘海洋等[13]发现,单
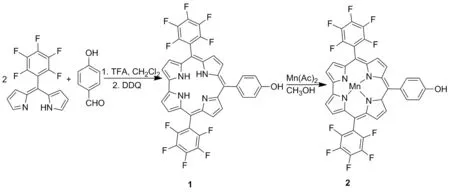
Scheme 1
羟基锰配合物和高浓度过氧化氢反应8 h,可以引起DNA发生有效断裂,但未对配合物和DNA的结合模式进行深入研究。
本文以五氟苯基二吡咯烷烃为原料,与对羟基苯甲醛经缩合反应合成了单羟基自由咔咯(1); 1与醋酸锰反应合成了一种单羟基咔咯锰配合物——10-(4-羟基苯基)-5,15-二(2,3,4,5,6-五氟苯基)咔咯锰(III)配合物(2, Scheme 1),其结构经UV-Vis和HR-MS(ESI)表征。由于2显顺磁性,因此无法获得核磁信号,通过紫外滴定、荧光滴定、圆二色谱推测2与ct-DNA的结合模式为外部结合,通过琼脂糖凝胶电泳实验探讨了其催化氧化DNA活性。
1 实验部分
1.1 仪器与试剂
UV-Vis 2450型紫外-可见分光光度计;RF-5301PC型荧光分光光度计;Agilent1290/maXis impact型超高压液相色谱-高分辨质谱联用仪;J-810型圆二色光谱仪;31-CN型凝胶电泳仪;BIO-RAD Gel Dox XR+凝胶自动成像分析系统。
小牛胸腺DNA(ct-DNA),Sigma公司;pBR322 DNA,大连宝生物工程有限公司;三羟甲基甲胺(Tris)、氯化钠(NaCl)、硼酸(H3BO3)、琼脂糖、溴酚蓝、溴化乙锭(EB),生物纯,上海生工生物工程公司;其余所用试剂均为分析纯,实验用水为去离子水。
1.2 合成
(1) 1的合成[13]
在100 mL圆底烧瓶中加入五氟苯基二吡咯烷烃499.2 mg(0.80 mmol)和二氯甲烷 50 mL,搅拌均匀;加入4-羟基苯甲醛48.8 mg(0.40 mmol)和三氟乙酸 20 μL(0.26 mmol),于室温反应7 h。注入三乙胺40 μL(0.30 mmol)中和三氟乙酸,加入二氯二氰基苯醌(DDQ) 182.0 mg(0.80 mmol),于室温反应2 h。用二氯甲烷淋洗,经硅胶柱层析(洗脱剂:二氯甲烷)纯化得粗产品。粗产品经硅胶柱层析[梯度洗脱剂:A=V(正己烷)∶V(二氯甲烷)=3 ∶1~2 ∶1]纯化,收集紫色条带蒸干得紫色粉末1,产率20.0%。
(2) 2的合成[13]
在50 mL圆底烧瓶中加入1 28.8 mg(0.04 mmol),甲醇20 mL和醋酸锰120.0 mg,于60 ℃反应2 h。旋干溶剂,残余物用混合溶剂[V(二氯甲烷)/V(水)=1/1]萃取,有机相经硅胶柱层析(洗脱剂A=1 ∶2)纯化,收集绿色条带,蒸干得绿色粉末2,产率90%; UV-Visλmax(relative intensity): 403(1.63), 416(1.71), 488(0.78) nm; HR-MS(ESI)m/z: Calcd for C37H13N4OF10Mn[M+]774.680 5, found 774.037 1。
1.3 2与ct-DNA的相互作用测试
在Tris-HCl缓冲溶液I(5 mmol·L-1Tris-HCl, 50 mmol·L-1NaCl, 2%DMF, pH 7.2)中测试2与ct-DNA的相互作用。其中,ct-DNA浓度通过测定其紫外-吸收光谱确定(ct-DNA在260 nm 处的摩尔消光系数为6 600 L·mol-1·cm-1)[14]。
1.4 氧化断裂DNA性能测定
向含有0.1 μg pBR322 DNA中加入不同浓度的2,同时加入过氧化氢(使得H2O2最终浓度为200 mmol·L-1)作为氧化剂,再加入Tris-HCl缓冲溶液Ⅱ(5 mmol·L-1Tris-HCl, 18 mmol·L-1NaCl, 2%DMF, pH 7.2),总体积为10 μL。避光反应2 h,琼脂糖凝胶电泳2 h(77 V, 30 mA),放入EB溶液中染色15 min,水冲洗后放入凝胶成像系统中成像。
2 结果与讨论
2.1 性质
(1) UV-Vis
2和ct-DNA有各自的UV-Vis谱图,但由于两者能够特异性结合,使得UV-Vis谱图也会产生相应的变化。因此UV-Vis谱图被认为是用于探索小分子物质与DNA相互结合模式最常用的方法。对于卟啉类分子,通常插入结合会导致其Soret带发生较大幅度减色效应(>35%),并伴随明显红移现象(>15 nm),而当发生外部结合模式时常伴随较小程度红移和减色效应[15]。如图1和图2所示,随着ct-DNA的加入,2的Soret带发生了较小程度减色效应,减色率为12.21%,并伴有微弱的红移(3 nm)。使用公式(1)计算其与DNA的结合常数为0.9659×105L·mol-1。据此,我们初步推测2与DNA的结合模式可能为外部结合。
(1)

λ/nm
(2) 荧光光谱
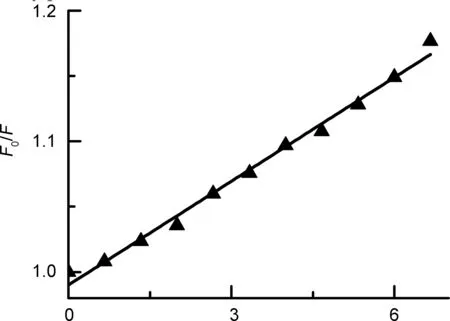
2自身没有荧光,本文采用溴化乙锭(EB)竞争的方法间接探索其与DNA的相互作用。EB自身荧光很弱,但与DNA结合后形成的EB-DNA体系在610 nm会有很强的荧光[16]。如图3和图4所示,随着2的加入,EB-DNA的荧光强度不断降低。通过Stern-Volmer方程[17][公式(2)]计算其对EB-DNA体系荧光猝灭常数(KSV)为2.648×104L·mol-1,较低的淬灭常数表明2与DNA之间作用较弱,不是通过插入结合方式作用的,这与前面紫外-可见光谱的结果是一致的。
F0/F=1+KSV[Q]=1+Kqτ0[Q]
(2)

[DNA]/(μmol·L-1)
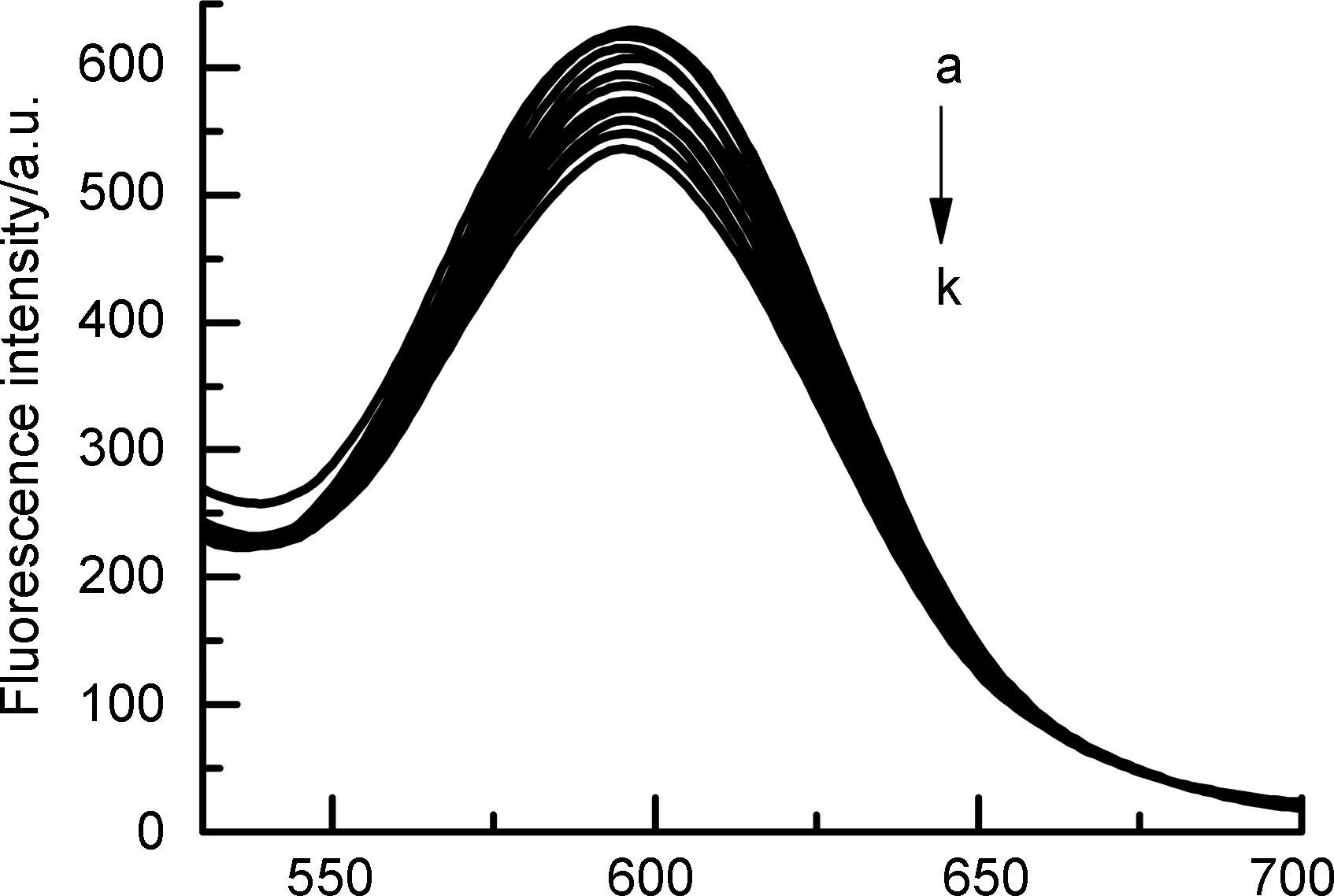
λ/nm
(3) 圆二色光谱
圆二色光谱是反映分子二级结构的一种光谱,许多体内大分子物质都有其特征CD光谱。通常小分子物质加入到DNA溶液中,会引起DNA的CD光谱强度发生变化,从而可以判定小分子物质与ct-DNA的结合模式。ct-DNA在246 nm处有一个B型DNA螺旋引起的负CD吸收峰,在275 nm处有一个DNA碱基对堆积引起的正CD吸收峰。一般来说,当小分子与DNA相互作用的时候还会在Soret带产生ICD峰:外部结合(正ICD或无ICD),插入模式(负ICD),自堆积模式(同时出现正负ICD)[17]。由图5可以看出,随着2的加入,在Soret带均未看到有ICD峰的出现,因此可进一步确定2与ct-DNA发生的是外部结合。
[2]/(μmol·L-1)
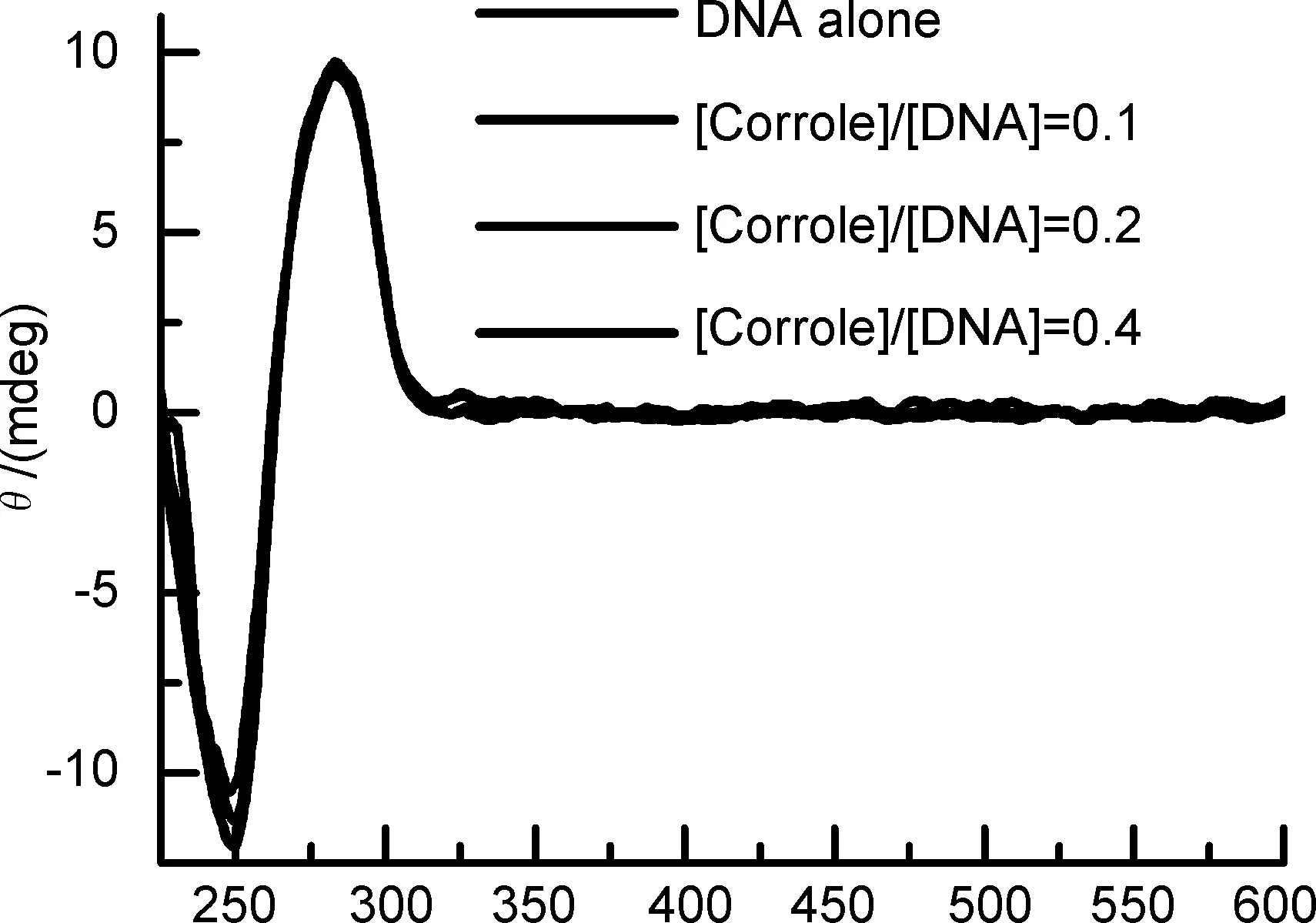
λ/nm
(4) 2氧化断裂pBR322 DNA
图6是2催化氧化DNA的琼脂糖凝胶电泳图。由图6可以看出,在只有DNA或2而没H2O2存在下,均未看到明显的DNA断裂(Lane 1, Lane 3)。而在H2O2存在下,有10%的Form II(缺刻型)DNA形成,这是因为H2O2自身具有一定的氧化能力,与文献结果类似[13]。而当2的浓度为10 μmol·L-1时(Lane 4),可以观察到有15%的FormⅡ型DNA形成,2的浓度越大,FormⅡ型DNA所占百分比则越大。当2的浓度达到60 μmol·L-1时(Lane 7),其氧化断裂DNA的活性最强,达到31%。

图6 pBR322 DNA与不同浓度的2的琼脂糖凝胶电泳图*
以五氟苯基二吡咯烷烃为原料,制得一种单羟基咔咯锰配合物——10-(4-羟基苯基)-5,15-二(2,3,4,5,6-五氟苯基)咔咯锰(III)配合物(2),其结构经UV-Vis和HR-MS(ESI)表征。由于2显顺磁性,因此无法获得核磁信号,通过紫外滴定、荧光滴定、圆二色谱推测2与ct-DNA的结合模式为外部结合,通过琼脂糖凝胶电泳实验探讨了其催化氧化DNA活性。结果表明,2以外部结合模式与ct-DNA相结合,且在H2O2存在下,其能有效催化氧化pBR322 DNA断裂。此发现对于开拓新型的人工核酸酶试剂及发展新型的抗癌试剂具有相应的理论和临床应用价值。
[1] Liu H Y, Mahmood M H R, Qiu S X,etal. Recent developments in manganese corrole chemistry[J].Coord Chem Rev,2013,267:1306-1333.
[2] Aviv-Harel I, Gross Z.Coordination chemistry of corroles with focus on main group elements[J].Coord Chem Rev,2011,255:717-736.
[3] Wang J M, Shi L, Liu H Y. Theinteraction of corrole and its metal complex with DNA and their anti-tumor activity[J].Progress in Chem,2015,27(6):755-762.
[4] 史蕾,杨文聪,曾淑莹,等. 新型单羟基氯代咔咯的合成及其光断裂DNA性质[J].合成化学,2016,24(4):312-315.
[5] 要永,周琳,朱卫华,等. 新型含氯(氟)的A2B型咔咯化合物的合成及其光学性质[J].合成化学,2015,23(10):948-951.
[6] Gershman Z, Goldberg I, Gross Z. DNA binding and catalytic properties of positively charged corroles[J].Angew Chem Int Ed,2007,46:4320-4324.
[7] Zhang Y, Wen J Y, Wang X L,etal. DNA binding and nuclease activity of cationic iron(Ⅴ) and manganese(Ⅲ) corrole complexes [J].Appl Organometal Chem,2014,28:559-556.
[8] Lu J, Liu H Y, Shi L,etal. DNA cleavage mediated by water-soluble manganese corrole[J].Chin Chem Lett,2011,22:101-104.
[9] Zhang Y, Chen H, Wen J Y,etal. Oxidative DNA cleavage mediated by water-soluble carboxyl iron(Ⅲ)corrole[J].Chem J Chinese Universities,2013,34(11):2462-2469.
[10] Huang J T, Wang X L, Zhang Y,etal. DNA binding and nuclease activity of a water-soluble sulfonated manganese(Ⅲ) corrole[J].Transition Met Chem,2013,38:283-289.
[11] Chang C K, Kong PW, Liu H Y,etal. Synthesis and photodynamic activities of modified corrole derivatives on nasopharyngeal carcinoma cells[J].Proc SPIE,2006,6139:613915-1-613915-11.
[12] Shi L, Yang W C, Zeng S Y,etal. DNA-binding and anti-tumor activities of cobalt corrole complexes[J].Chem J Chinese Universities,2016,37(6):1059-1068.
[13] Liu H Y, Liu L Y, Zhang L,etal. Oxidative DNA cleavage catalyzed by Mn(Ⅲ)corrole[J].Chem J Chinese Universities,2007,28:1628-1630.
[14] Sun Y, Hou Y J, Zhou Q X,etal. Dinuclear Cu(II) hypocrellin B complexes with enhanced photonuclease activity[J].Inorg Chem,2010,49:10108-10116.
[15] Pasternack R F, Gibbs E J, Villafranca J J. Interactions of porphyrins with nucleic acids[J].Biochem,1983,22:2406-2414.
[16] Sun Y T, Peng T T, Zhao L,etal. Studies of interaction between two alkaloids and double helix DNA[J].J Lumin,2014,156:108-115.
[17] Yun-Kai L V, Li P, Jiao M L,etal. Fluorescence quenching study of moxifloxacin interaction with calf thymus DNA[J].Turk J Chem,2014,38:202-209.
Synthesis of Mono-hydroxyl Corrole Manganese(III) Complex and Its Interaction with DNA
YANG Wen-cong, MO Ting-ting, LIN Ze-tan, ZENG Shu-ying, FANG Yu-qi, JIANG Tao, SHI Lei*
(Department of Chemistry, Guangdong University of Education, Guangzhou 510303, China)
Mono-hydroxyl corrole (1) was synthesized by condensation reaction of penta-fluorophenyl dipyrrolidine withp-hydroxybenzaldehyde. 10-(4-Hydroxylphenyl)-5,15-bis(2,3,4,5,6-pentafluorophenyl)corrol manganese was synthesized by reaction of 1 with manganese acetate. The structure was characterized by UV-Vis and HR-MS(ESI). The catalytic activity for the oxidation of DNA was tested by UV-Vis, fluorescence spectroscopic studies, circular dichroism spectra and agarose gel electrophoresis.
penta-fluorophenyl dipyrrolidine; corrole; manganese; DNA; oxidative cleavage; synthesis
2016-08-10;
2017-01-10
广东省自然科学基金资助项目(S2012040006270); 广东省本科高校教学质量与教学改革工程专业综合改革项目; 广东大学生科技创新培育专项资金(攀登计划专项资金); 大学生创新创业训练计划项目
杨文聪(1993-),男,汉族,广东广州人,本科生,主要从事配位化学的研究。 E-mail: 446107160@qq.com
史蕾,博士,讲师, E-mail: shil@gdei.edu.cn
O614.81
A
10.15952/j.cnki.cjsc.1005-1511.2017.03.16204

