原发性肝癌表皮生长因子受体突变的研究
于淼 邱李辉 熊伟 苏慧娟 叶绿
原发性肝癌表皮生长因子受体突变的研究
于淼1邱李辉1熊伟1苏慧娟1叶绿2★
目的对原发性肝癌患者EGFR基因进行检测,分析EGFR基因突变与原发性肝癌及患者年龄组成的关系。方法对2507例确诊原发性肝癌的石蜡包埋组织样本用PCR扩增法和双向测序法检测EGFR基因突变状态。结果2507例患者仅检测出620例(24.74%)EGFR基因20外显子同义突变Q787Q(2361G>A)和263例(10.49%)19内含子点突变(2284⁃60T>C);EGFR基因突变与患者性别、病理类型无关(P>0.05),与患者的年龄段组成明显相关(P<0.05),且基于年龄段的分布,20外显子突变与19内含子突变呈显著正相关(P<0.05)。结论本研究中未发现EGFR基因热点突变。同义突变位点Q787Q尚存在进一步需要被证实的功能。20外显子突变和19内含子突变与患者年龄分布有明显相关性,可为原发性肝癌患者提供更具体的个体化治疗方案。
原发性肝癌;表皮生长因子受体;基因突变
原发性肝癌(primary hepatocarcinoma,PHC)是指源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,包括胆管囊腺癌、肝细胞⁃胆管细胞混合癌及一些少见类型,其中常见类型为肝细胞癌和肝内胆管癌,是我国最常见的恶性肿瘤之一。最新统计结果显示,我国肝癌新增病例占全世界总数的50.5%,死亡病例占全世界总数的51.3%[1]。原发性肝癌是一种多条染色体上多个基因变化的复合基因病,基因改变的累加效应直接促成了肝癌的发生[2]。其中许多关键基因(ras、p53、BRCA2等)的突变、缺失或过表达均与肝癌的发生高度相关[3]。
表皮生长因子受体(epidermal growth factor re⁃cepter,EGFR)是一种受体型酪氨酸激酶,是相对分子质量为170×103的跨膜糖蛋白[4]。研究表明,在多种恶性肿瘤中均检测到EGFR过度表达或突变,如非小型细胞肺癌、头颈部癌、卵巢癌、宫颈癌、食管癌等[5⁃8]。近年来研究表明,肝癌中EGF及EGFR也存在过度表达或突变,这可能与肝癌的形成、侵袭性生长、临床特征有密切关联,并且在低分化的肝癌患者中,EGFR过表达影响到患者预后的恢复[9⁃11]。我国有学者认为EGFR和EGFRvIII高表达可能是肝细胞癌变的重要因素,可以作为评价肝癌转移、复发的参考指标[12⁃14];但是有关EGFR与我国原发性肝癌人群关系的研究国内鲜有报道,且不全面。本研究拟对2 507例原发性肝癌患者EGFR基因的突变情况进行检测,初步分析EGFR基因突变情况与患者临床特征之间的关系,并探讨EGFR基因突变与患者年龄组成的关系,为原发性肝癌的分子靶向治疗提供基础性参考依据和临床指导,希望找到一条原发性肝癌分子靶向治疗的新途径。
1 材料与方法
1.1 研究对象
收集2013年3月至2014年7月来自全国各医院病理科经手术切除的原发性肝癌石蜡包埋组织样本2 507例,显微镜下证实肿瘤细胞完整。其中男性2 153例,女性354例;年龄19~87岁,中位年龄52岁;病理类型:2 307例肝细胞癌,179例肝内胆管癌,21例肝胆混合癌。病理学分类按照WHO标准[1]。所有患者手术前均未接受过放疗化疗及靶向药物治疗。样本均在RNAlater(QIAGEN,德国)的冻存管中4℃保存,并于2个工作日内送达实验室进行检测。
1.2 提取基因组DNA
应用石蜡切片DNA提取试剂盒(FFPE gDNA miniPREP KIT,BIOMIGA,美国)进行DNA提取。用琼脂糖凝胶电泳检测质量,经紫外分光光度法测定浓度与纯度并稀释,要求A260/A280大于1.8且小于2.0,原液浓度为200 ng/μL,置于⁃20℃冰箱中保存。基因组DNA工作液稀释至浓度60 ng/ μL,置于4℃保存。
1.3 聚合酶链反应PCR扩增和基因测序
采用PCR扩增法和测序法分析原发性肝癌患者石蜡包埋组织中EGFR基因突变情况。根据NCBI发布的EGFR全基因组序列(NM⁃005228)和mRNA序列,用Oligo软件在EGFR第18、19、20、21外显子两侧各设计1对PCR引物。序列如下:
第18外显子:上游引物:5′⁃CAGGTGATTCGTG⁃GAGCCC⁃3′,
下游引物:5′⁃TAGGATGTGGAGATGAGCAG⁃3′。第19外显子:上游引物:5′⁃ACTTCACAGCCCT⁃GCGTAAAC⁃3′,
下游引物:5′⁃ATGGGACAGGCACTGATTTGT⁃3′。第20外显子:上游引物:5′⁃CAGCAGCGGGTTA⁃CATCTTC⁃3′,
下游引物:5′⁃GCAGCCTGCTCCCTGGTGTC⁃3′。
第21外显子:上游引物:5′⁃GCTTGGTGCACCGC⁃GACCTG⁃3′,
下游引物:5′⁃CGCACCCAGCAGTTTGGCGA⁃3′。
PCR反应体系组成为:水33 μL,10×PCR buf⁃fer 5 μL,10 mmol/L dNTPs 4 μL,5 U/μL Taq DNA聚合酶0.2 μL,60 ng/μL DNA模板4 μL,反应总体积为50 μL。反应条件均为94℃预变性5 min;94℃变性15 s,58℃退火30 s,72℃延伸30 s,共50个循环;72℃延伸5 min,4℃保温。所有产物经1.5%琼脂糖电泳检测,纯化后的产物从正反双链测序分析EGFR基因突变情况。测序仪器为ABI PRISM3730(USA),测序结果用Chromas软件进行分析。
1.4 统计分析
采用SPSS 21.0和ORIGION 8.0软件进行数据处理和分析,应用列联表卡方检验分析EGFR基因突变与患者性别、年龄和病理类型之间的关系,必要时用Fisher’s精确概率法分析,当P<0.05认为差异显著;根据不同年龄组成与EGFR基因突变率的分布散点图,应用回归分析求出其拟合曲线,并建立回归方程。
2 结果
2.1 EGFR基因突变情况
EGFR基因的突变特点及类型见表1。2 507例患者EGFR基因18、19、21外显子未检测到任何突变或缺失;检测出620例(24.74%)20外显子突变,突变类型为同义突变Q787Q(2361G>A);263例(10.49%)检测到19内含子点突变(2284⁃60T>C);发生19内含子突变的患者同时发生20外显子的突变,即双突变(10.49%)。测序结果见图1。

表1 EGFR基因突变的分布特点及类型Table 1 The type and distribution of EGFR gene mutation

表2 EGFR基因突变与临床特征的关系Table 2 Correlation of EGFR mutation to clinical characteristics of PHC
2.2 EGFR基因突变与患者临床特征之间的关系
EGFR基因突变与患者临床特征之间的关系见表2。由表2可见,在2 507例病例中,男性患者2 153例,EGFR基因突变率为24.66%,女性患者254例,EGFR基因突变率为 25.14%;576例(24.97%)肝细胞癌、42例(23.46%)肝内胆管癌和2例(9.52%)肝胆混合癌发生EGFR基因突变。EGFR基因的突变与性别、病理类型均不具有统计学意义(P>0.05)。
2.3 EGFR基因突变例数与肝细胞癌患者年龄组成的关系
EGFR基因的突变例数与肝细胞癌患者年龄组成之间的关系如图2示。EGFR基因突变例数与肝细胞癌患者年龄段呈抛物线关系,年龄50~59岁的患者突变数量最多,方差检验有显著相关。回归分析显示:回归系数R=0.958,决定系数R2=0.918,校正决定系数R2=0.917,显著性检验P<0.000 1,回归方程:y=-840.413+38.883x-0.363x2(y为20外显子突变率,x为肝细胞癌患者平均年龄)。
2.4 EGFR基因20外显子和19内含子突变率与肝细胞癌患者年龄组成之间的关系

图1 EGFR基因突变的测序结果Figure 1 Sequencing results of mutations in the EGFR gene

图2 EGFR基因突变例数与肝细胞癌患者年龄之间的关系Figure 2 Correlation of number of EGFR mutation to age groups of patients of PHC

图3 EGFR基因的突变情况与肝细胞癌患者年龄组成之间的关系Figure 3 Correlation of EGFR mutation to age groups of patients of PHC
EGFR基因的突变情况与肝细胞癌患者年龄组成之间的关系如图3和表3示。第20外显子突变率与突变患者年龄段呈抛物线关系,年龄50~59岁的突变患者比例最高,方差检验有显著相关。回归分析显示:回归系数R=0.958,决定系数R2=0.918,校正决定系数R2=0.916,显著性检验P<0.000 1,回归方程:y=-135.507+6.27x-0.059x2(y为20外显子突变率,x为突变患者平均年龄);19内含子突变率与突变患者年龄段也呈抛物线关系,年龄50~59岁的突变患者比例同样也最高,方差检验有显著相关。回归分析显示:回归系数R= 0.917,决定系数 R2=0.841,校正决定系数 R2= 0.838,显著性检验 P<0.000 1,回归方程:y=-147.435+6.75x-0.063x2(y为19内含子突变率,x为突变患者平均年龄)。进一步分析显示,基于突变患者年龄段分布,EGFR基因20外显子突变率与19内含子突变率呈显著正相关(P<0.01)。
2.5 EGFR基因突变与患者病理类型的关系
EGFR基因突变与病理类型的关系见表4。由表4可见,在2 307例肝细胞癌病例中,男性为500例(24.95%),女性为76例(25.08%);在179例肝内胆管癌和21例肝胆混合癌病例中,男性分别为32例(23.70%)、2例(9.52%),女性分别为10例(22.73%)、0例发生发生EGFR基因突变。EGFR基因的突变与不同的病理类型均不具有统计学意义(P>0.05)。
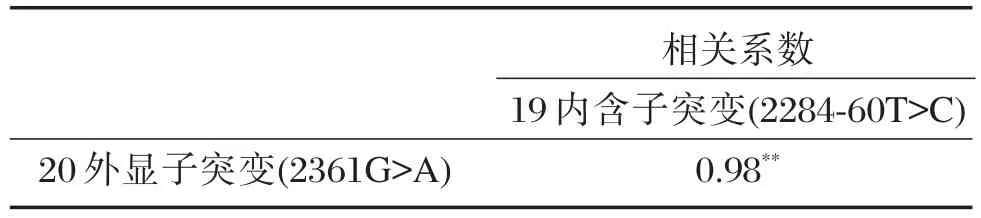
表3 EGFR基因20外显子突变与19内含子突变的相关系数Table 3 Correlation coefficient between mutants of exon 20 and intron 19 of EGFR

表4 EGFR基因突变与病理类型的关系Table 4 Correlation of EGFR mutation to clinical characteristics of PHC
3 讨论
伴随着慢性肝炎、肝硬化、肥胖发生率及饮食习惯不科学等现象的发生日趋常态,近年来原发性肝癌的发病率逐年升高。由于其分子发病机制具有复杂性、异质性、累积性等特点[2],并且不同的致癌机制在PHC中均发生不同程度的改变,这为PHC分子靶向治疗提出了严峻的考验[15]。目前应用在临床上的肝癌分子靶向治疗中较为成熟有效的也仅限于针对VEGFR2等靶标使用的索拉非尼药物,并没有像其他癌症(肺癌、乳腺癌等)那样出现跨越式的进步。关于EGFR基因突变情况在肝癌中的分子作用机制尚不明确,且与原发性肝癌关系的报道也极其有限,更多的研究聚焦在肝癌中EGFR基因的表达水平。可见,进一步探究肝癌发生的分子机制,为肝癌的分子靶向治疗及个体化用药方案制定建立临床基础。
EGFR基因共28个外显子,其中第18~21外显子是编码酪氨酸激酶的区域,EGFR基因发生最常见的突变是第19外显子的缺失和第21外显子的L858R点突变,被认为是激活突变[5]。以往大量的临床研究表明,选用EGFR酪氨酸激酶抑制剂治疗发生该活化突变的患者敏感性增强,生存率显著提高,而未发生突变的患者多数不会从EGFR靶向治疗药物中获益。本研究结果表明,2 507例患者中未出现EGFR基因的热点突变,仅检测到620例(24.74%)第20外显子发生同义突变Q787Q(2361G>A),国外学者在原发性肝癌EGFR基因突变的研究中也得出相似的结果[16⁃17]。
本研究虽未发现EGFR基因上存在热点突变,但我们发现高比例的20外显子同义突变Q787Q(rs1050171)。关于Q787Q位点突变的报道屡见不鲜,大量的临床实验结果表明,56%宫颈腺癌中EGFR基因外显子20存在同义突变(Q787Q)[18],在头颈鳞状细胞癌中Q787Q突变率为56.3%[19]。尽管同义突变并未引起氨基酸的改变,但“沉默突变”仍可能通过改变EGFR基因的拼接、mRNA的稳定性,一定程度地影响蛋白质的最终表达。已有研究显示,EGFR基因2073位点的同义突变导致了EGFR基因转录的mRNA缩短,致使EGFR三维结构发生改变[20];Q508Q同义突变引起TGFBR2基因异常拼接,导致蛋白编码提前终止[21]。Tagauchi等[19]研究结果表明,含有Q787Q突变型头颈部癌细胞系较野生型癌细胞系对吉非替尼更为敏感(P<0.05),预示该位点可能是头颈部鳞状细胞癌分子靶向治疗的一个潜在靶点。在非小细胞肺癌的研究发现,针对Q787Q突变的患者进行吉非替尼治疗后,13%的患者病情获得明显缓解[22]。由此可见,同义突变位点Q787Q尚存在进一步需要被证实的功能,这种功能可能会丰富原发性肝癌的靶向治疗及发生机制的研究。
值得一提的是,我们通过回归分析发现,EGFR基因突变率与肝细胞癌患者的年龄段组成明显相关(P<0.05)。50~59岁年龄段的患者EGFR基因20外显子和19内含子突变率均最高。肝内胆管癌和肝胆混合癌病例因数量少,无法按照年龄段组成进行统计学分析。鉴于此,依据EGFR基因突变规律为原发性肝癌患者提供更具体的个体化治疗方案。进一步分析发现,携带2284⁃60T>C突变的患者100%发生2361G>A突变,而携带 2361G>A突变的患者中仅有约 50%发生2284⁃60T>C突变。2284⁃60T>C与2361G>A的关联及原发性肝癌EGFR基因发生双突变后相关的生物学事件,将是我们今后深入研究的新方向。
[1]Bosman FT,Carneiro F,Hruban RH,et al.WHO classification of tumours of the digestive system[M]. International Agency for Research on Cancer,2010.
[2]Moeini A,Cornellà H,Villanueva A.Emerging sig⁃naling pathways in hepatocellular carcinoma[J].Liver Cancer,2012,1(2):83⁃93.
[3]Huang J,Zheng DL,Qin FS,et al.Genetic and epi⁃genetic silencing of SCARA5 may contribute to human hepatocellular carcinoma by activating FAK signaling[J].Journal of Clinical Investigation,2010,120(1):223⁃241.
[4]Oliveira⁃Cunha M,Newman WG,Siriwardena AK. Epidermal growth factor receptor in pancreatic cancer[J].Cancers,2011,3(2):1513⁃1526.
[5]Rothschild SI.Targeted therapies in non⁃small cell lung cancer⁃beyond EGFR and ALK[J].Cancers,2015,7(2):930⁃949.
[6]Tepper SR,Zuo Z,Khattri A,et al.Growth factor ex⁃pression mediates resistance to EGFR inhibitors in head and neck squamous cell carcinomas[J].Oral On⁃cology,2016,56:62⁃70.
[7]Alanazi IO,Khan Z.Understanding EGFR signaling in breast cancer and breast cancer stem cells:overex⁃pression and therapeutic implications[J].Asian Pacif⁃ic Journal of Cancer Prevention Apjcp,2016,17(2):445⁃453.
[8]Schrevel M,Gorter A,Kolkman⁃Uljee SM,et al.Mo⁃lecular mechanisms of epidermal growth factor recep⁃tor overexpression in patients with cervical cancer[J]. Mod Pathol,2011,24(5):720⁃728.
[9]Panvichian R,Tantiwetrueangdet A,Sornmayura P,et al.Missense mutations in exons 18⁃24 of EGFR in hepatocellular carcinoma tissues[J].Biomed Research International,2015,2015:171845.
[10]Komposch K,Sibilia M.EGFR signaling in liver dis⁃eases[J].International Journal of Molecular Scienc⁃es,2015,17(1).
[11]Daveau M,Scotte M,François A,et al.Hepatocyte growth factor,transforming growth factor alpha,and their receptors as combined markers of prognosis in he⁃patocellular carcinoma[J].Mol Carcinog,2003,36(3):130⁃141.
[12]徐立,张昌卿,冯凯涛,等.肝细胞癌及癌旁肝组织EGFR和EGFR vⅢ的表达及其临床意义[J].中山大学学报:医学科学版,2006,27(4):467⁃471.
[13]欧超,吴飞翔,罗元,等.表皮生长因子受体Ⅲ型突变体在肝细胞癌中的表达及意义[J].癌症,2005,24(2):166⁃169.
[14]王嘉毅.原发性肝癌组织EGFR和MMP9表达与术后复发或转移的关系[J].郑州大学学报:医学版,2005,40(5):885⁃886.
[15]Chang MH.Prevention of hepatitis B virus infection and liver cancer[J].RecentResultsin Cancer Re⁃search.2014,193:75⁃95.
[16]Lee SC,Lim SG,Soo R,et al.Lack of somatic muta⁃tions in EGFR tyrosine kinase domain in hepatocellular and nasopharyngeal carcinoma[J].Pharmacogenetics &Genomics,2006,16(1):73⁃74.
[17]Lee JW,Soung YH,Kim SY,et al.Absence of EGFR mutation in the kinase domain in common hu⁃man cancers besides non⁃small cell lung cancer[J]. International Journal of Cancer,2005,113(3):510⁃511.
[18]Longatto⁃ilho A,Pinheiro C,Martinho O,et al.Mo⁃lecular characterization of EGFR,PDGFRA and VEG⁃FR2 in cervical adenosquamous carcinoma[J].BMC Cancer,2009,9(1):212.
[19]Taguchi T,Tsukuda M,Imagawa⁃Ishiguro Y,et al. Involvement of EGFR in the response of squamous cell carcinoma of the head and neck cell lines to gefitinib[J].Oncology Reports,2008,19(1):65⁃71.
[20]Shintani S,Matsuo K,Crohin CC,et al.Intragenic mutation analysis of the human epidermal growth fac⁃tor receptor(EGFR)gene in malignant human oral keratinocytes[J].Cancer Research,1999,59(16):4142⁃4147.
[21]Mizuguchi T,Collod⁃Beroud G,Akiyama T,et al. Heterozygous TGFBR2 mutations in Marfan syndrome[J].Nature Genetics,2004,36(8):855⁃860.
[22]Young⁃Chul K,Kyu⁃Sik K,In⁃Jae O,et al.Abstract B43:SNP Q787Q of EGFR gene and efficacy of EG⁃FR⁃TKI in patients with non⁃small cell lung cancer[J]. Clinical Cancer Research,2012,18.
Analysis of EGFR mutation status in primary hepatocarcinoma patients
YU Miao1,QIU Lihui1,XIONG Wei1,SU Huijuan1,YE Lv2★
(1.Shanghai DaAn Center for Medical Laboratory,Shanghai,China,200120;2.GuangZhou DaAn Clinical Lab⁃oratory Center Pathology Department,Guangzhou,Guangdong,China,510080)
ObjectiveTo detect the EGFR mutations(exon18,19,20,21)in primary hepatocarcino⁃ma(PHC)tissue,and to study the correlation between the EGFR mutations and the ages and clinical features of the patients with the aim of supporting the development of new molecular targeting therapy for PHC patients.MethodsParaffin embedded tissues from 2 507 cases were collected,and EGFR mutations were detected us⁃ing PCR and bidirectional sequencing.ResultsOut of the 2 507 cases of PHC,there were 620 PHC pa⁃tients carrying a silent mutation,which showed a G⁃to⁃A transition at nucleotide 2361 in exon 20 of the gene. Furthermore,263 PHC patients(10.49%)were found to be carrying the mutation 2284⁃60T>C in intron 19 The EGFR mutations 2361G>C and 2284⁃60 were not related to sex or pathology(P>0.05),but were related to the age of the PHC patients(P<0.05).In addition,a significant positive correlation was found between the mutation rate of exon 20 and intron 19(P<0.05)based on the ages of the PHC patients.ConclusionThere were no hot mutations found in the EGFR gene.The features of the EGFR 2361G>C mutation need to be analyzed fur⁃ther.Investigation into the characteristics of exon 20 and intron 19 may provide avenues for more individualized therapy in PHC.
Primary hepatocarcinoma(PHC);Epidermal growth factor recepter(EGFR);Gene muta⁃tion
1.上海达安医学检验所有限公司,上海200120 2.广州达安临床检验中心病理事业部,广东,广州510080
★通讯作者:叶绿,E⁃mail:yelv@yunkanghealth.com

