荧光原位杂交技术检测肺癌ROS1易位病例临床病理特点
陈敏 刘晓羽 吕丽霞 杨洁亮 王威亚
荧光原位杂交技术检测肺癌ROS1易位病例临床病理特点
陈敏 刘晓羽 吕丽霞 杨洁亮 王威亚★
目的总结ROS1(c⁃ros oncogene1)易位病例分子病理特点及治疗情况;探讨荧光原位杂交(fluorescence in situ hybridization,FISH)技术在肺癌ROS1基因检测中的价值。方法采用荧光原位杂交方法检测613例肺癌患者ROS1基因。ROS1易位样本行手工ROS1免疫组化(IHC)、ALK Ventana全自动免疫组化及EGFR突变检测。结果采用ROS1 FISH法检出19例阳性病例,检出率为3.1%(19/613)。阳性细胞平均比例为60%,范围35%~78%。阳性病例显示两种信号模式,其中63.2%(12/19)为经典红绿分离,36.8%(7/19)为单独绿色。19例阳性病例ROS1蛋白表达为:1例(5%)0+,2例(11%)1+,7例(37%)2+,9例(47%)3+。阳性病例均无ALK基因易位,除1例同时具EGFR 19外显子突变外,其余病例均为EGFR野生型。ROS1易位患者年龄略小;女性、非吸烟患者比例较高;大多为晚期病人。组织学类型以实体、腺泡及乳头型腺癌为主。易位病例中,3例患者死亡,7例患者接受克唑替尼治疗。结论ROS1易位更易发生在年轻、女性、不吸烟的腺癌患者中。FISH方法可有效地检测肺癌ROS1基因易位,对确诊ROS1阳性肺癌具有重要意义。
非小细胞肺癌(NSCLC);ROS1易位;荧光原位杂交(FISH)
肺癌是目前发病率和死亡率居首位的恶性肿瘤,是癌症死亡的主要原因之一,其中非小细胞肺癌(non⁃smallcell lung cancer,NSCLC)约占全部肺癌的85%,在NSCLC中,主要的类型为腺癌(ade⁃nocarcinoma,AC)、鳞状细胞癌(squamouscell carci⁃noma,SqCC)。晚期NSCLC患者的预后极差,5年生存率<15%[1]。近年来肺癌分子驱动基因的检测越来越受到关注,尤其是表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶结构域突变、间变性淋巴瘤激酶(anaplastic lym⁃phoma kinase,ALK)易位以及KRAS突变等基因的检测。而ROS1基因易位是新近发现的NSCLC另一驱动基因[2],ROS1易位是NSCLC中独立的分子亚型,在NSCLC中的发生率约为1%~2%[3],在EGFR与ALK双阴性肺腺癌患者中的阳性比例更高[4]。前期临床研究显示,ALK酪氨酸激酶抑制剂克唑替尼(Crizotinib)对ROS1易位的NSCLC有较好的活性[5]。检测ROS1基因易位的方法有免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)、逆转录聚合酶链反应(reverse transcriptase poly⁃merase chain reaction,RT⁃PCR)和二代测序技术(next generation sequencing,NGS)。
目前国内对ROS1研究的报道中,综述较多,大宗的临床病例及靶向治疗方面的报道较少。因此,本研究采用FISH技术检测613例肺癌ROS1基因易位,总结易位阳性病例临床病理特点并探讨FISH技术在ROS1基因易位检测中的价值。
1 材料与方法
1.1 病例收集
2014年1月至2016年1月间四川大学华西医院病理科完成ROS1基因FISH检测的613例石蜡组织标本。记录所有患者的临床资料包括:性别、年龄、吸烟史、临床分期、治疗及随访情况。组织病理分型和临床分期参考2015版世界卫生组织的肺癌组织学分类[6]。
1.2 实验方法
1.2.1 IHC检测及评分标准
所有标本均为10%中性缓冲福尔马林溶液固定,石蜡包埋,切片厚度4 μm。ROS1 IHC采用手工方法。ROS1抗体(D4D6)购自Cell Signaling Technology(Danvers,MA,美国),并按1∶100稀释。用pH=9.0的EDTA抗原修复液,修复条件为97℃,40 min。一抗孵育过夜,于一抗之后使用增强剂(Dako,美国),室温孵育10 min,并用增强显色试剂盒检测。ALK IHC采用VentanaBench⁃Mark XT全自动染色。
ROS1 IHC结果判读标准:0+(阴性):肿瘤细胞无明确着色;1+:>5%肿瘤细胞呈现微弱或模糊的胞浆着色;2+:>5%肿瘤细胞中等强度胞浆着色;3+:>5%肿瘤细胞胞浆强阳性着色[6]。ALK IHC结果判读采用试剂盒推荐的二元化标准,即:在空白对照及阳性对照均正常的情况下,检测样本评价为阳性或者阴性。
1.2.2 FISH检测及判读标准
采用ROS1双色分离探针(Vysis LSI ROS1 Du⁃al Color,Break Apart Rearrangement Probe,Abbott Molecular),将613例肺癌患者病理组织样本石蜡切片按照常规FISH实验步骤进行处理。杂交过程严格按照ROS1探针试剂盒说明书操作。
FISH结果判定:在荧光显微镜下观察结果,正常ROS1基因呈现红绿重合的黄色信号,当红绿信号分开且两信号之间距离大于2个信号点大小或出现单独的绿色信号时判定为该细胞ROS1易位基因阳性[8]。选择染色明亮、细胞核完整且杂交信号强的肿瘤细胞进行计数,至少计数50个肿瘤细胞,阈值设定为15%。
1.2.3 EGFR突变PCR检测
采用DNeasy试剂盒(Qiagen,德国)提取石蜡包埋组织中DNA。EGFR突变采用ARMS法检测29位点突变(AmoyDx,艾德,中国厦门)。
1.3 统计学分析
研究数据采用SPSS 19.0进行分析处理。组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ROS1易位患者临床病理特征
613例肺癌患者平均发病年龄为58.47岁,中位年龄59岁(20~94岁)。男:女=1.30∶1。613例肺癌患者中共检出19例ROS1基因易位,阳性率为3.1%,均为肺腺癌。阳性患者年龄略轻(平均56.1岁),与阴性组差异无统计学意义(P>0.05)。阳性患者中男性8例,女性11例,男∶女=0.73∶1,女性患者更多见(P>0.05)。19例中6人有吸烟史,13例无吸烟史(P>0.05)。阳性病例临床分期多为晚期,其中Ⅲ期8例、Ⅳ期9例,组织学亚型以实体与腺泡型为主(图1)。其分化程度为:低分化13例(68%)、低~中分化5例(26%)、中分化1例(5%),无高分化病例。ROS1易位患者临床病理特征见表1。
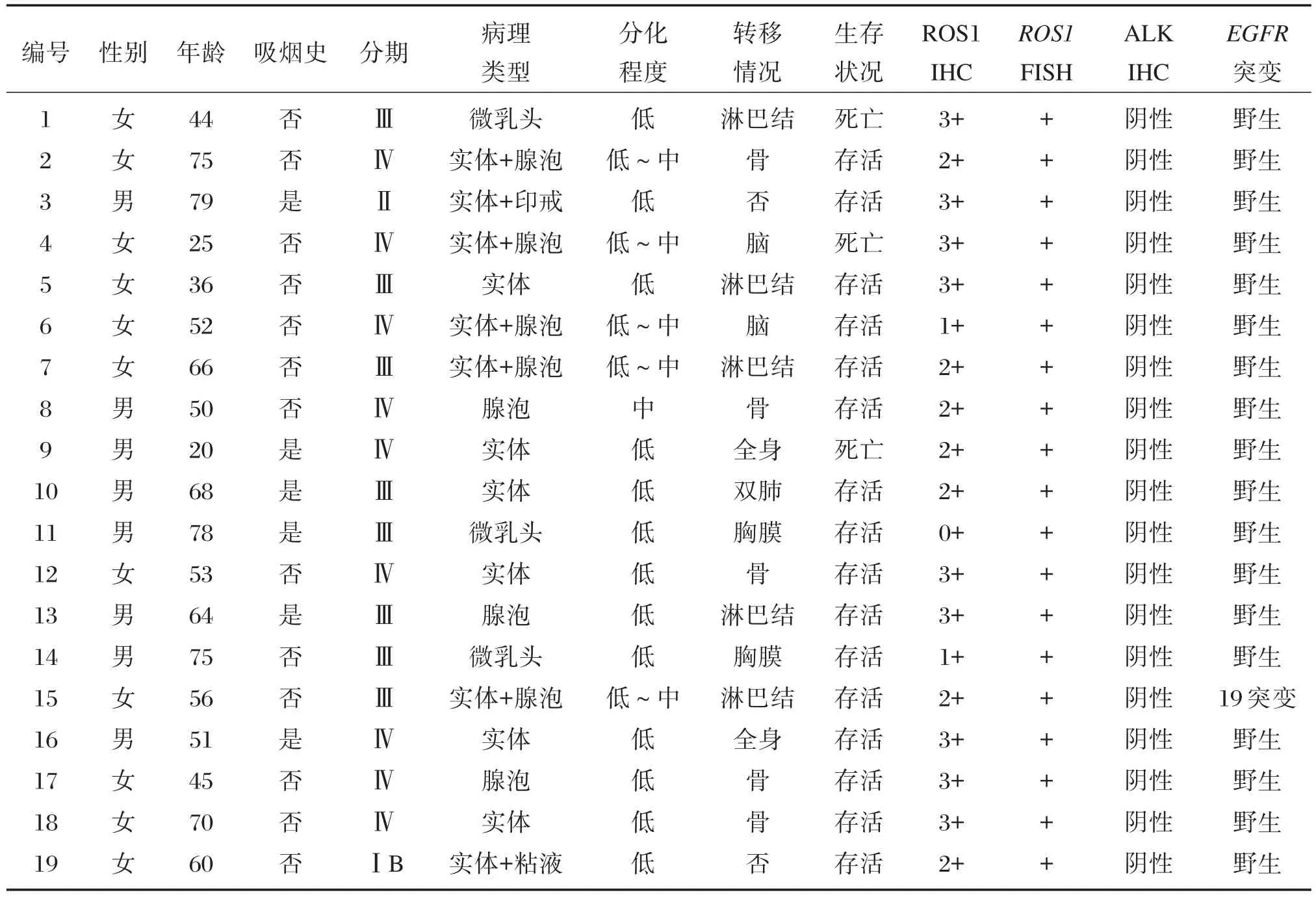
表1 ROS1阳性患者临床病理特征(n=19)Table 1 The major clinicopathological features for ROS1 positive cases(n=19)
2.2 ROS1易位患者IHC及分子检测结果
19例阳性病例ROS1蛋白表达为:1例(5%)0+,2例(11%)1+,7例(37%)2+,9例(47%)3+。ROS1易位病例阳性细胞平均比例为60%,范围为35%~78%。其中12例(63.16%)为经典红绿分离,7例(36.84%)为单独绿色(图2)。ROS1易位病例ALK Ventana染色均为阴性,1例同时具EGFR 19外显子突变,余18例均为EGFR野生型。
2.3 治疗情况
19例易位病例全部获得随访,截止到2016年6月,有3例病人死亡。1例为44岁女性患者(生存时间17个月),形态为微乳头状;1例为25岁女性患者(生存时间1个月),形态为实体和腺泡结构为主;另1例为20岁男性患者(生存时间3个月),形态为实体性。此3位病人平均生存时间为7个月。有7例患者行克唑替尼靶向治疗,一日两次,每次口服剂量250 mg。治疗时间为1~14个月,平均治疗时间为8.3个月。7例患者均无疾病进展。1例生物治疗;1例未行治疗。其中部分病人同时行放化疗。

图1 ROS1阳性病例形态学特点Figrue 1 Histologic features of ROS1 positive cases

图2 荧光原位杂交检测ROS1易位信号模式(×1 000倍)Figure 2 The ROS1 translocation signals by FISH(×1 000)
3 讨论
肺癌因其高发病率及死亡率成为研究的热点,其分子靶向治疗也引起极大的关注。ROS1易位NSCLC为NSCLC中一个独特的分子亚型。ROS1基因定位于6号染色体,属于受体酪氨酸激酶家族,迄今已发现至少9种ROS1易位基因。本研究采用FISH法检测613例肺癌患者ROS1基因,共检出19例阳性病例,阳性率3.1%,比文献报道NSCLC中ROS1易位整体1%~2%的阳性率略高[8],可能与本研究的部分病例为EGFR和ALK基因双阴性有关,从而间接提高了ROS1的检出率。本研究与武莎菲等[9]报道的EGRF/KRAS/ALK三阴肺癌患者中ROS1易位3.7%的阳性率接近。ROS1易位阳性患者与阴性患者相比,年龄较小、女性非吸烟患者稍多、分化程度低、临床分期高,与文献报道相符[10⁃11]。组织学类型集中在实体、腺泡和乳头状亚型,并伴有印戒细胞、粘液、筛状、贴壁等成分。同一病例各不同组织学亚型之间ROS1基因结果无差异,ROS1基因表达无异质性。国内程弘夏[12]与刘尽国[13]分别报道了53例和16例ROS1易位病例,均发现ROS1易位在青年、非吸烟患者中较为多见。
研究认为NSCLC中驱动基因改变是相互排斥的。本研究检测到1例无吸烟史的女性患者存在ROS1易位与EGFR 19外显子突变。此病例ROS1 IHC 1+,ROS1 FISH检测为经典红绿分离信号。组织学类型以实体和腺泡为主,未行克唑替尼靶向治疗,截止随访,仍存活。目前有一些文献陆续报道ROS1易位与EGFR突变共存的现象。Rimkunas等[1]报道9例ROS1重排患者中,有2例患者同时存在EGFR不同位点突变。刘尽国等[13]通过PCR方法从369例肺腺癌组织中检测到3例ROS1易位与EGFR突变共存病例。说明ROS1易位可与EGFR突变共存,但ROS1易位本身阳性率低,ROS1易位与EGFR突变共存的病例更少。目前关于这类双阳性病例的临床病理及治疗情况有限,有待进一步研究。
ROS1与ALK受体酪氨酸激酶(receptor tyro⁃sine kinase,RTK)结构域有49%的氨基酸同源序列。多种ALK抑制剂在体外均可抑制ROS1的活性。ALK抑制剂克唑替尼通过抑制ROS1的磷酸化从而抑制ROS1的激酶活性。在本组ROS1阳性病例中,采用IHC检测ALK蛋白的表达,19例病例全部为阴性,未检测到ROS1与ALK双阳病例。ALK基因易位发生率在3%~7%。在我国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识中[14],ALK⁃Ventana、ALK⁃FISH和ALK⁃PCR 3种检测ALK易位的方法都得到了认可。全自动ALK免疫组织化学(Ventana IHC)与Vysis ALK双色分离探针检测间的符合率在97%,Ven⁃tana IHC的特异性能达到100%,敏感性也在95%以上[15]。
本研究中7例ROS1易位患者行克唑替尼靶向治疗,治疗时间为1~14个月,平均治疗时间为8.3个月,均无疾病进展。2014年新英格兰杂志报道50例ROS1阳性NSCLC患者行克唑替尼靶向治疗,其疗效优于ALK易位患者[16]。因此如何准确有效地筛选出ROS1易位肺腺癌患者,让更多的患者从靶向治疗中获益就显得尤为重要。
检测ROS1基因易位有多种方法[17],包括FISH、PCR、IHC和二代测序技术。PCR技术对样本RNA质量要求较高,且不能检测未知的断裂点。有研究认为IHC快速、简便且价格低廉,可用于初步筛查ROS1基因易位[18]。但在ROS1易位基因的IHC检测中,暂无统一的实验流程及判读标准,也未实行自动化操作。本研究中,1例ROS1易位FISH阳性病例其ROS1 IHC结果为阴性。此病例为胸水细胞块,可能与肿瘤细胞在保存、运输过程中样本质量或抗原丢失有关,提示IHC染色可能会出现少数病例漏诊的现象。近年NGS研究较多,而临床应用较少。本研究中FISH检测在各种类型的石蜡包埋组织样本中均取得成功,易位信号明确,易于判读。
本研究通过FISH技术检测613例肺癌石蜡包埋组织中ROS1基因易位,检出19例阳性病例,阳性率为3.1%。ROS1易位作为NSCLC中独立的分子亚型,其更易发生在年轻、女性、不吸烟的腺癌患者中。组织学类型以实体和腺泡状成分为主。ROS1易位可与EGFR突变共存,本研究未检测到ROS1易位与ALK易位共存病例。FISH方法可有效的检测肺癌ROS1基因易位。与IHC相比,FISH检测ROS1基因易位特异性更高,从而为患者靶向治疗提供可靠的依据。
[1]Rikova K,Guo A,Zeng Q,et al.Global survey of phosphotyrosine signaling identifis oncogenic kinases in lung cancer[J].Cell,2007,131(6):1190⁃1203.
[2]Bergethon K,Shaw AT,Ou SH,et al.ROS1 rear⁃rangements define a unique molecular class of lung cancers[J].J ClinOncol,2012,30(8):863⁃870.
[3]Gainor JF,Shaw AT.Novel targets in non⁃small cell lung cancer:ROS1 and RET fusions[J].Oncologist,2013,18(5):865⁃875.
[4]Davies KD,Doebele RC.Molecular pathways:ROS1 fusion proteins in cancer[J].Clin Cancer Res,2013,19:4040⁃4045.
[5]Xu LT,Zhao RJ,Zhu TN,et al.Clinical signifiance of ROS1 rearrangements in non⁃small cell lung cancer[J].Zhongguo FeiAi Za Zhi,2013,16(12):663⁃670.
[6]Travis WD,Brambilla E,Burke,et al.WHO classifi⁃cation of tumours of the lung,pleura,thymus and heart[M].lyon:iarcpress,2015:183⁃299.
[7]Mescam⁃Mancini L,Lantuéjoul S,Moro⁃Sibilot D,et al.On the relevance of a testing algorithm for the detec⁃tion of ROS1⁃rearranged lung adenocarcinomas[J]. Lung Cancer,2014,83(2):168⁃173.
[8]Pan Y,Zhang Y,Li Y,et al.ALK,ROS1 and RET fusions in 1139 lung adenocarcinomas:a comprehen⁃sive study of common and fusion pattern⁃specific clini⁃copathologic,histologic and cytologic features[J]. Lung Cancer,2014,84(2):121⁃126.
[9]Wu SF,Wang JJ,Zeng X,et al.Clinicopathological characteristics and outcomes of ROS1⁃rearranged pa⁃tients with lung adenocarcinoma with out EGFR,KRAS mutations and ALK rearrangements[J].Tho⁃racic Cancer,2015,6(4):413⁃420.
[10]Go H,Kim DW,Kim D,et al.Clinicopathologic analysis of ROS1⁃rearranged non⁃small⁃cell lung can⁃cer and proposal of a diagnostic algorithm[J].J Tho⁃rac Oncol,2013,8(11):1445⁃1450.
[11]Warth A,Muley T,Dienemann H,et al.ROS1 ex⁃pression and translocations in non⁃small⁃cell lung can⁃cer:clinicopathological analysis of 1478 cases[J]. Histopathology,2014,65(2):187⁃194.
[12]程弘夏,叶伦,薛力泉.荧光原位杂交法检测非小细胞肺癌患者ROS1基因易位及其与临床病理特征的关系[J].中华肿瘤杂志,2014,36(10):751⁃754.
[13]刘尽国,赵瑞英,滕昊骅,等.肺腺癌ROS1融合基因的检测及临床病理特征[J].中华病理学杂志,2015,44(6):390⁃394.
[14]张绪超,陆舜,张力,等.中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版)[J].中华病理学杂志,2013,42(6):402⁃406.
[15]Ying J,Guo L,Qiu T,et al.Diagnostic value of an novel fully automated immunochemistry assay for de⁃tection of ALK rearrangement in primary lung adeno⁃carcinoma[J].Ann Oncol,2013,24(10):2589⁃2593.
[16]Shaw AT,Ou SH,Bang YJ,et al.Crizotinib in ROS1⁃rearranged non⁃small⁃cell lung cancer[J].N Engl J Med,2014,371(21):1963⁃1971.
[17]Shan L,Lian F,Guo L,et al.Detection of ROS1 gene rearrangement in lung adenocarcinoma:compari⁃son of IHC,FISH and real⁃time RT⁃PCR[J].Plos One,2015,10(5):1⁃8.
[18]Go H,Kim DW,Kim D,et al.Clinicopathologic analysis of ROS1⁃rearranged non⁃small⁃cell lung can⁃cer and proposal of a diagnostic algorithm[J].J Tho⁃rac Oncol,2013,8(11):1445⁃1450.
Detection of ROS1 gene rearrangement by FISH in lung cancer and analysis of its clinicopathological features
CHEN Min,LIU Xiaoyu,LV Lixia,YANG Jieliang,WANG Weiya★
(Department of Pathology,West China Hospital of Sichuan University,Chengdu,Sichuan,China,610041)
ObjectiveTo analyze the molecular,pathological,and therapeutic features of ROS1⁃translocation positive lung cancer cases,and to investigate the value of fluorescence in situ hybridization(FISH) in screening for and confirming the ROS1 translocation.MethodsIn this study,ROS1⁃translocation detection was performed in 613 cases with FISH.For ROS1⁃FISH positive samples,manual ROS1 immunohistochemistry (IHC),ALK IHC using a Ventana auto⁃stainer and EGFR mutation status were analyzed.Results19 ROS1⁃translocation positive cases were detected by FISH and with a positive incidence of 3.1%.The average percentage of positive tumor cells was 60%,ranging from 35%to 78%.Among these positive cases,63.2%(12/ 19)cases displayed classical break apart signals,whereas 36.8%(7/19)showed isolated green signals.In the ROS1⁃translocation group,the expression of ROS1 protein are as follows:1 case was not stained 0+(5%);2 cases had weak expression 1+(11%);7 cases had moderate expression 2+(37%)and 9 cases had strong expression 3+(47%).With the exception of one patient with an EGFR deletion mutation in exon19,ROS1⁃translocation positive adenocarcinomas in all patients revealed no alterations in ALK or EGFR genes.The ROS1⁃translocationpositive patients were slightly younger than the negative patients,and were predominantly female, non⁃smokers.Most of the ROS1⁃translocation tumors showed solid,acinar and papillary patterns with a moreadvanced clinical stage.Furthermore,the positive cases all survived except 3 patients,and 7 patients were treated with crizotinib.ConclusionROS1 rearrangement tends to occur in younger,female,non⁃smoking lung adenocarcinoma patients.To make a definite positive diagnosis of ROS1⁃translocationin lung cancer,FISH is a relevant detection method.
Non⁃small cell lung cancer(NSCLC);ROS1 translocation;Fluorescence in situ hybridization(FISH)
国家自然科学基金(81302027)
四川大学华西医院病理科,四川,成都 610041
★通讯作者:王威亚,E⁃mail:151422303@qq.com

