糖尿病小鼠心肌组织中线粒体转录因子A的表达
周益盛,荆 哲,刘峰舟,高玉婷*
(1兰州军区兰州总医院安宁分院心肾内科,兰州 730070;2兰州军区兰州总医院心血管内科;3第四军医大学西京医院心血管内科;*通讯作者,E-mail:937027447@qq.com)
糖尿病小鼠心肌组织中线粒体转录因子A的表达
周益盛1,荆 哲2,刘峰舟3,高玉婷2*
(1兰州军区兰州总医院安宁分院心肾内科,兰州 730070;2兰州军区兰州总医院心血管内科;3第四军医大学西京医院心血管内科;*通讯作者,E-mail:937027447@qq.com)
目的 观察db/db糖尿病小鼠与正常小鼠心肌组织中线粒体转录因子A(TFAM)的表达水平。 方法 9只雄性db/db糖尿病小鼠,随机分为6周组(db/db 6 week),12周组(db/db 12 week),18周组(db/db 18 week);正常雄性小鼠9只,随机分为6周组(wt 6 week),12周组(wt 12 week),18周组(wt 18 week),每组3只。分别用实时定量PCR、Western blot法检测心肌组织中TFAM的表达。利用实时定量PCR检测心肌组织中线粒体拷贝数。 结果 db/db糖尿病小鼠TFAM的表达及线粒体拷贝数低于正常组,且随年龄的增长表达逐渐降低,同时研究还发现,db/db小鼠心肌组织中心肌组织ATP的生成明显低于正常组水平,且随着周龄的增长,ATP的生成逐渐降低。 结论 糖尿病小鼠心肌组织中TFAM表达进行性降低。
2型糖尿病; 心肌; 线粒体转录因子A; 线粒体; 小鼠
糖尿病是一种常见的由内分泌系统代谢障碍引起的慢性终身疾病[1],表现为高血糖、高血脂等代谢紊乱[2],长期糖尿病可导致心血管系统、神经系统及泌尿系统等多种系统的慢性损害[3]。近年来流行病学调查显示,糖尿病患者中70%以上死于心血管相关性疾病,明显高于非糖尿病患者心血管系统疾病。而其中糖尿病心肌病(DCM)是糖尿病患者主要心脏并发症之一[4]。糖尿病心肌病是指在糖尿病患者机体基础代谢平衡紊乱的基础上引发的心脏微血管病变和心肌代谢紊乱,最终导致心肌广泛坏死[5]。糖尿病心肌病发病初期主要以心肌顺应性下降和舒张功能不全为主要表现,若患者长期血糖控制不佳或治疗不当,发展至晚期则以收缩功能不全为主要表现,严重时甚至可发展为充血性心力衰竭[6]。
线粒体在维持和发挥细胞生物学功能中发挥着重要作用,是细胞生命进程中的重要细胞器[7]。近期研究表明,细胞线粒体功能的紊乱与糖尿病心肌病的发病及进展密切相关[8]。而其中维持一定数量正常功能的线粒体,对细胞生物学功能的发挥至关重要[9]。线粒体转录因子A(mitochondrial transcription factor A,TFAM)是在哺乳动物调控线粒体复制和转录过程的重要调控因子[10],有研究显示,线粒体DNA转录激活过程、基因组复制及调节线粒体mtDNA拷贝数,TFAM都在其中发挥重要的调控作用[11]。TFAM基因位于10号染色体长臂21区上,长度为10-25 kb,有6个内含子,所编码的蛋白相对分子质量为25000,包含2个短串联的高迁移率族蛋白盒域,其间以27个氨基酸连接,其后是1个相对富含酸性氨基酸C末端[12]。已有研究证实,在心血管相关疾病中TFAM发挥着一定的调控作用[13,14]。本研究通过db/db糖尿病心肌病模型,探讨不同周龄糖尿病心肌组织中TFAM的表达变化,期望进一步阐述糖尿病心肌病中心肌线粒体DNA转录激活和基因组复制、线粒体mtDNA拷贝数的变化在糖尿病心肌病发生及发展中的作用及其机制。
1 材料和方法
1.1 动物实验与分组
正常组(wt)小鼠为c57小鼠,db/db糖尿病小鼠为近交系小鼠(C57BL/Ks),c57及db/db糖尿病小鼠为清洁普通级动物,购买周龄均为3-4周,均购自常州卡文斯实验动物有限公司(动物许可证号:SCXK苏2011-0003)。根据实验设计,采用随机数字表法,将9只正常雄性小鼠分为3组,每组3只,分别饲养至6周(wt-6w),12周(wt-12w),18周(wt-18w)。另将9只雄性db/db糖尿病小鼠随机分为3组,每组3只,分别饲养至6周(db-6w),12周(db-12w),18周(db-18w)。饲养到对应周龄后处死,取小鼠心脏左心室组织。
1.2 Western blot检测TFAM蛋白表达水平
采用聚丙烯凝胶电泳(10%分离胶,5%浓缩胶),80 V进行上层胶电泳,120 V进行下层胶电泳2 h后,采用湿转法将蛋白转移到PVDF膜上(100 V恒压,1 h)。5%脱脂奶粉摇床室温封闭1 h,TFAM抗体(购自英国abcam公司)稀释比例为1 ∶1 000,β-actin抗体(购自武汉三赢公司)稀释比例为1 ∶3 000,4 ℃封闭过夜,兔二抗IgG抗体室温孵育2 h,化学发光试剂盒进行检测。
1.3 实时定量PCR检测TFAM mRNA表达水平
采用实时定量PCR方法对不同处理组中心肌组织TFAM的mRNA表达水平进行检测。Trizol(购自美国Invitrogen公司)法提取心肌组织的总RNA后反转录为cDNA。采用实时定量PCR法检测,严格按照PCR检测试剂盒的说明书操作(购自TaKaRa公司)。扩增TFAM基因的引物序列上游为:5′-GAAACGCCTAAAGAAGAAAGCA-3′,下游为5′-AAGTCCATGGGCTACAGAAAAA-3′;扩增内参GAPDH基因的引物序列上游为:5′-GGCACAGTCAAGGCTGAGAATG-3′,下游为5′- ATGGTGGTGAAGACGCCAGTA-3′。
1.4 实时定量PCR检测心肌组织线粒体mtDNA表达水平
方法及材料同1.3。心肌组织线粒体mtDNA基因的引物序列上游为:5′- CTGATACTAGTGGCATTCTCCGAGTTGCTGCTAAA-3′,下游为5′- TACCGGAATTCTTGTGAGGGACGGTAAAAGG-3′;扩增内参GAPDH基因的引物序列上游为:5′-GGCACAGTCAAGGCTGAGAATG-3′,下游为5′-ATGGTGGTGAAGACGCCAGTA-3′。
1.5 心肌组织ATP生成的检测
采用ATP荧光检测法(购自美国Invitrogen公司)。试剂准备:配制1 ml 1×Reaction Buffer:50 μl 20× Reaction Buffer+950 μl去离子水。配制1 ml 10 mmol/L D-luciferin储存液:将上述步骤1中的1 ml Reaction Buffer加入到一整管D-luciferin(Component A, blue cap)中;-20 ℃避光。配制100 mmol/L DTT储存液:加1.62 ml水至25 mg的DTT管(Component C,black cap)-20 ℃保存,若拿出溶解,请放置4 ℃,勿再次冻融;稀释ATP做标曲。工作液制备:8.9 ml 去离子水;0.5 ml 20×Reaction Buffer (Component E);0.1 ml 0.1 mol/L DTT;0.5 ml 10 mmol/L D-luciferin;2.5 μl firefly luciferase 5 mg/ml stock solution(Component B, red cap);90 μl工作液+10 μl(ATP、裂解后样本)。
1.6 统计学分析
采用SPSS19.0统计软件进行处理,组间比较采用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 心肌组织TFAM mRNA表达进行性降低
分别饲养db/db及正常组小鼠至6,12,18周,将此3个饲养时间点的不同分组的小鼠处死后,采用实时定量PCR检测小鼠心肌TFAM mRNA表达。结果显示,db/db小鼠心肌组织中TFAM的mRNA水平明显低于正常组水平,且随着周龄的增长表达逐渐降低(见图1)。
2.2 心肌组织TFAM蛋白表达进行性下降
为了进一步明确TFAM在糖尿病心肌组织中的表达情况,采用Western blot检测TFAM在心肌组织中的蛋白表达水平。结果显示,db/db小鼠心肌组织中TFAM的蛋白表达明显低于正常组水平,且随着周龄的增长表达逐渐降低,这与实时定量PCR的结果相一致(P<0.05,见图2)。
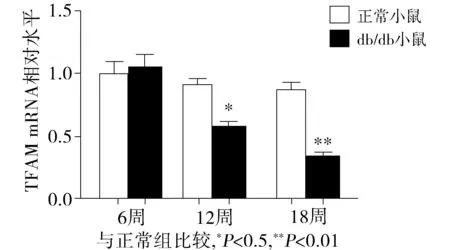
图1 正常组及db/db小鼠心肌组织TFAM的mRNA表达水平(n=3)Figure 1 The TFAM mRNA level in normal group and db/db mice group (n=3)
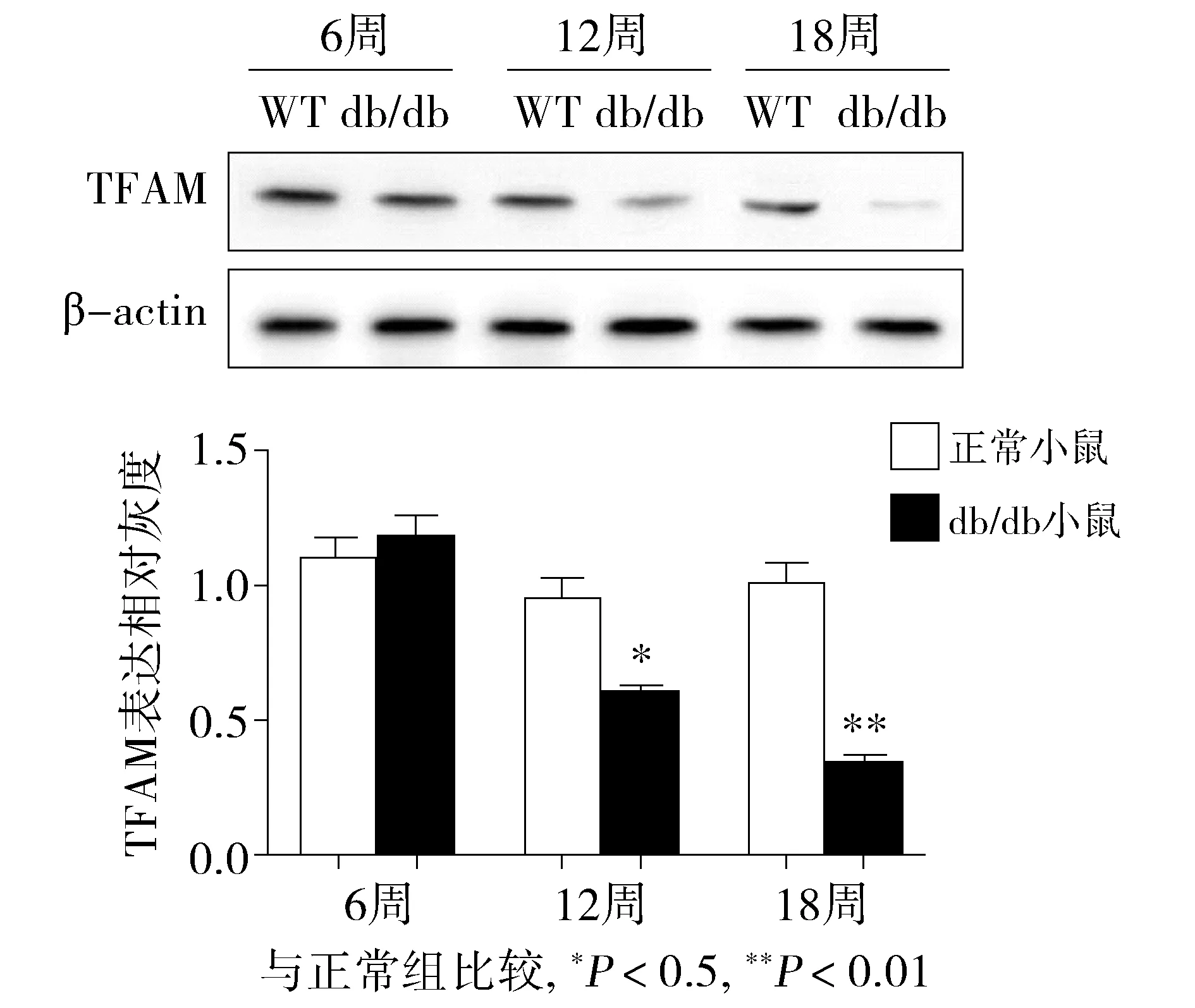
图2 正常组及db/db小鼠心肌组织TFAM的蛋白表达水平比较 (n=3) Figure 2 The TFAM protein level by Western blot in normal group and db/db mice group (n=3)
2.3 心肌组织线粒体mtDNA拷贝数随周龄增长表达降低
为了进一步明确TFAM是否参与影响了糖尿病心肌组织中线粒体的复制和转录过程,通过实时定量PCR检测心肌组织中线粒体mtDNA的拷贝数。结果显示,db/db小鼠心肌组织中心肌线粒体mtDNA拷贝数明显低于正常组水平,且随着周龄的增长表达逐渐降低(P<0.05,见图3)。
2.4 心肌组织ATP生成随周龄增长表达降低
TFAM与线粒体的生物学功能密切相关,为了初步研究TFAM是否影响了糖尿病心肌组织中线粒体的生物学功能,我们对心肌组织中ATP的生成进行了检测。结果显示,db/db小鼠心肌组织中心肌组织ATP的生成明显低于正常组水平,且随着周龄的增长ATP的生成逐渐降低(P<0.01,见图4)。
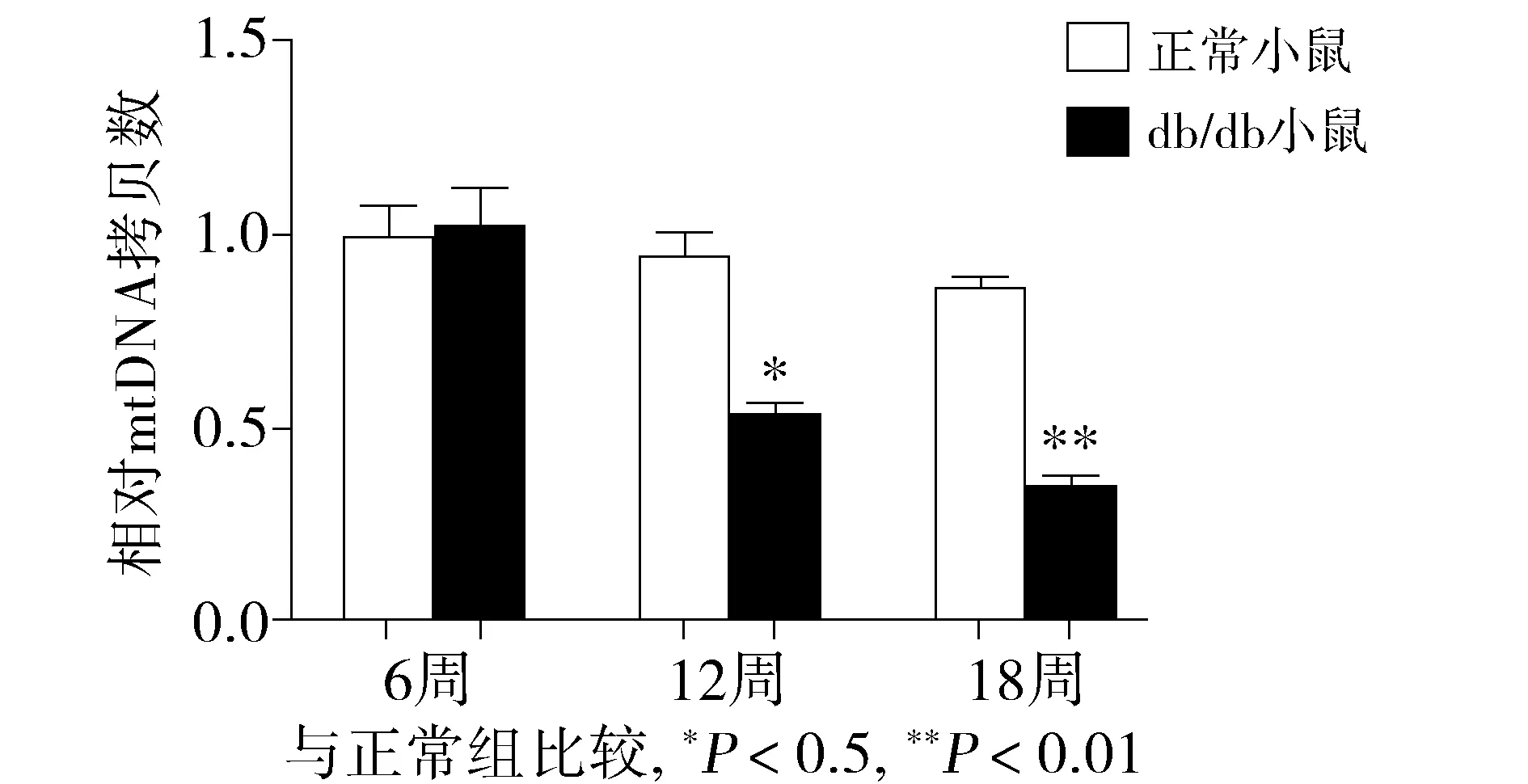
图3 正常组及db/db小鼠心肌组织线粒体mtDNA拷贝数 (n=3)Figure 3 The mtDNA copy number in normal group and db/db mice group (n=3)

图4 正常组及db/db小鼠心肌组织ATP生成量比较 (n=3)Figure 4 The level of ATP in normal group and db/db mice group (n=3)
3 讨论
城市及农村人口中糖尿病患者呈逐年上升的趋势,糖尿病的重要并发症之一糖尿病心肌病对人类的健康造成严重的危害。近期有学者认为,糖尿病心肌病的发生与线粒体功能的异常密切相关[15]。TFAM通过对线粒体复制和转录过程的调控,影响线粒体DNA转录激活过程和基因组复制、调节线粒体mtDNA拷贝数,进而影响线粒体的生物学功能[16]。Yue等[17]研究指出,心肌细胞缺血再灌注损伤为线粒体DNA损伤所致,其机制可能与心肌细胞中TFAM的表达降低密切相关。Hickson-Bick等[18]研究发现,在新生大鼠心肌细胞中,TFAM通过激活线粒体的生物多样性,抑制新生大鼠心肌细胞的程序性死亡,对心肌细胞产生保护作用。但TFAM在糖尿病心肌病中的作用及其机制尚不十分清楚。
本研究以瘦素受体敲除的db/db糖尿病小鼠为糖尿病心肌病疾病模型,首先检测了TFAM mRNA的表达水平,结果提示db/db糖尿病小鼠心肌组织中TFAM的mRNA水平明显低于正常组,且与小鼠的周龄呈明显的负相关。为了进一步明确上述实验的可信性,采用Western blot法对TFAM的蛋白表达进行了检测,实验结果与实时定量PCR的结果相一致。TFAM通过对线粒体复制和转录过程的调控,调节和影响线粒体mtDNA拷贝数,实时定量PCR实验结果显示,db/db小鼠心肌组织中心肌线粒体mtDNA拷贝数明显低于正常组水平,且随着周龄的增长表达逐渐降低。普遍研究认为,TFAM在发挥线粒体生物学功能中起到至关重要的作用,而ATP作为提供细胞能量物质,其主要来源于线粒体,因此,我们初步对TFAM是否对糖尿病心肌病中心肌组织线粒体ATP的生成产生影响进行了实验,结果发现,db/db小鼠心肌组织中心肌组织ATP的生成明显低于正常组水平,且随着周龄的增长ATP的生成逐渐降低。
综上认为,在糖尿病心肌病的发生及发展过程中,TFAM的表达进行性降低,这种变化可能引起线粒体复制和转录过程调控受到影响,线粒体DNA转录激活和基因组复制发生异常,进而引起线粒体mtDNA拷贝数发生改变,最终影响线粒体的生物学功能的发挥,如ATP的生成改变等,而这些改变可能最终导致糖尿病心肌病的发生。但由于实验条件的限制,本实验仅仅是对糖尿病心肌中TFAM的表达、心肌线粒体mtDNA拷贝数及其ATP的生成的改变进行了初步研究,并未对其具体机制进行更深层次的研究,这也导致了本研究具有一定的局限性。因此,以本课题的结果为依托,课题组将在后续研究中,对TFAM在糖尿病心肌组织中的表达定位及在糖尿病心肌病中发挥作用的深层次分子机制进行进一步的研究与探讨,以期为糖尿病心肌病的治疗提供新的潜在的治疗靶点。
[1] Liu Q,Wang S,Cai L.Diabetic cardiomyopathy and its mechanisms: Role of oxidative stress and damage[J].J Diabetes Investig,2014,5(6):623-634.
[2] Njike VY,Ayettey R,Petraro P,etal.Walnut ingestion in adults at risk for diabetes: effects on body composition,diet quality,and cardiac riskmeasures[J].BMJ Open Diabetes Res Care,2015,3(1):e000115.
[3] Bernardi S,Michelli A,Zuolo G,etal.Update on RAAS modulation for the treatment of diabetic cardiovascular disease[J]. J Diabetes Res,2016,2016:8917578.
[4] Mizamtsidi M,Paschou SA,Grapsa J,etal.Diabetic cardiomyopathy: a clinical entity or a cluster of molecular heart changes?[J].Eur J Clin Invest,2016,46(11):947-953.
[5] Guo X,Xue M,Li CJ,etal.Protectiveeffects of triptolide on TLR4 mediated autoimmune and inflammatory response induced myocardial fibrosis in diabetic cardiomyopathy[J].J Ethnopharmacol,2016,193:333-344.
[6] Haseeb A,Bilal M,Khan MA.N-acetyl cysteine:a possible treatment for diabetic cardiomyopathy[J].J Coll Physicians Surg Pak,2016,26(8):720.
[7] Higuchi T,Miyagawa S,Pearson JT. Functional and electrical integration of induced pluripotent stem cell-derived cardiomyocytes in a myocardial infarction rat heart[J]. Cell Transplant,2015,24(12):2479-2489.
[8] Sultana MR,Bagul PK,Katare PB,etal.Garlic activates SIRT-3 to prevent cardiac oxidative stress and mitochondrial dysfunction in diabetes[J]. Life Sci,2016,164:42-51.
[9] Arkat S,Umbarkar P,Singh S,etal.Mitochondrial peroxiredoxin-3 protects against hyperglycemia induced myocardial damage in diabetic cardiomyopathy[J].Free Radic Biol Med,2016,97:489-500.
[10] Vernochet C,Mourier A,Bezy O,etal.Adipose-specific deletion of TFAM increases mitochondrial oxidation and protects mice against obesity and insulin resistance[J]. Cell Metab,2012,16(6):765-776.
[11] Furukawa R,Yamada Y,Matsushima Y,etal.The manner in which DNA is packaged with TFAM has an impact on transcription activation and inhibition[J]. FEBS Open Bio,2012,2:145-150.
[12] Kang D,Kim SH,Hamasaki N.Mitochondrial transcription factor A (TFAM): roles in maintenance of mtDNA and cellular functions[J].Mitochondrion,2007,7(1-2):39-44.
[13] Lu Y,Li S,Wu H,etal.Beneficial effects of astragaloside Ⅳ against angiotensin Ⅱ-induced mitochondrial dysfunction in rat vascular smooth muscle cells[J].Int J Mol Med,2015,36(5):1223-1232.
[14] Colom B,Oliver J,Garcia-Palmer FJ. Sexual dimorphism in the alterations of cardiac muscle mitochondrial bioenergetics associated to the ageing process[J].J Gerontol A Biol Sci Med Sci,2015,70(11):1360-1369.
[15] Boudina S,Abel ED.Diabetic cardiomyopathy revisited[J].Circulation,2007,115:3213-3223.
[16] Sultana MR,Bagul PK,Katare PB,etal.Garlic activates SIRT-3 to prevent cardiac oxidative stress and mitochondrial dysfunction in diabetes[J].Life Sci,2016,164:42-51.
[17] Yue R,Xia X,Jiang J,etal.Mitochondrial DNA oxidative damage contributes to cardiomyocyte ischemia/reperfusion-injury in rats cardioprotective role of lycopene[J].J Cell Physiol,2015,230(9):2128-2141.
[18] Hickson-Bick DL,Jones C,Buja LM.Stimulation of mitochondrial biogenesis and autophagy by lipopolysaccharide in the neonatal rat cardiomyocyte protects against programmed cell death[J].J Mol Cell Cardiol,2008,44(2):411-418.
Expression of mitochondrial transcription factor A in myocardium of diabetic mice
ZHOU Yisheng1,JING Zhe2,LIU Fengzhou3,GAO Yuting2*
(1DepartmentofCardiology,LanzhouGeneralHospital,LanzhouMilitaryRegionAnningBranchCourts,Lanzhou730070,China;2DepartmentofCardiology,LanzhouGeneralHospital,LanzhouMilitaryRegion;3DepartmentofCardiology,XijingHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:937027447@qq.com)
ObjectiveTo investigate the altered expression of mitochondrial transcription factor A in db/db diabetic mice.MethodsNine male db/db mice were randomly divided into 3 groups(db/db 6 week, db/db 12 week and db/db 18 week) according to the feeding time,and nine male normal mice were also randomly divided into 3 groups(wt 6 week,wt 12 week and wt 18 week). The expression of TFAM was detected by real-time PCR and Western blot. The mtDNA copy number was detected by real-time PCR.ResultsCompared to normal group, the expression of TFAM and the mtDNA copies were decreased significantly in db/db mice group, and decreased gradually as the prolonging of feeding. ATP level showed the same tendency.ConclusionThe expression of TFAM is gradually decreased in db/db diabetic mice.
type 2 diabetes mellitus; myocardium; TFAM; mitochondria; mice
周益盛,男,1984-01生,学士, 住院医师,E-mail:zysgml@qq.com
2016-11-09
R587.1
A
1007-6611(2017)03-0211-04
10.13753/j.issn.1007-6611.2017.03.003

