5HRE增强子和hTERT启动子联合调控CDX2基因对裸鼠移植瘤的抑制作用
祁 杰,郑见宝,孙学军,王孝珑,余钧辉,吴云桦,高 琪,王 恺,贺 赛
(1陕西省人民医院心内二科,西安 710068;2西安交通大学第一附属医院普通外科;3西安交通大学第二附属医院肿瘤外科;4陕西省肿瘤医院乳腺病院;*通讯作者,E-mail:hesai.2006@stu.xjtu.edu.cn)
5HRE增强子和hTERT启动子联合调控CDX2基因对裸鼠移植瘤的抑制作用
祁 杰1,郑见宝2,孙学军2,王孝珑3,余钧辉2,吴云桦2,高 琪2,王 恺2,贺 赛4*
(1陕西省人民医院心内二科,西安 710068;2西安交通大学第一附属医院普通外科;3西安交通大学第二附属医院肿瘤外科;4陕西省肿瘤医院乳腺病院;*通讯作者,E-mail:hesai.2006@stu.xjtu.edu.cn)
目的 探讨5HRE增强子和hTERT启动子联合调控CDX2基因对结肠癌LoVo细胞裸鼠皮下移植瘤的抑制作用,为结肠癌生物治疗提供实验依据。 方法 将复苏前期筛选的稳定表达pLVX-hTERTp-CDX2-3FLAG(hC)的LoVo细胞(hC/LoVo)、空LoVo细胞、稳定表达pLVX-5HRE-hTERTp-3FLAG(5Hh)的LoVo细胞(5Hh/LoVo)及转染pLVX-5HRE-hTERTp-CDX2-3FLAG(5HhC)的LoVo细胞(5HhC/LoVo),接种各组细胞制备裸鼠皮下移植瘤模型,观察构建的载体对LoVo细胞移植瘤生长的影响;免疫组化法观察移植瘤CDX2和Ki-67的表达情况。 结果 成功复苏转染5HhC的LoVo细胞及各组对照LoVo细胞。各组裸鼠皮下接种肿瘤细胞后均成功致瘤,成瘤率为100%;5HhC组种植瘤生长速度显著低于其他组(P<0.05);终点时间第18天时,5HhC组裸鼠皮下种植瘤的体积明显小于其他各组(P<0.05);5HhC组种植瘤质量为(0.20±0.16)g,明显低于hC/LoVo组(0.34±0.21)g,空LoVo细胞组(0.61±0.19)g及5Hh/LoVo组(0.55±0.27)g(P<0.05);5HhC组种植瘤中CDX2表达为(87±7)%,明显低于hC/LoVo组(55±4)%,空LoVo细胞组(15±3)%及5Hh/LoVo组(17±5)%(P<0.05);5HhC组种植瘤中Ki-67表达为(7±7)%,明显低于hC/LoVo组(13±2)%,空LoVo细胞组(38±5)%及5Hh/LoVo组(85±9)%(P<0.05)。 结论 构建的双靶向调控载体5HhC可以抑制结肠癌LoVo细胞裸鼠移植瘤的生长。
基因治疗载体; 结肠癌; 裸鼠; 移植瘤; CDX2; Ki-67
结肠癌是全世界常见的恶性肿瘤,其病死率位居恶性肿瘤死因的第二位[1],预后不甚理想,且其发病率呈逐年上升趋势[2]。结肠癌的治疗是当今世界面临的一个重要难题,现代医学越来越关注肿瘤的基因治疗[3-5]。本课题组[6]前期构建完成了5个拷贝的缺氧反应元件(hypoxia response element,HRE)和人端粒酶催化亚单位(human telomerase reverse transcriptase,hTERT)双靶向联合调控元件,调控抑癌基因CDX2表达的慢病毒表达载体pLVX-5HRE-hTERTp-CDX2-3FLAG(5HhC)及其对照载体pLVX-hTERTp-CDX2-3FLAG(hC)、pLVX-5HRE-hTERTp-3FLAG(5Hh),并将上述载体进行病毒包装,转染人结肠癌LoVo细胞,获得了稳定表达5HhC的LoVo细胞(5HhC/LoVo)及稳定表达hC、5Hh的LoVo细胞(hC/LoVo、5Hh/LoVo),旨在利用增强子HRE和特异性启动子hTERT组成的调控元件,高效、特异地增强其下游抑癌基因CDX2的表达。在前期的实验中,本课题组已在体外对该载体的靶向性、特异性以及对结肠癌细胞系LoVo的增殖抑制进行了验证[7,8],本研究采用皮下组织块原位移植法构建裸鼠人结肠癌移植模型,进一步观察构建的双靶向调控载体在体内环境中对结肠癌移植瘤生长的影响。
1 材料与方法
1.1 实验动物与细胞株
4周龄雄性BALB/c裸鼠24只,购自上海斯莱克实验动物有限责任公司,饲养于SPF条件下。人结肠癌细胞株LoVo及单克隆细胞hC/LoVo、5Hh/LoVo、5HhC/LoVo均由本课题组前期保存,于含10%胎牛血清的DMEM培养液中,置于37℃、5%CO2培养箱中培养,取生长状态良好的细胞进行实验。
1.2 主要试剂
胎牛血清、DMEM细胞培养基购自美国Invitrogen公司,兔抗人CDX2、Ki-67单克隆抗体购自美国epitomics公司;辣根标记羊抗兔二抗、SP兔HRP显色试剂盒购自中杉公司。
1.3 裸鼠移植瘤模型的建立
BALB/c裸鼠随机分为hC/LoVo、LoVo、5Hh/LoVo和5HhC/LoVo细胞组,每组6只。收集处于对数生长期的各组细胞,于每组裸鼠后背部皮下注射0.2 ml各组细胞,细胞密度均调整至5×106/ml。细胞种植完成后,每天观察并记录肿块出现时间。肿瘤形成后,继续观察,每3 d用游标卡尺测量肿瘤的长径a和短径b,并计算肿瘤体积(V=π/6×ab2),绘制肿瘤生长曲线。于肿块长至直径约1.5-2 cm大小时,断颈处死裸鼠,摘取移植瘤并称重,并计算抑瘤率。抑瘤率(%)=(正常对照组平均瘤质量-抑制组平均瘤质量)/正常对照组平均瘤质量×100%[9]。
1.4 免疫组织化学法检测裸鼠移植瘤组织中CDX2,Ki-67蛋白的表达
将各组裸鼠移植瘤组织经40 g/L多聚甲醛固定,常规脱水,石蜡包埋,连续切片,切片厚度4-6 μm。参照免疫组化SP法试剂盒说明书进行操作,以PBS液代替一抗作为阴性对照。胞质/胞核棕黄色染色为阳性,其中CDX2以胞质着色为主,Ki-67以胞核染色为主,每张切片随机取5个视野(×400),观察200个细胞,计数阳性细胞数。
1.5 统计学分析
2 结果
2.1 5HhC对裸鼠皮下种植瘤生长的影响
裸鼠皮下分别接种hC/LoVo、LoVo、5Hh/LoVo和5HhC/LoVo单细胞悬液后,全部存活并有肿瘤形成,致瘤成功率100%。各组种植瘤持续生长,未出现致瘤裸鼠死亡,第18天时拍照记录并处死裸鼠获取肿瘤(见图1)。绘制肿瘤生长曲线,hC/LoVo组和5HhC/LoVo组种植瘤生长速度显著低于LoVo与5Hh/LoVo组(P<0.05),5HhC/LoVo组种植瘤生长速度显著低于hC/LoVo组,差异具有统计学意义(P<0.05,见图2);终点时间第18天,hC/LoVo组和5HhC/LoVo组裸鼠皮下种植瘤的体积显著小于LoVo与5Hh/LoVo组裸鼠皮下种植瘤的体积(P<0.05),并且5HhC/LoVo组裸鼠皮下种植瘤的体积亦明显小于hC/LoVo组裸鼠皮下种植瘤的体积,差异具有统计学意义(P<0.05)。
2.2 5HhC对肿瘤质量的影响及抑瘤率
终点时间处死裸鼠获取各组肿瘤,称取肿瘤质量,hC/LoVo和5HhC/LoVo组种植瘤质量分别为(0.34±0.21)g和(0.20±0.16)g,明显低于LoVo组(0.61±0.19)g及5Hh/LoVo组(0.55±0.27)g(P<0.05);hC/LoVo组与5HhC/LoVo组种植瘤质量亦有明显差异(P<0.05,见图3)。与LoVo组比较,hC/LoVo组及5HhC/LoVo组的抑瘤率分别为44.3%及67.2%。
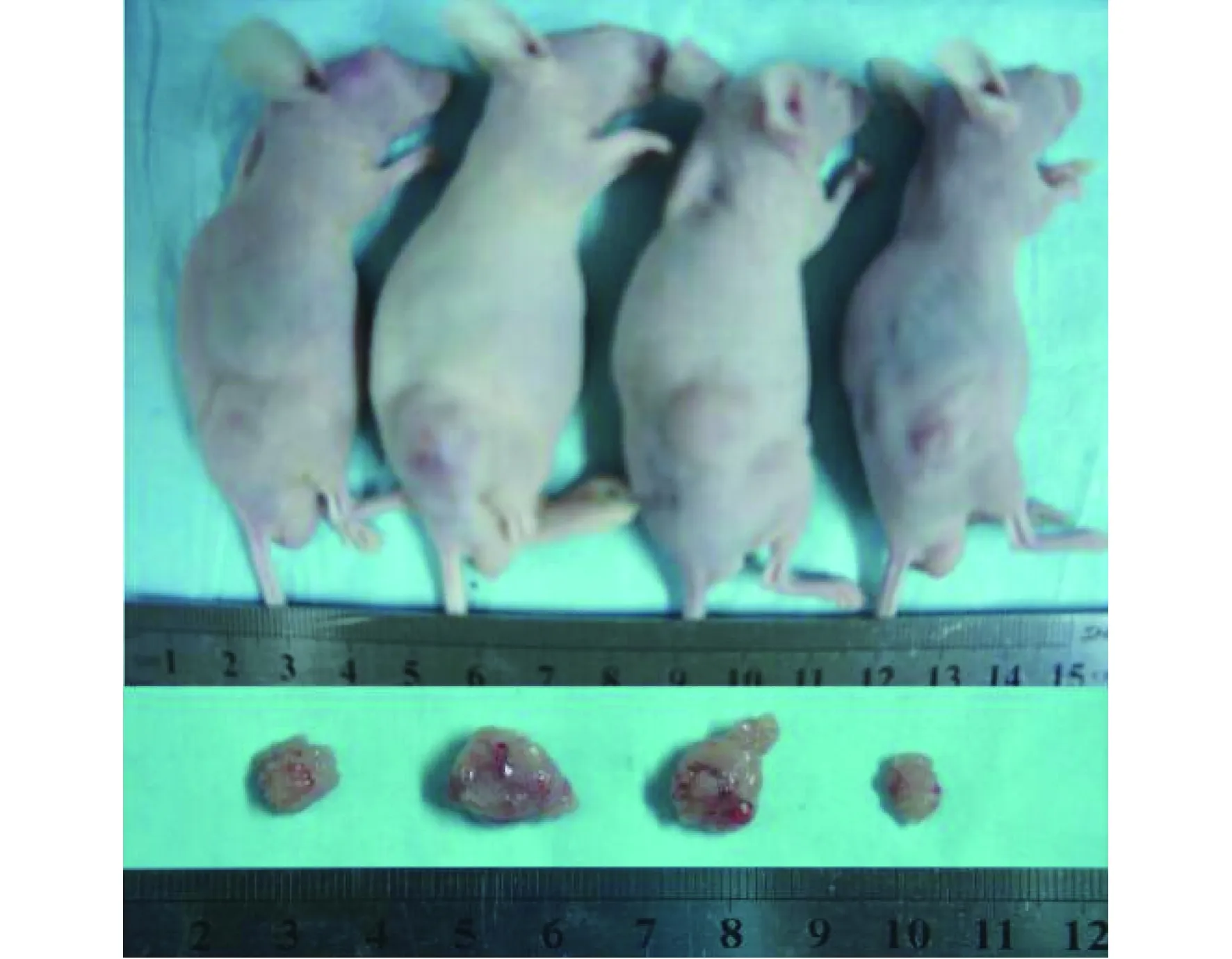
从左至右分别为hC/LoVo、LoVo、5Hh/LoVo和5HhC/LoVo组图1 5HhC抑制裸鼠皮下结肠癌种植瘤生长Figure 1 5HhC suppressed the growth of transplanted colorectal tumors
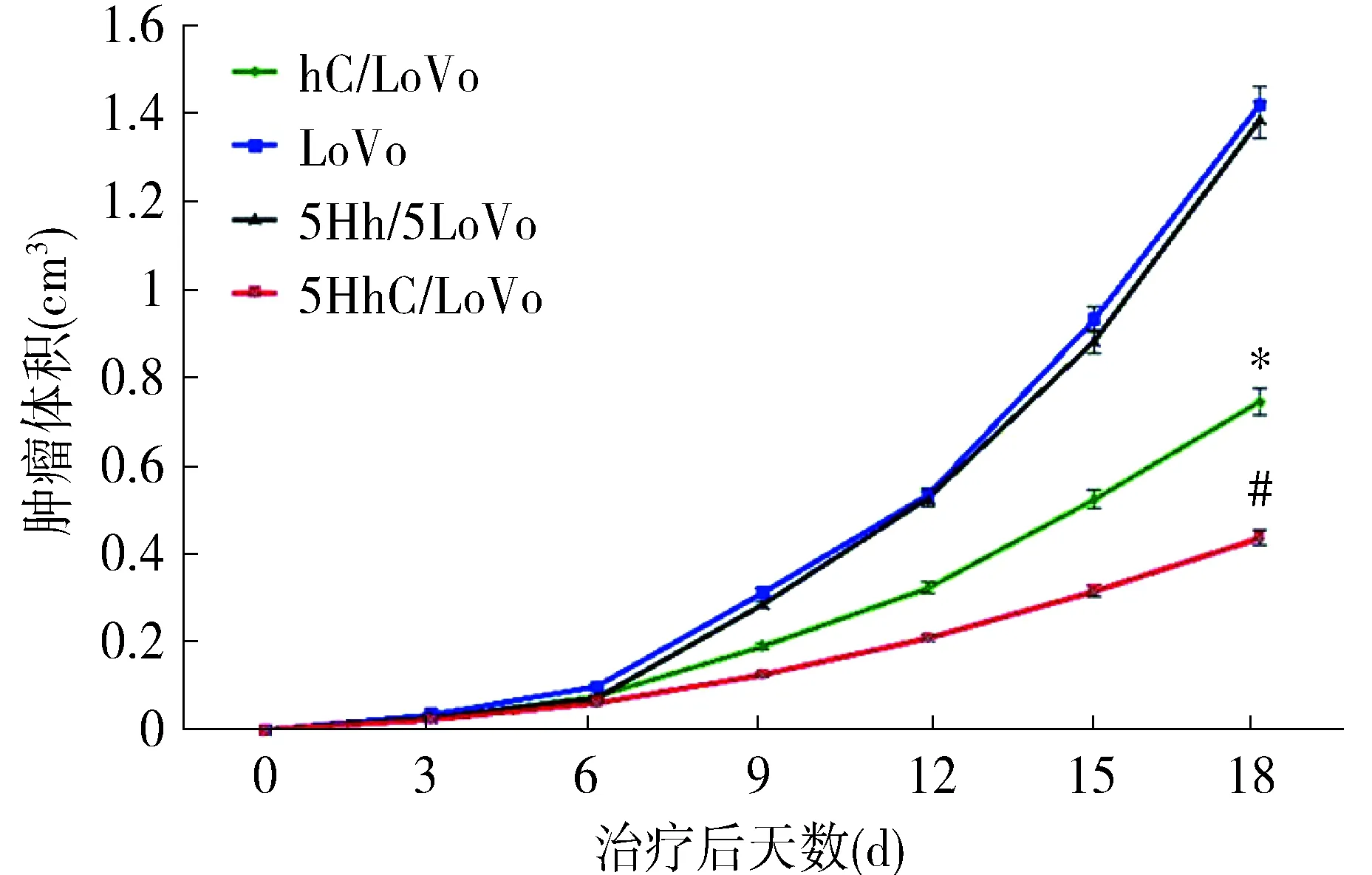
与5Hh/LoVo和LoVo组比较,*P<0.05;与hC/LoVo组比较,#P<0.05图2 各组裸鼠移植瘤生长曲线Figure 2 The growth curve of xenograft tumor in all groups
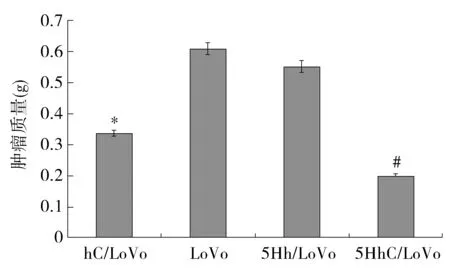
与5Hh/LoVo组和LoVo组比较,*P<0.05;与hC/ LoVo组比较,#P<0.05图3 各组裸鼠移植瘤质量对比Figure 3 Comparison of tumor weight among four groups
2.3 各组种植瘤中CDX2,Ki-67的表达
CDX2在肿瘤细胞中表达于细胞质,胞质有棕黄色染色为CDX2蛋白阳性表达;Ki-67在肿瘤细胞中表达于细胞核,胞核有棕黄色染色为Ki-67蛋白阳性表达(见图4)。hC/LoVo和5HhC/LoVo组CDX2蛋白阳性表达细胞所占百分比分别为(55±4)%和(87±7)%,明显高于LoVo组(15±3)%及5Hh/LoVo组(17±5)%,其中5HhC/LoVo组的CDX2
表达明显高于hC/LoVo组,差异均具有统计学意义(P<0.05,见图5)。hC/LoVo和5HhC/LoVo组Ki-67蛋白阳性表达细胞所百分比分别为(13±2)%与(7±7)%,明显低于LoVo组(38±5)%及5Hh/LoVo组(85±9)%,其中,5HhC/LoVo组的Ki-67表达明显低于hC/LoVo组(P<0.05,见图5)。
3 讨论
低氧是实体肿瘤的共同特征,它是癌细胞快速增殖与血液供应相对滞后的结果[10,11]。近年来,肿瘤的生长与其内部的缺氧微环境的关系倍受研究者关注。缺氧反应元件(hypoxia response element,HRE)是位于低氧相关基因3′或5′端的一段DNA序列,其核心序列可与缺氧诱导因子HIF-1特异结合,形成转录起始复合物,从而启动靶基因的转录[12]。近年来,为了增加目的基因在缺氧微环境下的表达水平,5个拷贝的缺氧反应元件(HRE)作为一种增强子,经常被应用于治疗载体的构建。Wang等[11]证明5HRE调控的TSST-1基因的表达在缺氧微环境下能够明显上调。因此,作为增强子,5HRE可以很好地在缺氧微环境下上调目的基因的表达。分子靶向性基因治疗在肿瘤的治疗中具有广阔的应用前景,使用肿瘤特异性启动子调控治疗载体的表达,使得肿瘤的靶向性基因治疗成为可能。hTERT启动子,由于其在大多数肿瘤细胞中表达,而在正常细胞中不表达[13-16],使得它在治疗载体的构建中成为一种有用的调控元件。Hashimoto等[16]构建了一种hTERT启动子调控的溶菌细胞腺病毒载体,可以有效地特异性杀伤人肿瘤细胞,而对人正常的体细胞没有作用。上述数据表明,在肿瘤的基因治疗过程中,肿瘤特异性的hTERT启动子为我们提供了一种新途径。
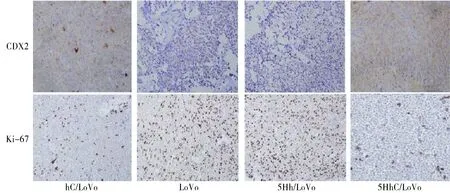
图4 各组种植瘤中CDX2,Ki-67的表达Figure 4 Immunohistochemical staining of CDX2,Ki-67 expression in tumor specimens
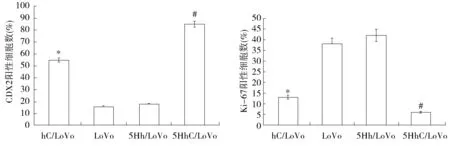
与5Hh/LoVo和LoVo组比较,*P<0.05;与hC/LoVo组比较,#P<0.05图5 各组种植瘤中CDX2,Ki-67的表达Figure 5 Expression of CDX2,Ki-67 expression in tumor tissues
基于以上思路,为了实现治疗载体在肿瘤细胞中特异性和高效性的表达,本课题组前期构建了增强子5HRE和启动子hTERT双靶向联合调控抑癌基因CDX2表达的慢病毒表达载体5HhC及其对照载体,已在体外对该载体的靶向性及高效性进行了鉴定,并且验证了该治疗载体对结肠癌细胞LoVo在体外增殖的抑制作用[6-8]。本实验表明,hC/LoVo组与5HhC/LoVo组肿瘤生长相对LoVo、5Hh/LoVo组明显减慢,且二者最终种植瘤质量小于后者,提示抑癌基因CDX2在LoVo细胞中的过表达能够抑制移植瘤的生长,而5HhC/LoVo组种植瘤生长速度、种植瘤质量亦与hC/LoVo组具有明显差异,提示由于治疗载体5HhC中5HRE增强子的作用,使得其可以利用肿瘤内部缺氧的特性,增强治疗载体下游的抑癌基因CDX2的表达,从而使其具有更好的抑制肿瘤生长的作用。此外,通过免疫组化法检测了移植瘤中CDX2和Ki-67的表达情况,结果显示5HhC/LoVo组种植瘤中CDX2高表达,其表达量明显高于其他三组,而该组中增殖细胞核抗原Ki-67的表达明显低于其他三组,差异均具有统计学意义。本研究结果与前期体外实验的结果一致,与理论分析相符。
综上,本实验证明了前期构建的治疗载体5HhC可以有效抑制裸鼠皮下结肠癌移植瘤的生长,由此可见CDX2在结肠癌的发病中起重要作用,并可能成为基因治疗潜在的侯选靶点,同时,该双靶向治疗载体以其高效、特异等优点体现出了很高的潜在的发展前景,相信随着对该载体的深入研究,可以为探讨结肠癌治疗的新途径提供实验依据。
[1] Laszlo L.Predictive and prognostric factors in the complex treatment of patients with colorectal cancer[J].Magy Onkol,2010,54(4):383-394.
[2] 陈宣辰,程军,张意.结直肠癌相关炎性因子的研究进展[J].中国肿瘤生物治疗杂志,2012,19(001):103-106.
[3] Shayakhmetov DM,Di Paolo NC,Mossman KL.Recognition of virus infection and innate host responses to viral gene therapy vectors[J].Mol Ther,2012,18(8):1422-1429.
[4] Chen EQ,Song XQ,Wang YL,etal.Construction of a highly-active,liver-specific transcriptional regulatory element through combination of the albumin promoter and α-fetoprotein enhancer[J].Plasmid,2011,65(2):125-131.
[5] Dong K,Wang R,Wang X,etal.Tumor-specific RNAi targeting eIF4E suppresses tumor growth,induces apoptosis and enhances cisplatin cytotoxicity in human breast carcinoma cells[J].Breast Cancer Res Treat,2009,113(3):443-456.
[6] 郑见宝,贺赛,孙学军,等.双靶向调控CDX2基因慢病毒表达载体的构建及鉴定[J].中国普外基础与临床杂志,2014,21(4):414-419.
[7] 贺赛,郑见宝,孙学军,等.缺氧诱导的肿瘤特异性基因治疗载体的靶向性鉴定[J].西安交通大学学报(医学版),2014,35(4):473-477.
[8] 贺赛,郑见宝,孙学军,等.缺氧诱导的肿瘤特异性基因治疗载体对人结肠癌细胞系LoVo增殖的影响[J].中国肿瘤生物治疗杂志,2014,21(3):314-318.
[9] Ji J,Zheng PS.Expression of Sox2 in human cervical carcinogenesis[J].Hum Pathol,2010,41(10):1438-1447.
[10] Jubb AM,Buffa FM,Harris AL.Assessment of tumor hypoxia for prediction of response to therapy and cancer prognosis[J].J Cell Mol Med,2010,14(1-2):18-29.
[11] Wang W,Sun XJ,Lu L,etal.Cytotoxicity of lymphocytes activated by superantigen toxic-shock-syndrome toxin-1 against colorectal cancer LoVo cells[J].Mol Cell Biochem,2013,376(1-2):1-9.
[12] Hu J,Stiehl DP,Setzer C,etal.Interaction of HIF and USF signaling pathways in human genes flanked by hypoxia-response elements and E-box palindromes[J].Mol Cancer Res,2011,9(11):1520-1536.
[13] Li X,Wang K,Ren Y,etal.MAPK signaling mediates sinomenine hydrochlorideinduced human breast cancer cell death via both reactive oxygen species-dependent and-independent pathways:an in vitro and in vivo study[J].Cell Death Dis,2014(5):e1356.
[14] Wang W,Jin B,Li W,etal.Targeted antitumor effect induced by hTERT promoter mediated ODC antisense adenovirus[J].Mol Biol Rep,2009,37(7):3239-3247.
[15] Nemunaitis J,Tong AW,Nemunaitis M,etal.A phase I study of telomerase-specific replication competent oncolytic adenovirus(telomelysin)for various solid tumors[J].Mol Ther,2010,18(2):429-434.
[16] Hashimoto Y,Tazawa H,Teraish F,etal.The hTERT promoter enhances the antitumor activity of an oncolytic adenovirus under a hypoxic microenvironment[J].PLoS One,2012,7(6):e39292.
[17] Bougel S,Renaud S,Braunschweig R,etal.PAX5 activates the transcription of the human telomerase reverse transcriptase gene in B cells[J].J Pathol,2010,220(1):87-96.
Effects of regulation of CDX2 gene by 5HRE enhancer and hTERT promoter on growth of colorectal transplanted tumors in nude mice
QI Jie1,ZHENG Jianbao2,SUN Xuejun2,WANG Xiaolong3,YU Junhui2,WU Yunhua2,GAO Qi2,WANG Kai2,HE Sai4*
(1DepartmentofVascularDisease,ShaanxiProvincialHospital,Xi’an710068,China;2DepartmentofGeneralSurgery,FirstAffiliatedHospitalofXi’anJiaotongUniversity;3DepartmentofSurgicalOncology,FirstAffiliatedHospitalofXi’anJiaotongUniversity;4DepartmentofBreastCancer,ShaanxiProvincialTumorHospital;*Correspondingauthor,E-mail:hesai.2006@stu.xjtu.edu.cn)
ObjectiveTo verify the effect of pLVX-5HRE-hTERTp-CDX2-3FLAG(5HhC)containing the tumor suppressor gene CDX2 regulated by the hypoxia-induced enhancer(HRE)and the hTERT promoter on growth of colorectal transplanted tumors in mude mice.MethodsThe LoVo cells with stable expression of pLVX-hTERTp-CDX2-3FLAG (hC),pLVX-5HRE-hTERTp-3FLAG(5Hh)and pLVX-5HRE-hTERTp-CDX2-3FLAG(5HhC)were obtained by transfection technique,named as hC/LoVo,5Hh/LoVo and 5HhC/LoVo.A xenograft tumor model was established and tumor growth was observed.The expression of CDX2 and Ki-67 protein in tumor tissues were detected by immunohistochemistry.ResultsThe xenograft tumor models of human colorectal carcinoma cells in hC/LoVo,LoVo,5Hh/LoVo and 5HhC/LoVo groups were established successfully.The tumor volume in 5HhC/LoVo group was significantly smaller than in the other three groups at every time point(P<0.05).At the termination of observation,the tumor weight in 5HhC/Lovo group was significantly smaller than in hC/LoVo,LoVo and 5Hh/LoVo groups respectively[(0.20±0.16)gvs(0.34±0.21)g,(0.61±0.19)g,(0.55±0.27)g,P<0.05].The expression of CDX2 protein by immunohistochemistry in tumor tissues in 5HhC/LoVo group[(87±7)%]were higher than that of hC/LoVo[(55±4)%],LoVo[(15±3)%]and 5Hh/LoVo[(17±5)%],respectively(P<0.05),while the expression of Ki-67 protein in tumor tissues in 5HhC/LoVo group was lower than in the other three groups[(7±7)%vs(13±2)%,LoVo(38±5)% and 5Hh/LoVo(85±9)%,P<0.05].ConclusionThe gene therapy vector 5HhC may induce the growth of colorectal transplanted tumors in mude mice.
gene therapy vector; colon cancer; nude mice; xenograft tumor; CDX2; Ki-67
国家自然科学基金资助项目(81101874,81172362);陕西省科学技术研究发展计划项目(2016SF-015);陕西省科技统筹创新工程计划项目(2013KTCQ03-08)
祁杰,女,1983-09生,硕士,主治医师,E-mail:qijie_1983@163.com
2016-12-19
R735.35
A
1007-6611(2017)03-0246-05
10.13753/j.issn.1007-6611.2017.03.010

