冬凌草甲素通过下调NF-κB/COX-2表达抑制结肠癌LoVo细胞增殖
刘 娜,李文强,高成伟
(武汉大学人民医院急诊科,武汉 430060;*通讯作者,E-mail:wenqiang67@sohu.com;#共同通讯作者,E-mail:gaochengweihubei@163.com)
冬凌草甲素通过下调NF-κB/COX-2表达抑制结肠癌LoVo细胞增殖
刘 娜,李文强*,高成伟#
(武汉大学人民医院急诊科,武汉 430060;*通讯作者,E-mail:wenqiang67@sohu.com;#共同通讯作者,E-mail:gaochengweihubei@163.com)
目的 观察天然植物冬凌草提取物冬凌草甲素对结肠癌LoVo细胞增殖、凋亡的作用,并分析其可能的作用机制。 方法 体外培养LoVo细胞,用不同浓度冬凌草甲素(0-240 μmol/L)分别处理24,48,72 h,MTT法检测细胞活力的改变。冬凌草甲素(终浓度为0,30,60,120 μmol/L)分别处理LoVo细胞48 h,流式细胞仪检测细胞凋亡率的变化,ELISA法检测细胞上清液中PGE2的含量;Western blot检测细胞蛋白环氧合酶-2(COX-2)、p-NF-κB(p65)、Bcl-2及Bax的表达的改变。 结果 冬凌草甲素(15-240 μmol/L)能显著抑制LoVo细胞活力(P<0.05),呈剂量、时间依赖性。冬凌草甲素(终浓度为0,30,60,120 μmol/L)处理LoVo细胞48 h后,细胞凋亡率分别为8.83%,15.5%,22.64%和25.86%;冬凌草甲素处理LoVo细胞48 h后,细胞Bax蛋白表达上调,Bcl-2蛋白表达下调(P<0.05),同时p-NF-κB(p65)、COX-2蛋白的表达及PGE2合成降低(P<0.05)。 结论 冬凌草甲素可通过抑制p-NF-κB、COX-2表达及PGE2合成,继而上调促凋亡蛋白Bax表达,下调抗凋亡蛋白Bcl-2表达,抑制LoVo细胞增殖并诱导细胞凋亡。
冬凌草甲素; LoVo细胞; 细胞凋亡; 环氧合酶-2; 前列腺素E2
大肠癌是常见的消化道恶性肿瘤,其发病率居恶性肿瘤的第3位,死亡率则高居恶性肿瘤相关死亡的第2位[1];每年全球有超过120万新增病例,有超过60万病例死亡[2]。治疗大肠癌的有效性取决于能否早期诊断,其治疗措施包括手术切除、放疗或化疗等各种组合的综合治疗。不幸的是,在大肠癌的早期阶段,其发病隐匿,即使早期有症状,因其非特异性也未引起患者重视,导致早期诊断困难。事实上,大多数大肠癌患者就医时都已经属于中晚期。化疗仍是进展期大肠癌的主要治疗方式,然而常规化疗药物毒副作用大,易耐药。因此,迫切需要寻找新的治疗方法和策略。
冬凌草甲素(oridonin),又称延命草宁,是从冬凌草中提取的以贝壳杉烯(ent-kaurene)为骨架的四环二萜类化合物,是冬凌草中最主要的活性成分。前期研究已经证实,其具有抗炎、抗氧化、调解免疫、抗菌等多种药理活性[3]。近年来,大量资料证实,冬凌草甲素也具有抗肿瘤活性,对食管癌、膀胱癌及肺癌等多种肿瘤细胞的均有抑制作用[4-7]。本研究拟观察冬凌草甲素对结肠癌细胞系LoVo细胞增殖、凋亡的影响,探讨其作用机制。
1 材料与方法
1.1 细胞株及主要试剂
结肠癌LoVo细胞由中国科学院上海细胞库提供;冬凌草甲素购自上海诗丹德生物技术有限公司(纯度>98%),用DMSO 配制成10 mmol/L(DMSO的终浓度小于0.1%)的母液,-20 ℃保存;胎牛血清购自GBICO;培养板购于Corning公司;PGE2 ELISA试剂盒购自美国BPB公司;Bax、Bcl-2、COX-2、p-NF-κB(p65)及β-actin抗体购自Cell Signaling Technology公司。RPMI1640培养液、辣根酶标记山羊抗兔或山羊抗鼠IgG购自碧云天生物技术研究所。
1.2 主要仪器
台式低温离心机购自日本Hitachi公司;微量精密移液器购自德国Eppendorf公司;细胞培养箱购自美国Thermo公司;正置荧光显微镜购自日本Olympus公司;电子分析天平购自上海精密仪器仪表有限公司;普通冰箱购自海尔集团;超低温冰箱购自美国ThermoForma公司;脱色摇床购自金坛市正基仪器有限公司;ZP-200恒温振荡器购自常州国华电器有限公司;手提压力式蒸汽灭菌器购自上海华线医用核子仪器有限公司;电热恒温干燥箱购自天津泰斯特仪器有限公司;自动三重纯水蒸馏器购自上海亚荣生化仪器厂;流式细胞仪购自美国Berkman公司;超净工作台(SW-CJ-IFD型)购自苏州真田洁净设备有限公司。
1.3 细胞培养及分组
用含10%胎牛血清的RMPI 1640培养基,于37 ℃,5% CO2条件细胞培养箱中培养LoVo细胞,取生长状态良好的并处于对数期的细胞进行实验。实验分为4组:对照组(0 μmol/L冬凌草甲素)、30 μmol/L冬凌草甲素组、60 μmol/L冬凌草甲素组和120 μmol/L冬凌草甲素组。
1.4 细胞活力测定
取3块96孔板,同时准备好细胞计数板;取对数生长期的细胞备用;调整细胞浓度为5×104/ml,每组设3个复孔,每孔加培养基150 μl,铺板过程中确保每个孔接种的细胞数目一致,铺板完成后将培养板放培养箱中继续孵育;细胞贴壁后各组分别加入冬凌草甲素终浓度为0,15,30,60,120,240 μmol/L的培养液,3块培养板分别培养24,48,72 h,在培养终止前4 h,每孔内加入10 μl 5 mg/ml的MTT,继续孵育4 h后,弃去培养液,每孔加入100 μl的DMSO终止反应。将96孔板置于振荡器上振荡10 min后,在酶标仪上检测490 nm的A值。细胞活力(%)计算公式:(实验组平均A值-调零孔A值)/(对照组平均A值-调零孔A值)]×100%。
1.5 细胞凋亡率检测
取对数生长期细胞,接种于6孔板中,贴壁后弃上清。冬凌草甲素组分别加入含不同浓度冬凌草甲素(终浓度为30,60,120 μmol/L)的培养液,对照组加入含10%胎牛血清的培养基,将6孔板置于培养箱中,培养48 h,收集培养上清于5 ml离心管中,用D-Hanks液洗涤细胞1次,胰酶消化细胞,收集细胞于同一5 ml离心管中。4 ℃条件下1 500 r/min离心5 min,弃上清,收集细胞。用1×的binding buffer液洗涤细胞,4 ℃条件下1 500 r/min,离心5 min,收集细胞,加入staining buffer液,充分混匀,重悬细胞,调整细胞密度为5×106cell/ml。取5 μl annexin V-APC加入100 μl细胞悬液进行染色,室温下避光放置10 min,将染色后的细胞悬液用流式细胞仪检测,每组设3个复孔。
1.6 ELISA法检测PGE2
按照预定分组处理48 h后,吸取培养基离心后将上清液移至高压消毒的EP管中备用。加入标准品至酶标板中,设置梯度,分别取各组上清液样品100 μl,加入至酶标板中,再分别将每孔加入酶标液50 μl,室温放置90 min。具体操作步骤根据试剂盒要求进行,根据标准品曲线计算样品中PGE2浓度。
1.7 Western blot检测COX-2及p-NF-κB(p65)蛋白表达
消化离心收集各组处理48 h后的细胞,预冷PBS液洗涤,加入预冷蛋白裂解液200 μl,4 ℃裂解30 min,置于冰上超声裂解;4 ℃,12 000 r/min离心10 min,小心吸取上清,移至高压消毒过的EP管中,分装后于-80 ℃储存。采用BCA法测定蛋白质;取40 μg样品并加入等体积上样缓冲液,SDS-PAGE电泳,再转膜至PVDF膜,37 ℃条件下用5% BSA封闭1 h,分别加入兔抗人COX-2、p-NF-κB(p65)抗体,4 ℃摇床上孵育过夜;TBST洗膜,加入稀释比例为1 ∶1 000的辣根酶标记的山羊抗兔二抗,37 ℃条件下孵育2 h,TBST洗膜,暗室曝光、显影定影,分析结果。
1.8 统计学分析
采用SPSS17.0统计软件分析数据,所有计量资料以均数±标准差表示,两样本间参数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 冬凌草甲素对LoVo细胞活力的影响
冬凌草甲素在15-240 μmol/L范围内均可抑制LoVo细胞的增殖(见图1),抑制作用呈时间和浓度依赖性,药物浓度越高、作用时间越长,其发挥抗肿瘤作用效果亦越好。

图1 冬凌草甲素对LoVo细胞增殖的影响Figure 1 The effect of oridonin on the cell proliferation of LoVo colorectal cancer cells
2.2 冬凌草甲素对LoVo细胞凋亡的影响
冬凌草甲素(浓度分别为0,30,60,120 μmol/L)处理LoVo细胞48 h后,细胞凋亡率分别为8.83%,15.5%,22.64%和25.86%(见图2),随着药物浓度的增加,细胞凋亡率逐渐增加。提示冬凌草甲素能诱导LoVo细胞凋亡。
2.3 冬凌草甲素对LoVo细胞凋亡相关蛋白Bax及Bcl-2蛋白表达的影响
0,30,60,120 μmol/L的冬凌草甲素处理LoVo细胞48 h后,Western blot结果显示随着药物浓度的升高,促凋亡蛋白Bax表达量逐渐升高,而抗凋亡蛋白Bcl-2表达量逐渐降低(P<0.05,见图3)。
2.4 冬凌草甲素对LoVo细胞COX-2的影响
0,30,60,120 μmol/L浓度的冬凌草甲素处理LoVo细胞48 h后,COX-2表达逐渐降低(P<0.05,见图4),表明冬凌草甲素可下调LoVo细胞COX-2表达。

图2 冬凌草甲素对LoVo细胞凋亡率的影响Figure 2 The effect of oridonin on the cell apoptosis of LoVo colorectal cancer cells
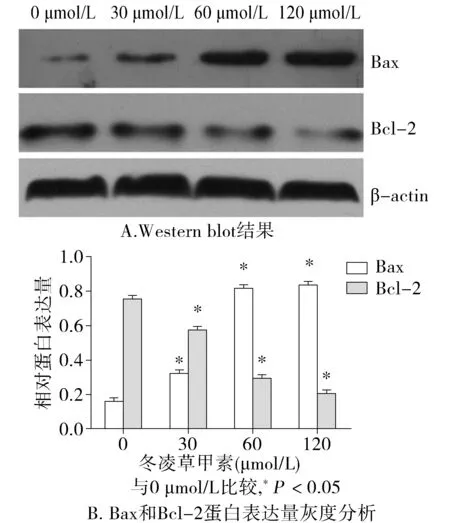
图3 冬凌草甲素对LoVo细胞Bax和Bcl-2蛋白表达的影响Figure 3 The effect of oridonin on the expression of Bax and Bcl-2 in LoVo colorectal cancer cells
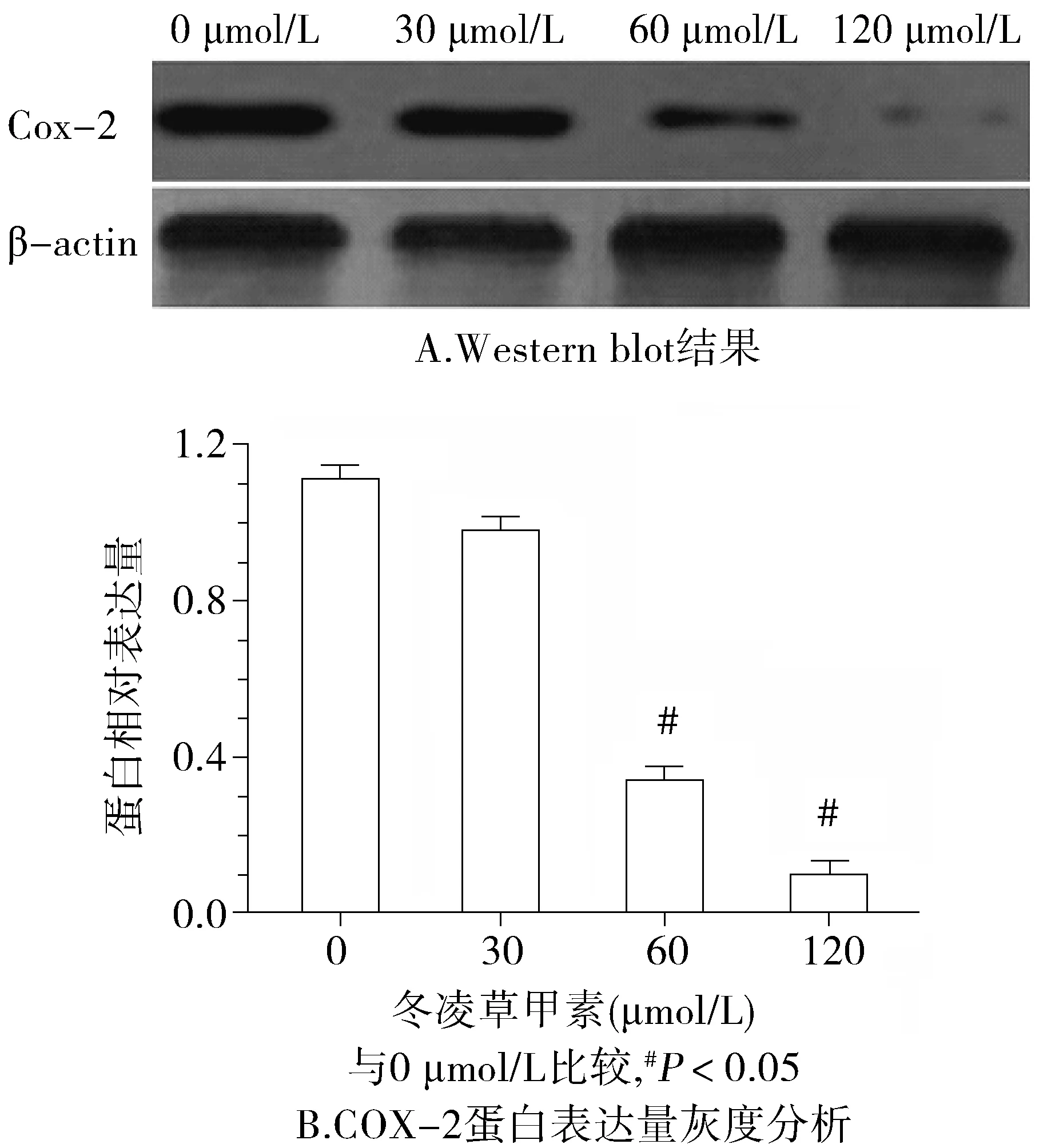
图4 冬凌草甲素对LoVo细胞COX-2蛋白表达的影响Figure 4 The effect of oridonin on the expression of COX-2 in LoVo colorectal cancer cells
2.5 冬凌草甲素对LoVo细胞PGE2产生的影响
PGE2作为COX-2的催化产物,与COX-2表达水平及活性密切相关。进一步探讨了30,60,120 μmol/L浓度的冬凌草甲素分别处理LoVo细胞48 h后对细胞上清液中PGE2浓度的影响,结果表明随着药物浓度的增加,细胞上清液中PGE2浓度明显降低(见图5),与对照组比较,差异均有统计学意义(P<0.05)。

图5 冬凌草甲素对LoVo细胞PGE2合成的影响Figure 5 The effect of oridonin on the synthesis of PGE2 in LoVo colorectal cancer cells
2.6 冬凌草甲素对LoVo细胞NF-κB表达的影响
作为炎症反应的调控基因,NF-κB参与调控COX-2的表达,因此本实验进一步探讨冬凌草甲素对NF-κB/p65表达的作用,不同浓度的冬凌草甲素处理LoVo细胞48 h后,细胞核内p-NF-κB(p65)表达量减少,呈浓度依赖性(见图6)。

图6 冬凌草甲素对LoVo细胞核内p-NF-κB表达的影响Figure 6 The effect of oridonin on the expression of p-NF-κB within nucleus in LoVo colorectal cancer cells
3 讨论
本实验结果显示,冬凌草甲素可抑制LoVo细胞的增殖,且抑制作用呈时间和浓度依赖性,药物浓度越高、作用时间越长,其发挥抗肿瘤作用效果亦越好。同时,本实验结果显示冬凌草甲素处理后可显著诱导细胞凋亡,呈浓度依赖性。这些结果表明,冬凌草甲素可能通过激活细胞凋亡通路抑制细胞增殖。
本实验检测了冬凌草甲素对凋亡相关蛋白Bcl-2及Bax表达的影响。结果显示冬凌草甲素可下调LoVo细胞抗凋亡蛋白Bcl-2的表达,同时上调促凋亡蛋白Bax的表达。抗凋亡蛋白Bcl-2主要存在于线粒体、内质网和核膜上,研究显示在多种肿瘤细胞中Bcl-2均成过表达状态,引起细胞持续增殖。Bcl-2可通过增强线粒体膜电位,保持线粒体内外膜的完整性,及抑制Ca2+释放,阻止核酸内切酶活化等多种机制抑制细胞凋亡,在肿瘤发生及发展中扮演着重要角色[8,9];此外,Bcl-2还可通过与ERK等通路相互作用,调节细胞凋亡[10]。研究显示下调Bcl-2的表达可促进细胞凋亡,并可延长中路患者的生存期[11];促凋亡蛋白Bax也属于Bcl-2家族,但其作用与Bcl-2相反,Bax即可与自身形成同源二聚体,又可与Bcl-2相互结合形成异源二聚体,Bcl-2表达上调时可促进自身与Bax结合形成异源二聚体,发挥抗凋亡作用,Bcl-2表达下调时,则出现相反的效应[12]。
包括结肠癌在内的多种肿瘤均高表达COX-2。作为PGE2合成过程的重要限速酶,过表达的COX-2又大量产生PGE2,二者共同参与肿瘤增殖、凋亡、侵袭及转移[13,14]。抑制COX-2及PGE2表达后可促进细胞凋亡、抑制血管新生、促进细胞免疫而发挥抗肿瘤作用。研究发现,COX-2抑制剂在一定程度上可预防胃肠道肿瘤及其他肿瘤[15,16]。由于COX-2在肿瘤发生发展过程中的重要作用,COX-2被认为是肿瘤治疗的潜在靶点。本实验结果显示冬凌草甲素能显著降低LoVo细胞COX-2蛋白表达,并抑制PGE2的合成。
此外,NF-κB作为COX-2在炎症反应过程中的上游调控基因,本实验检测了冬凌草甲素对NF-κB/p65表达的影响。Western blot结果提示冬凌草甲素可降低细胞核内p-NF-κB(p65)表达,即冬凌草甲素可抑制LoVo细胞NF-κB的核内移位。
综上所述,冬凌草甲素可降低结肠癌LoVo细胞增殖,并诱导细胞凋亡,其作用机制可能是通过抑制p-NF-κB(p65)转录,下调COX-2表达和PGE2合成。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2] Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3] Ku CM,Lin JY.Anti-inflammatory effects of 27 selected terpenoid compounds tested through modulating Th1/Th2 cytokine secretion profiles using murine primary splenocytes[J].Food Chem,2013,141(2):1104-1113.
[4] 刘俊保,岳静宇,唐引引,等.冬凌草甲素对 EC9706细胞增殖、凋亡的影响[J].郑州大学学报(医学版),2014,49(1):8-11.
[5] 王海艳,朱志兵.冬凌草甲素通过激活ATM蛋白诱导人肝癌HepG2细胞G2/M细胞周期阻滞[J].中国老年学杂志,2014,(15):4271-4273.
[6] 温鹏路,马亮,葛光炬,等.人β防御素-1联合冬凌草甲素对膀胱癌T24细胞生长抑制作用的研究[J].肿瘤学杂志,2014,20(12):1006-1011.
[7] 柳悄然,张在云,于晓明,等.冬凌草甲素对人肺癌NCI-H460细胞侵袭和迁移的影响[J].中国病理生理杂志,2014,30(8):1497-1500.
[8] Baron JA,Sandler RS,Bresalier RS,etal.A randomized trial of rofecoxib for the chemoprevention of colorectal adenomas[J].Gastroenterology,2006,131(6):1674-1682.
[9] Solomon SD,Pfeffer MA,McMurray JJ,etal.Effect of celecoxib on cardiovascular events and blood pressure in two trials for the prevention of colorectal adenomas[J].Circulation,2006,114(10):1028-1035.
[10] Bertagnolli MM,Eagle CJ,Zauber AG,etal.Five-year efficacy and safety analysis of the adenoma prevention with celecoxib trial[J].Cancer Prev Res (Phila),2009,2(4):310-321.
[11] Solomon SD,Wittes J,Finn PV,etal.Cardiovascular risk of celecoxib in 6 randomized placebo-controlled trials: the cross trial safety analysis[J].Circulation,2008,117(16):2104-2113.
[12] Harris RE.Cyclooxygenase-2 (cox-2) blockade in the chemoprevention of cancers of the colon,breast,prostate,and lung[J].Inflammopharmacology,2009,17(2):55-67.
[13] Jana S,Chatterjee K,Ray AK,etal.Regulation of matrix metalloproteinase-2 activity by COX-2-PGE2-pAKT axis promotes angiogenesis in endometriosis[J].PLoS One,2016,11(10):e0163540.
[14] Chell S,Kaidi A,Williams AC,etal.Mediators of PGE2 synthesis and signalling downstream of COX-2 represent potential targets for the prevention/treatment of colorectal cancer[J].Biochim Biophys Acta,2006,1766(1):104-119.
[15] Kim YY,Lee EJ,Kim YK,etal.Anti-cancer effects of celecoxib in head and neck carcinoma[J].Mol Cells,2010,29(2):185-194.
[16] Thompson PA,Ashbeck EL,Roe DJ,etal.Celecoxib for the prevention of colorectal adenomas: results of a suspended randomized controlled trial[J].J Natl Cancer Inst,2016,108(12):djw151.
Oridonin inhibits proliferation of LoVo colorectal cancer cells through inhibiting the expression of NF-κB/COX-2
LIU Na,LI Wenqiang*,GAO Chengwei#
(DepartmentofEmergency,RenminHospitalofWuhanUniversity,Wuhan430060,China;*Correspondingauthor,E-mail:wenqiang67@sohu.com;#Co-correspondingauthor,E-mail:gaochengweihubei@163.com)
ObjectiveTo explore the effect of oridonin on the cell proliferation and apoptosis of LoVo colorectal cancer cells and its possible mechanisms.MethodsLoVo cells were culturedinvitroand treated with different concentrations(0-240 μmol/L) of oridonin for 24,48 and 72 h,respectively,and then the cell activity was determined by MTT assay. After treated with 0,30,60,120 μmol/L oridonin for 48 h, the cell apoptosis rate was detected by flow cytometry, the expression of PGE2 in the culture medium was detected by ELISA, and Bcl-2,Bax,COX-2 and p-NF-κB(p65) protein expression was detected by Western blot.ResultsMTT result showed that the cell proliferation of LoVo cells was inhibited by oridonin in a dose-dependent and time-dependent manner(P<0.05). After treated with 0, 30,60,120 μmol/L oridonin, the cell apoptosis rate of LoVo cells was 8.83%,15.5%,22.64%,and 25.86%,respectively. ELISA result showed that the PGE2 synthesis was inhibited after treated with oridonin. The oridonin promoted the expression of pro-apoptotic factor Bax, and suppressed the expression of anti-apoptotic factor Bcl-2(P<0.05). Western blot showed that oridonin decreased the expression of COX-2 and p-NF-κB,and PEG2 synthesis(P<0.05).ConclusionOridonin could inhibit the cell proliferation and induce cell apoptosis in LoVo cells by inhibition of the expression of p-NF-κB for up-regulating Bax and down-regulating Bcl-2.
oridonin; LoVo cells; cell apoptosis; COX-2; PGE2
刘娜,女,1981-07生,本科,主治医师,E-mail:371264709@qq.com
2016-12-19
R735.35
A
1007-6611(2017)03-0251-05
10.13753/j.issn.1007-6611.2017.03.011

