脂联素及其受体在高血压小鼠血管平滑肌中的表达及其作用机制
郭瑞敏,韩 敏,孙燕妮
(上海中医药大学附属普陀医院急诊内科,上海 200062;*通讯作者,E-mail:sunstone1974@163.com)
脂联素及其受体在高血压小鼠血管平滑肌中的表达及其作用机制
郭瑞敏,韩 敏,孙燕妮*
(上海中医药大学附属普陀医院急诊内科,上海 200062;*通讯作者,E-mail:sunstone1974@163.com)
目的 观察血管原位组织中脂联素(adiponectin,APN)及AdipoR的表达及其在高血压血管损伤中的作用,并分析其可能的机制。 方法 采用免疫印迹检测正常血管平滑肌细胞、内皮细胞及脂肪细胞中APN及AdipoR的表达。采用免疫印迹分别检测血管紧张素Ⅱ(Ang Ⅱ)处理的脂肪细胞中APN的表达及血管平滑肌细胞中AdipoR的表达。成年雄性C57BL/6小鼠分为对照组和Ang Ⅱ诱导血管损伤组,免疫荧光检测血管组织APN及AdipoR的表达。Transwell迁移实验检测APN对血管平滑肌细胞的迁移调控作用。 结果 免疫印迹结果显示,内皮细胞APN表达量较少,脂肪细胞大量表达APN,血管平滑肌细胞未检测到APN的表达。APN受体AdipoR广泛分布于血管各层细胞中。Ang Ⅱ诱导血管损伤后管周脂肪细胞APN的表达降低(11.7%±3.6%vs3.0%±1.5%),同时血管平滑肌细胞及内皮细胞的AdipoR1(13.2%±4.0%vs2.7%±1.6%)和AdipoR2(22.4%±7.1%vs5.7%±1.2%)的表达显著降低,差异具有统计学意义。细胞实验证实Ang Ⅱ抑制脂肪细胞APN以及血管平滑肌细胞AdipoR的表达。利用免疫荧光技术进一步证实了血管原位的APN及AdipoR表达分布与体外研究结果一致。APN重组蛋白抑制Ang Ⅱ诱导的血管平滑肌细胞的迁移以及P38 MAPK信号通路的活化(1.2±0.08vs2.3±0.46),差异具有统计学意义。 结论 本研究证实Ang Ⅱ诱导管周脂肪APN的表达降低以及血管原位AdipoR的降低,参与血管损伤过程的调节。
脂联素; 脂联素受体; 高血压; 血管平滑肌细胞
近年来的研究表明脂肪组织也具有活跃的内分泌功能,可以分泌和释放多种脂肪因子、炎症因子[1,2]。这些细胞因子在体内行使多种功能,在糖代谢、免疫炎性反应及心血管疾病中起重要作用。在诸多脂肪因子中,脂联素(adiponectin,APN)的血浆含量最高。最近研究发现,APN可通过内分泌和/或旁分泌途径进入血管组织,调节平滑肌细胞和内皮细胞的增殖、迁移和凋亡等病理生理过程,在动脉粥样硬化等心血管疾病发生发展过程中发挥着重要调控作用[3,4]。APN存在2种受体,分别命名为APN受体1(AdipoR1)和APN受体2(AdipoR2),其结构相似,均为包含7个跨膜区域的蛋白质,广泛表达于机体各组织中[4,5]。已有的研究证实Ang Ⅱ通过促进VSMCs的迁移参与血管损伤过程的调控[6],但是APN及其受体是否参与这一过程仍不清楚。关于APN及其受体与心肌缺血、糖尿病等的发生发展已有较多文献报道,然而关于APN及其受体是否参与高血压血管损伤过程目前还不清楚。本研究通过建立血管紧张素Ⅱ诱导的高血压模型,检测APN及其受体在血管组织的表达分布,并探讨APN对血管细胞生物学功能的调控作用。
1 材料与方法
1.1 主要试剂
APN羊多克隆抗体(R&D公司,美国);AdipoR1和AdipoR2羊多克隆抗体(Abcam公司,英国);β-actin鼠单克隆抗体(Sigma公司,美国);磷酸化p38(p-p38)和总p38(t-p38)抗体(Cell Signaling Technology公司,美国);Transwell 细胞迁移板(Corning公司,美国),胎牛血清及DMEM细胞培养液(HyClone公司,美国)。
1.2 动物模型制备
成年雄性C57BL/6小鼠,体重(25±2)g,上海斯莱克实验动物中心提供,动物生产许可证号:SCXK(沪)2012-0002,动物使用许可证号:SYXK(沪)2011-0113。12只小鼠随机分为对照组(n=6),Ang Ⅱ植入式胶囊渗透压泵灌注损伤组[1 mg/(kg·min),14 d,n=6]。造模方法:将动物腹腔注射水合氯醛(0.3 g/kg)麻醉,背部肩胛骨处切口,植入AngⅡ渗透压泵,缝合皮肤。对照小鼠的基本操作方法与上述相同,但植入PBS泵。
1.3 小鼠血管组织病理学检测
模型制备14 d后,水合氯醛(0.3 g/kg)麻醉,处死小鼠,取胸主动脉,用PBS缓冲液冲洗残余的血液,用4%多聚甲醛固定,石蜡切片,HE染色,显微镜下观察血管结构。冰冻切片免疫荧光染色:按上述方法取材,固定,OCT冰冻包埋剂包埋。将冰冻切片破膜封闭固定后,分别滴加20 μl一抗(APN,Adipo R1,AdipoR2 1 ∶100稀释)将标本覆盖,室温孵育2 h后加二抗(1 ∶200),室温孵育1 h,4’,6-diamidino-2-phenylindole(DAPI)染细胞核20 min,室温,封片,Zeiss荧光显微镜检测蛋白表达。
1.4 细胞培养
小鼠血管平滑肌细胞(vascular smooth muscle cell,VSMC)培养:取正常小鼠胸主动脉置于含200 U/ml Ⅱ型胶原酶的DMEM中,37 ℃孵育10 min,镊子小心剥离外膜。175 U/ml Ⅱ型胶原酶和4 U/ml Ⅰ型弹性蛋白酶37 ℃消化中膜30-45 min。待中膜平滑肌消化后,200×g离心5 min,重悬于2 ml含20% FBS的DMEM中培养。实验均使用90%融合的第4-6代VSMC,待静止24 h后,使用Ang Ⅱ处理0,6,12,24 h,对照组不做任何处理等待0,6,12,24 h收集。为检测APN的保护作用,VSMCs使用APN预处理1 h后,再加Ang Ⅱ刺激。
3T3-L1脂肪细胞培养:3T3-L1前体细胞生长融合后,换培养液继续培养48 h,换成分化液A(10%FBS-DMEM,IBMX 0.5 mmol/L,地塞米松1 μmol/L,胰岛素10 μg/ml)继续培养细胞48 h,换成分化液B(10%FBS-DMEM,胰岛素10 μg/ml),继续培养细胞48 h,换成新鲜培养液继续培养细胞48 h,即可得到成熟的脂肪细胞C,待静止24 h后,使用Ang Ⅱ处理0,6,12,24 h,对照组不做任何处理等待0,6,12,24 h收集。
1.5 Western blot检测APN及AdipoR蛋白表达
培养细胞加入细胞裂解液,冰浴20 min,4 ℃ 12 000 r/min离心15 min,测定蛋白浓度。取各组细胞蛋白10 g经含SDS-PAGE电泳分离,转移至硝酸纤维素膜上,5%脱脂牛乳封闭1 h,加入一抗(1 ∶1 000)室温孵育2 h,用HRP标记的二抗室温孵育2 h,洗膜后经ECL显色,暗室曝光。
1.6 Transwell细胞迁移实验
取适量血管平滑肌细胞,完全吸尽上清,加入DMEM,细胞密度为106/ml,吹打均匀。细胞悬液分为4组,分别为对照组,Ang Ⅱ组,Ang Ⅱ加APN(1 μg/ml),Ang Ⅱ加APN(10 μg/ml)。Transwell下室加入600 ml DMEM和Ang Ⅱ及APN,将上述细胞悬液接种到Transwell上室中(200 ml/小室)放入37 ℃孵箱培养6 h,然后从孵箱中取出Transwell,将上室取出用棉签轻轻搽拭上室内侧壁,PBS洗3遍冰乙醇固定4 ℃ 15 min,PBS洗3遍,每次5 min,苏木素染色室温下5 min,水洗伊红A和B分别染色,室温下5 min,水洗,放置显微镜下观察,随机选取5个视野(×200),细胞计数取其平均数。
1.7 统计学分析
采用SPSS13.0软件进行统计学分析,数据以均数±标准差表示,多组间比较采用方差分析,两组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 APN及其受体在血管细胞的表达
蛋白免疫印迹结果显示:APN在内皮细胞表达相对较少,主要表达于脂肪细胞(adipocyte),在血管平滑肌细胞很少表达;而脂联素受体Adipo R1和Adipo R2在脂肪细胞,平滑肌细胞和内皮细胞都有表达(见图1)。

图1 脂联素(APN)及其受体(AdipoR1、AdipoR2)在胸主动脉血管细胞的表达Figure 1 Expression of APN and APN receptors in the vascular cells and adipocytes from thoracic aorta
2.2 APN及其受体在高血压血管组织的表达分布
与对照组相比,损伤组(Ang Ⅱ灌注制备高血压小鼠模型)苏木素-伊红(HE)染色显示胸主动脉血管壁显著增厚,尤以中膜平滑肌为主。组织免疫荧光染色显示APN主要表达于管周脂肪细胞,损伤组小鼠管周脂肪组织脂联素表达与对照组相比显著减少(3.0%±1.5%vs11.7%±3.6%,见图2A)。与细胞蛋白表达结果相似,APN受体Adipo R1和Adipo R2广泛表达于血管壁各层组织,包括内皮细胞、平滑肌细胞、管周脂肪细胞,并且与对照组相比,损伤组小鼠血管壁Adipo R1(13.2%±4.0%vs2.7%±1.6%)和Adipo R2(22.4%±7.1%vs5.7%±1.2%)表达显著减少(见图2B,C)。
2.3 AngⅡ抑制脂肪细胞APN表达
体外培养3T3-L1脂肪细胞,AngⅡ(100 nmol/L)刺激呈时间依赖性抑制APN在脂肪细胞的表达,减少55%±10.6%(见图3),培养24 h表达最少,差异具有统计学意义(P<0.05)。正常对照脂肪细胞在静止状态下不加Ang Ⅱ刺激,24 h内APN表达无显著差异。

蓝色为DAPI染色,显示细胞核;损伤组表示血管紧张素Ⅱ(AngⅡ)灌注高血压模型小鼠,对照组表示正常对照;与对照组比较,*P<0.05图2 脂联素(APN)及其受体(AdipoR)在胸主动脉血管原位的表达Figure 2 APN and APN receptors expression and distribution in the vasculature of Ang Ⅱ-induced vascular injury mice
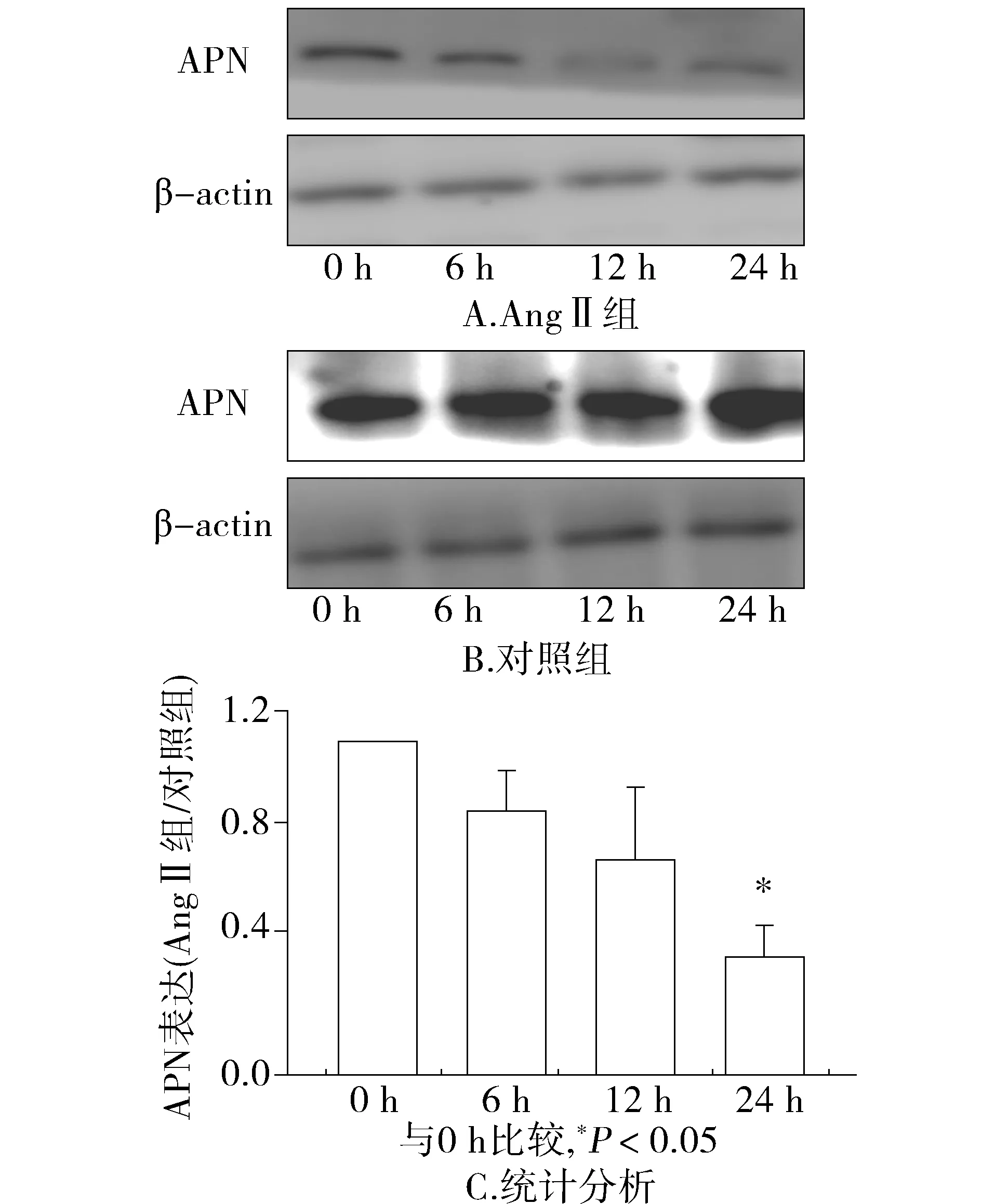
图3 血管紧张素Ⅱ抑制脂肪细胞脂联素(APN)的表达Figure 3 Ang Ⅱ inhibits APN expression in the adipocytes
2.4 AngⅡ抑制血管平滑肌细胞APN受体表达
体外培养AngⅡ刺激原代培养的血管平滑肌细胞(VSMCs),呈时间依赖性抑制AdipoR1(减少54%±6.1%)和Adipo R2(减少53%±5.3%)的表达(见图4),培养24后表达最少,差异具有统计学意义(P<0.05)。正常对照VSMCs在静止状态下不加Ang Ⅱ刺激,AdipoR的表达无显著差异。
2.5 APN抑制AngⅡ诱导的血管平滑肌细胞迁移
利用APN预处理VSMCs后,再给予AngⅡ刺激,结果显示APN(10 mg/ml)预处理能显著抑制AngⅡ诱导的VSMCs的迁移(1.83±0.46vs5.58±0.58),差异具有统计学意义(P<0.05,见图5)。
2.6 APN通过MAPK通路抑制AngⅡ诱导的血管平滑肌细胞迁移
MAPK通路p38激酶的蛋白免疫印迹结果显示APN可以抑制AngⅡ诱导的p38激酶磷酸化(1.2±0.08vs2.3±0.46),差异具有统计学意义(P<0.05,见图6)。

图4 血管紧张素Ⅱ抑制血管平滑肌细胞AdipoR1和AdipoR2的表达Figure 4 Ang Ⅱ inhibits APN receptors expression in the VSMCs
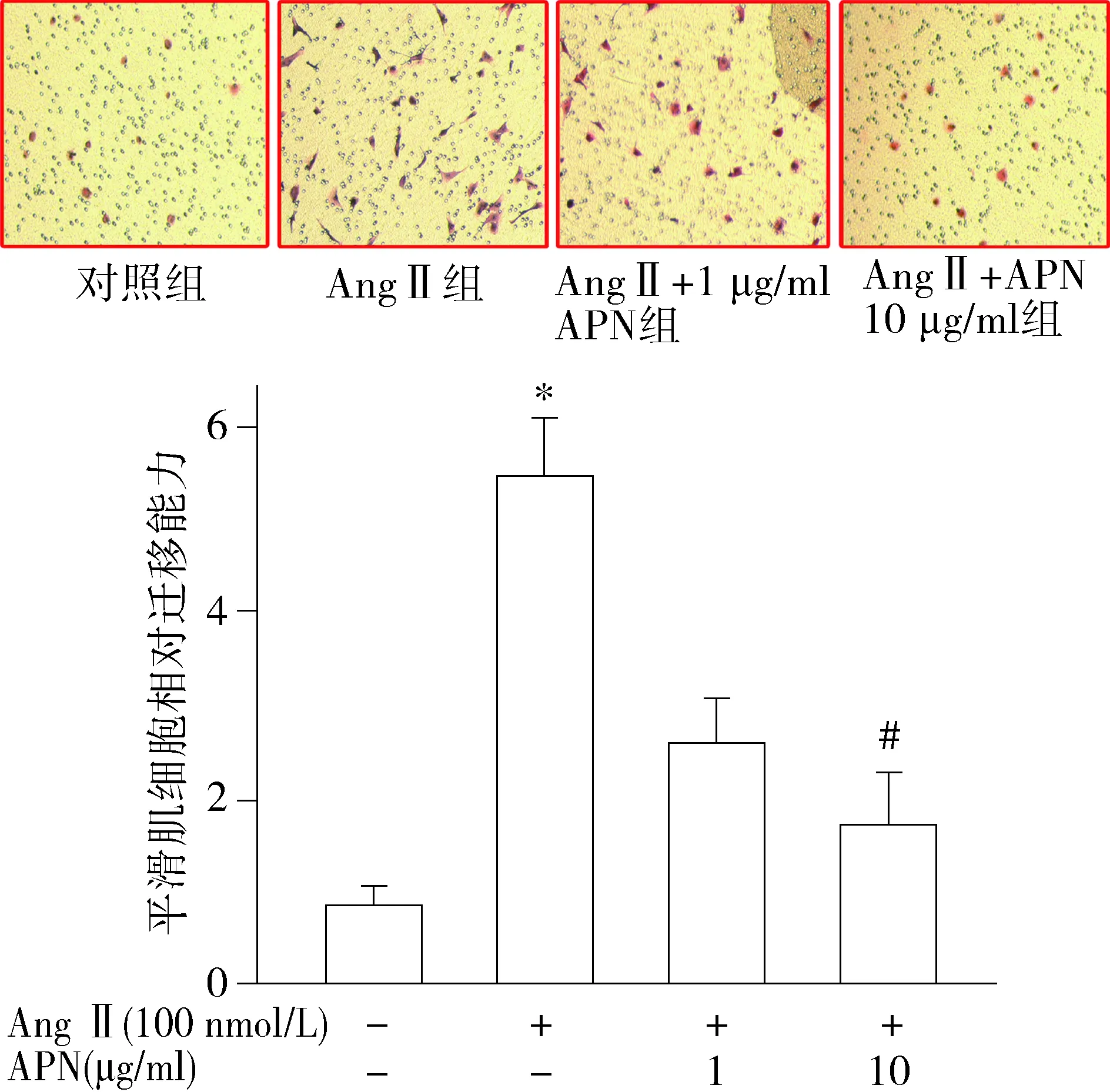
与正常对照组比较,*P<0.05;与AngⅡ组比较,#P<0.05图5 脂联素(APN)抑制血管紧张素Ⅱ(AngⅡ)诱导的血管平滑肌细胞的迁移Figure 5 APN inhibits Ang Ⅱ-induced VSMCs migration

与正常对照组比较,*P<0.05;与AngⅡ组比较,#P<0.05图6 脂联素(APN)抑制血管紧张素Ⅱ(Ang Ⅱ)诱导的血管平滑肌细胞p38 MAPK激酶的磷酸化Figure 6 APN inhibits Ang Ⅱ-induced p38 phosphorylation(p-p38)in the VSMCs
3 讨论
本研究通过建立AngⅡ诱导的高血压动物模型,观察了APN及其受体在血管组织的分布,结果显示APN主要表达于血管外周脂肪细胞,而其受体Adipo R1和Adipo R2则主要分布于血管组织,尤其在中膜平滑肌。在AngⅡ诱导的高血压动物模型,其血管周脂肪APN表达显著减少,同时体外培养的脂肪细胞证实Ang Ⅱ呈时间依赖性的抑制APN的表达。APN是由约240个氨基酸组成的分泌蛋白,分子量约30 kD,包含4个结构域,从N端到C端分别是20残基信号序列、N端非同源序列、胶原样结构域和C端球状结构域。APN作为一种重要的抗炎性的脂肪因子,近年来其在代谢、血管损伤等方面的保护作用已逐渐被人们所认知[7,8]。APN通过活化AMPK通路,促进内皮细胞eNOS的表达,增加NO的释放,并诱导内皮细胞的增殖,进而参与急性血管损伤的修复过程。同时APN可以抑制碱性成纤维细胞生长因子(bFGF)诱导的VSMC的增殖和迁移作用,从而抑制血管损伤过程中新生内膜的形成[7,9]。本研究发现在高血压慢性血管损伤模型中发现高血压引起血管周围脂肪APN的表达降低,并且RAS系统的激活抑制脂肪细胞APN的表达。已有研究证实VSMCs迁移能力的改变是血管重塑过程的重要生物学基础,多种血管活性物质包括Ang Ⅱ都能刺激VSMCs的迁移,其中MAPK信号通路的活化起着关键的调控作用[10]。本研究提示APN能抑制Ang Ⅱ诱导的VSMCs的迁移及MAPK家族关键成员p38激酶的活化。这些结果提示RAS系统激活除直接作用于心血管系统外,可能也通过调控脂肪细胞脂肪因子APN的表达,进而抑制VSMCs活化迁移,减轻高血压血管损伤。
脂联素主要通过自身受体发挥生物学调控作用,目前已知受体为AdipoR1和AdipoR2,这两种受体广泛分布于全身各个器官和组织。脂联素受体不同于GPCR受体家族,其属于PAQR受体家族,N端位于胞内,而C端位于胞外,介导APN的生物学作用。尽管在各组织都有广泛表达,但是AdipoR1和AdipoR2还是存在组织间的差异性,如AdipoR1主要表达于骨骼肌组织,AdipoR2主要表达于肝脏中[11,12]。本研究对血管组织中的AdipoR的分布进行了观察,结果提示AdipoR1和AdipoR2广泛表达于管周脂肪细胞、血管平滑肌细胞以及内皮细胞中。已有研究表明在代谢性疾病模型中,脂肪细胞AdipoR表达会显著降低;与之相反,在慢性肾脏病疾病动物模型中,肾脏组织原位AdipoR表达显著增加[13],提示在不同的疾病模型中,AdipoR的变化存在一定差异。本研究在高血压动物模型中发现,血管组织的AdipoR的表达显著降低,在体外培养的主动脉原代平滑肌细胞也发现Ang Ⅱ刺激能抑制VSMC的AdipoR表达。
综上所述,本研究表明在Ang Ⅱ诱导的高血压动物模型,管周脂肪细胞APN表达以及血管各层组织中AdipoR的表达均明显降低,外源性APN可以抑制AngⅡ引起的p38 MAPK信号通路的活化,并抑制血管平滑肌细胞的迁移,证实p38信号通路可能是APN的作用靶点。这些结果提示APN及其受体可能作为潜在的干预靶点为防治高血压血管损伤提供新的治疗思路。
[1] Thalmann S,Meier CA.Local adipose tissue depots as cardiovascular risk factors[J].Cardiovasc Res,2007,75(4):690-701.
[2] Molica F,Morel S,Kwak BR,etal.Adipokines at the crossroad between obesity and cardiovascular disease[J].Thromb Haemost,2015,113(3):553-566.
[3] Li FY,Cheng KK,Lam KS,etal.Cross-talk between adipose tissue and vasculature:role of adiponectin[J].Acta Physiol(Oxf),2011,203(1):167-180.
[4] Wang ZV,Scherer PE.Adiponectin,the past two decades[J].J Mol Cell Biol,2016,8(2):93-100.
[5] Yamauchi T,Kamon J,Ito Y,etal.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423(6941):762-769.
[6] Montezano AC,Nguyen Dinh Cat A,Rios FJ,etal.Angiotensin II and vascular injury[J].Curr Hypertens Rep,2014,16(6):431.
[7] Lee S,Kwak HB.Role of adiponectin in metabolic and cardiovascular disease[J].J Exerc Rehabil,2014,10(2):54-59.
[8] Chakraborti CK.Role of adiponectin and some other factors linking type 2 diabetes mellitus and obesity[J].World J Diabetes,2015,6(15):296-1308.
[9] Freitas Lima LC,Braga VA,do Socorro de Franca Silva M,etal.Adipokines,diabetes and atherosclerosis:an inflammatory association[J].Front Physiol,2015,6:304.
[10] Ndisang JF,Jadhav A.Heme arginate therapy enhanced adiponectin and atrial natriuretic peptide,but abated endothelin-1 with attenuation of kidney histopathological lesions in mineralocorticoid-induced hypertension[J].J Pharmacol Exp Ther,2010,334(1):87-98.
[11] Yamauchi T,Kadowaki T.Adiponectin receptor as a key player in healthy longevity and obesity-related diseases[J].Cell Metab,2013,17(2):185-196.
[12] Lustig Y,Hemi R,Kanety H.Regulation and function of adiponectin receptors in skeletal muscle[J].Vitam Horm,2012,90:95-123.
[13] Yu Y,Bao BJ,Fan YP,etal.Changes of adiponectin and its receptors in rats following chronic renal failure[J].Ren Fail,2014,36(1):92-97.
Expression and its mechanism of adiponectin and its receptors in the vacular smooth muscle of hypertension mice
GUO Ruimin,HAN Min,SUN Yanni*
(DepartmentofEmergencyMedicine,PutuoHospitalAffiliatedToShanghaiTraditionalChineseMedicineUniversity,Shanghai200062,China;*Correspondingauthor,E-mail:sunstone1974@163.com)
ObjectiveTo explore the role of APN and APN receptor expression in the hypertensive vascular injury and its possible
adiponectin; adiponectin receptors; hypertension; vascular smooth muscle cells
上海中医药大学预算内项目(2016YSN59)
郭瑞敏,女,1977-05生,硕士,主治医师,E-mail:guoruimin13597632359@126.com
2016-12-23
R544.1
A
1007-6611(2017)03-0205-06
10.13753/j.issn.1007-6611.2017.03.002

