hsa-miR-381过表达慢病毒载体的构建、转染和表达
周苏娜,叶文广,崔耀友,梁军#,张明鑫*
(1第四军医大学唐都医院放疗科,西安 710061;2第四军医大学肿瘤研究所;3第四军医大学唐都医院消化内科;*通讯作者,E-mail:zmx3115@163.com;#共同通讯作者,E-mail:liangjtangdu@163.com)
hsa-miR-381过表达慢病毒载体的构建、转染和表达
周苏娜1,2,叶文广2,崔耀友1,梁军1#,张明鑫2*
(1第四军医大学唐都医院放疗科,西安 710061;2第四军医大学肿瘤研究所;3第四军医大学唐都医院消化内科;*通讯作者,E-mail:zmx3115@163.com;#共同通讯作者,E-mail:liangjtangdu@163.com)
目的 构建hsa-miR-381过表达慢病毒载体病毒载体,并对其在食管鳞癌TE10细胞中miR-381表达调节效果进行鉴定。 方法 利用PCR法扩增miR-381基因序列,将目的基因miR-381克隆到携带Green&Puro的慢病毒载体LV3中,经双酶切及测序鉴定后大量抽提;利用脂质体将含目的基因的重组质粒和包装质粒pGag/Pol、pRev、pVSV-G共转染293T细胞;用得到的慢病毒转染TE10细胞,通过荧光显微镜观察转染状况,实时荧光定量PCR分析转染前后miR-381的表达。 结果 酶切与测序结果证明成功构建重组质粒,并成功包装成慢病毒,实验组病毒滴度为2×108TU/ml,空白阴性对照组病毒滴度为2×108TU/ml。TE10细胞转染过表达慢病毒后miR-381的表达升高,TE10-381组has-miR-381的表达丰度是TE10组的456.05倍。 结论 LV3-hsa-miR-381慢病毒载体构建成功,并能明显增加TE10细胞中miR-381的表达量。
miR-381; 慢病毒载体; 食管鳞癌; 基因转染
食管癌的发病率和致死率在常见肿瘤中分别占第八和第六位,其中食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)在东亚地区占主要地位,约50%的ESCC病例发生在中国[1]。研究发现microRNAs(miRNAs)在恶性肿瘤的发生发展过程中发挥重要作用[2]。近年来研究发现,miR-381在多种肿瘤中如肝癌、卵巢癌、结直肠癌中发挥抑癌基因的功能,可以通过抑制肝受体同系物-1(liver receptor homolog 1,LRH-1)、转录因子Yin Yang 1(YY1)、Twist家族碱性螺旋-环-螺旋转录因子1(Twist1),发挥抑制细胞增殖、侵袭、迁移等抗肿瘤的作用[3-6]。研究miR-381在ESCC中的表达和作用,有助于对ESCC的深入了解,为其检测、治疗、预防等提供依据。本实验构建has-miR-381过表达慢病毒载体(LV3-hsa-miR-381),通过荧光显微镜、实时荧光定量PCR(real-time quantitative PCR,qPCR)验测TE-10细胞的转染效率,为研究miR-381在ESCC中的调控作用奠定基础。
1 材料与方法
1.1 细胞系
食管鳞癌细胞株TE10、人胚肾上皮细胞株293T购于中国科学院上海细胞库。
1.2 载体和主要试剂
混合包装载体质粒(pGag/Pol、pRev、pVSV-G)和慢病毒载体pGLV3/H1/GFP+Puro载体(LV3)购自上海吉玛制药技术有限公司;大肠杆菌菌株DH5α为西安交通大学医学院中心实验室保存;DMEM、胎牛血清、胰酶Trypsin-EDTA Solution和链霉素(10 000 μg/ml)/青霉素(10 000 U/ml)购自美国GIBCO公司;质粒抽提试剂盒购自日本Takara公司;BamHⅠ、EcoRⅠ内切酶、T4 DNA连接酶、Marker购自加拿大Fermentas公司;琼脂糖、DNA凝胶回收试剂盒、Taq聚合酶购自北京天根生化科技有限公司;PrimeScript RT试剂盒、SYBR酶购自美国ABI公司;Lipofectamine 2000、Trizol购自美国Invitrogen公司;LB培养基购自美国ATCC公司。
1.3 细胞分组
根据后期实验转染情况,分为TE10组(空白TE10细胞)、TE10-NC组(转染阴性LV3-NC病毒)、TE10-381组(转染过表达LV3-hsa-miR-381病毒)。
1.4 hsa-miR-381的基因扩增
根据GeneBank提供的hsa-miR-381基因组序列的信息数据,设计has-mir-381上游引物:GCGAGGTTGCCCTTTGTA;hsa-miR-381下游引物:CACTTCCTCAGCACTTGTTGGTAT。目的基因上下游引物分别加上BamHⅠ和EcoRⅠ及保护碱基,用于慢病毒载体的亚克隆。引物由上海吉玛基因技术有限公司合成,按照PCR试剂盒操作说明提取TE10细胞miR-381的互补DNA(complementary deoxyribonucleic acid,cDNA)、以得到的cDNA为模板进行目的基因的大量扩增。扩增条件:95 ℃预变性3 min,95 ℃ 30 s、62 ℃ 40 s、72 ℃ 30 s,循环40次。PCR产物经聚丙烯酰胺凝胶电泳,切胶回收基因片段。
1.5 LV3-hsa-miR-381重组质粒的构建、转化、筛选和鉴定
将扩增的has-miR-381基因片段及载体质粒LV3在37 ℃下用BamHⅠ和EcoRⅠ进行双酶切2 h,酶切完成后按照凝胶回收试剂盒进行胶回收。二者在T4连接酶的作用下,16 ℃过夜连接。将连接产物转化感受态细胞,挑取单菌落,摇菌,提取质粒,将抽提好的质粒用BamHⅠ、EcoRⅠ限制性内切酶进行双酶切并鉴定。取测序正确后的克隆,摇菌扩大培养,用除内毒素大提试剂盒大量抽提阳性重组质粒。
1.6 慢病毒的包装
在转染前24 h,取在10 cm培养皿中培养至80%-90%融合时的293T细胞,接种至15 cm培养皿。转染前2 h将培养基更换为无血清的新鲜培养基。利用脂质体将含目的基因的重组质粒(LV3-hsa-miR-381)和包装质粒pGag/Pol、pRev、pVSV-G共转染293T细胞(构建实验组慢病毒),同时利用脂质体将不含目的基因的质粒(LV3-NC)和包装质粒pGag/Pol、pRev、pVSV-G共转染293T细胞(构建阴性对照组慢病毒),在在37 ℃、5% CO2培养箱中温育4-6 h,更换为含10%FBS的DMEM培养液。37 ℃、5% CO2继续培养72 h。包装后产生过表达hsa-miR-381的慢病毒(LV3-hsa-miR-381)和空白阴性对照慢病毒(LV3-NC)。
1.7 慢病毒的收获、浓缩
将上述培养72 h的293T细胞上清液收集到50 ml离心管中,于4 ℃,4 000 r/min离心4 min;将离心管上清液倒入50 ml 注射器内,用0.45 um过滤器过滤。滤液于4 ℃,20 000 r/min离心2 h。将浓缩液收集分装,-80 ℃保存。
1.8 慢病毒滴度的测定
用培养基将指数生长期的239T细胞制备成单细胞悬液,按3×104个/孔接种至96孔板中,混匀后于37 ℃ 5% CO2培养24 h。将慢病毒原液10 μl,用10% FBS的DMEM 培液10倍稀释4个梯度。吸去96孔板中的培养液,每孔加入100 μl稀释的病毒液,同时设立空白对照组,于37 ℃、5% CO2培养24 h。吸弃96孔板中的稀释病毒液,每孔加入100 μl 10% FBS的DMEM培液,于37 ℃ 5% CO2继续培养72 h。通过荧光显微镜计数荧光细胞,结合稀释倍数计算病毒滴度,计算病毒滴度(病毒滴度=荧光细胞数/病毒原液量),病毒LV3-hsa-miR-381b和LV3-NC的滴度分别为2×108TU/ml和2×108TU/ml。
1.9 慢病毒转染ESCC TE10细胞
将对数生长期的TE10细胞,按1×106个/孔接种至6孔板中,于37 ℃、5% CO2培养箱中培养24 h,细胞长至密度约为40%时侵染病毒。将侵染TE10细胞的慢病毒原液用10% FBS的1640培养液按梯度1 ∶10稀释3个梯度,加入终浓度为5 μg/ml的聚凝胶以增加转染率。吸去6孔板中的原培养液,加入上述稀释的病毒液,同时设立空白对照组。培养24 h更换成正常培养基,继续培养72 h,倒置荧光显微镜观察绿色荧光表达并拍照。
1.10 实时qPCR检测TE10细胞miR-381的表达水平
严格按照产品说明书进行实时qPCR检测转染后的TE10组、TE10-NC组和TE10-381组细胞中miR-381的表达水平。细胞中加入1 ml Trizol,按说明提取细胞总RNA并测定其纯度和浓度。按照PrimeScript RT试剂盒的操作说明,以RNA为模板通过逆转录合成cDNA。在SYBR酶的作用下进行PCR反应。实时qPCR循环95 ℃变性3 min,95 ℃ 30 s、62 ℃ 40 s、72 ℃ 30 s,循环40次。
1.11 统计学分析
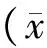
2 结果
2.1 hsa-miR-381的PCR扩增产物
凝胶电泳分析显示:PCR扩增的特异性条带在113 bp左右,与Genebank发布的结果相符(见图1)。
2.2 重组质粒LV3-hsa-miR-381的鉴定
挑取1个阳性克隆进行扩增和抽提质粒,用BamHⅠ和EcoR Ⅰ对阳性克隆的重组质粒进行双酶切,电泳后得到的阳性克隆条带见图2。表明质粒所在8 000 bp大小的为阳性重组质粒LV3-hsa-miR-381。

1-4.PCR产物;5.空白对照;6.Marker图1 琼脂糖凝胶电泳分析hsa-miR-381的PCR扩增产物Figure 1 Analysis of PCR-amplified products of hsa-miR-381 by agarose gel electrophoresis
1.pGLV3/H1/GFP+Puro质粒(LV3);2.LV3-hsa-miR-381重组质粒Bam HⅠ和EcoR Ⅰ双酶切;3.Fermentas SM0331GeneRuler DNA Ladder Mix图2 重组质粒LV3-hsa-miR-381电泳后得到的阳性克隆条带鉴定结果Figure 2 Identification of the positive clones of recombinant plasmid LV3-hsa-miR-381 after electrophoresis
2.3 DNA测序鉴定
过表达载体LV3-hsa-miR-381阳性克隆测序结果见图3,4,通过Blast证实其基因序列与miR-381序列匹配,表明miR-381的基因正确地插入到了载体LV3中。

红字斜体显示为插入的has-miR-381前体序列图3 LV3-hsa-miR-381过表达载体阳性克隆测序结果Figure 3 The sequencing of LV3-hsa-miR-381-overexpressed vector

测序波峰图显示has-miR-381前体序列正确插入质粒图4 LV3-hsa-miR-381过表达载体阳性克隆测序波峰图Figure 4 DNA sequencing of LV3-hsa-miR-381-overexpressed vector
2.4 各组细胞转染结果
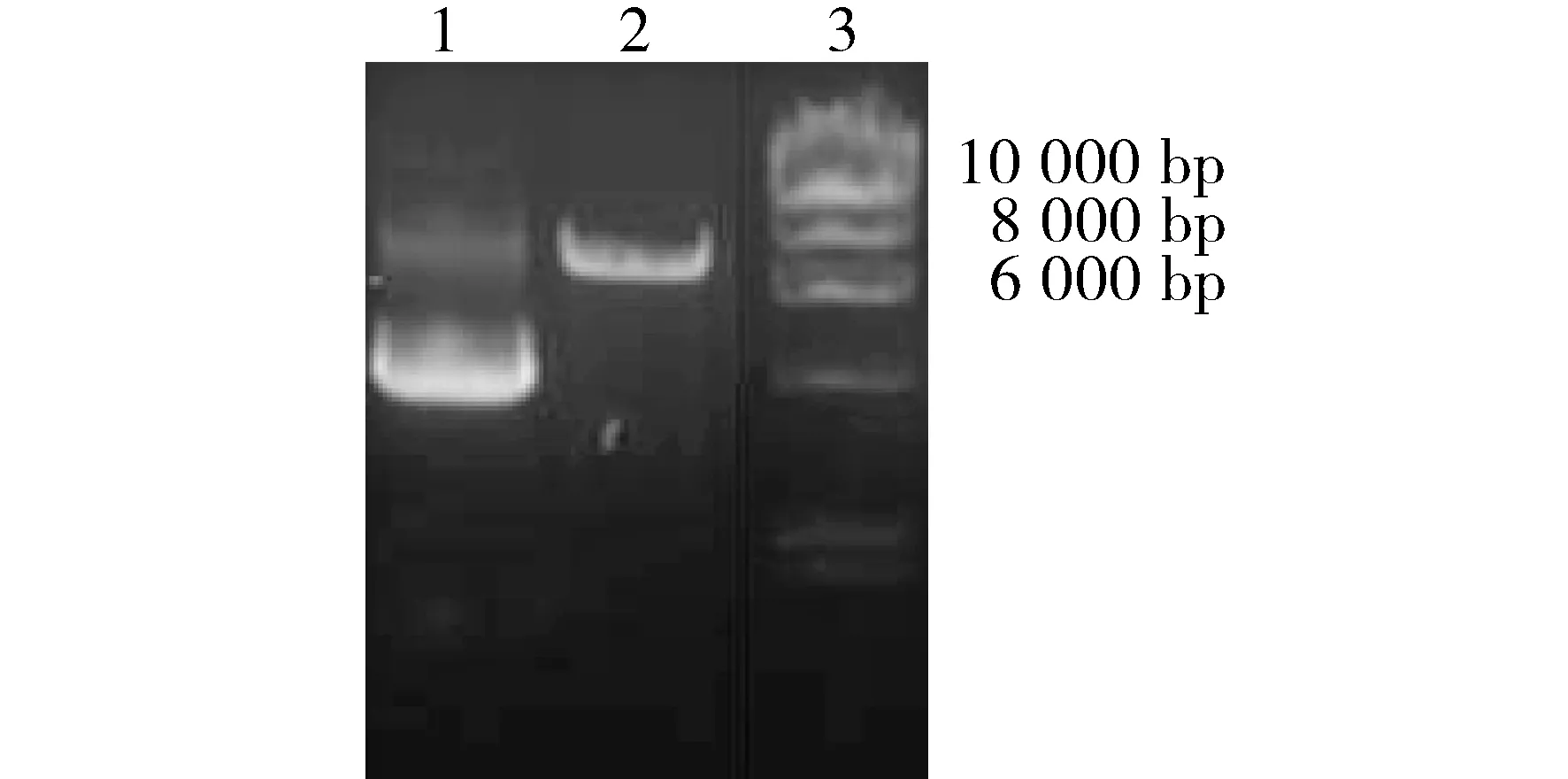
TE10-381组感染过表达LV3-hsa-mir-381病毒,TE10-NC组感染空白阴性对照慢病毒LV3-NC,病毒感染96 h后进行荧光拍照。各组细胞荧光拍照结果见图5,可见病毒感染成功。
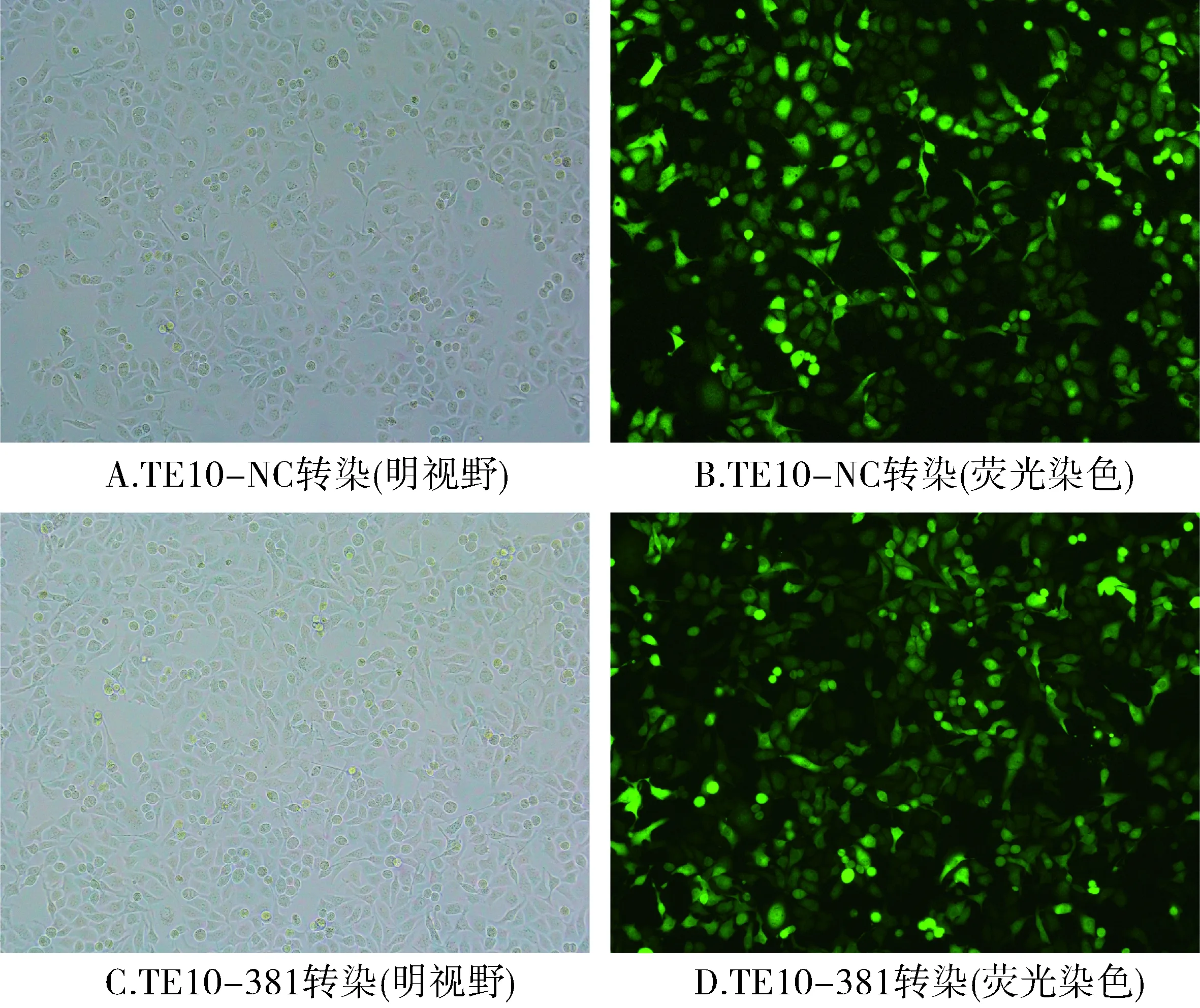
图5 稳转细胞株转染后荧光蛋白表达情况 (×100)Figure 5 Expression of green fluorescent protein in stable transgenic cell line after transfection (×100)
2.5 PCR 验证TE10细胞中转染LV3-hsa-miR-381过表达病毒效率的结果
以U6为内参,TE10组为基准,校正计算各组2-ΔΔCt值。TE10组为1.00±0.47,TE10-NC组为2.95±1.26,TE10-381组为456.05±96.64。上述结果显示TE10-381组细胞与TE10组、TE10-NC组细胞相比,miR-381的含量明显升高,TE10-381组has-miR-381的表达丰度是TE10组的456.05倍,差异具有统计学意义(P<0.05,见图6)。
与其他两组比较,*P<0.05图6 实时qPCR检测各组细胞中miR-381表达结果Figure 6 qRT-PCR expression of miR-381 in cells by real-time qPCR
3 讨论
miRNA作为一类非编码单链小分子RNA,参与调控细胞增殖和凋亡等生物学行为相关的基因表达,且研究证实许多miRNA与肿瘤的发展、侵袭、转移等恶性生物学行为及肿瘤耐药相关[7]。近年来关于miRNA的功能研究越来越多。随着miRNA研究的逐渐深入,发现miR-381在肿瘤和正常组织中呈差异性表达,且在肿瘤的发生发展过程中扮演着重要角色。miR-381在肺腺癌中表达下调,靶向调控分化抑制蛋白1(inhibitor of differentiation 1,ID1)影响细胞迁移和侵袭[8]。结肠癌组织中miR-381的表达明显下降,其发挥抑癌基因的功能,调控肿瘤的增殖、侵袭、迁移及上皮细胞间质转型(epithelial-mesenchymal transitions,EMT)能力[4,6,9]。课题组的前期研究发现miR-381的表达下调和食管鳞癌细胞株的恶性表型如增殖、侵袭能力增加,放疗抵抗增加相关[10]。正是由于miR-381在消化道组织中的表达特异性,提示miR-381在食管癌的发展过程中发挥抑制肿瘤的作用。
常用的慢病毒载体是在人类免疫缺陷病毒1型基础上修饰改造而得到的一种多用途、安全的转基因载体[11]。慢病毒可以高效地感染内皮细胞、肿瘤细胞等多种类型的细胞,将需要的目的基因重组到慢病毒载体,然后通过重组载体转染靶细胞,可以实现目的基因在宿主细胞的持久表达。相对于非病毒载体,病毒载体具有如下优势[12]:①慢病毒载体可转染有丝分裂期包括分裂终末期的细胞;②维持目的基因在靶细胞中长期而稳定的表达;③实现从时间性、空间性的精确调控目的基因的表达;④实现功能相关的数个基金的共表达;⑤免疫反应小,安全性高。
为进一步阐明mir-381在调控食管癌的发生与发展中的可能分子机制,本研究选择应用重组慢病毒载体技术构建了能够稳定而持久过表达外源mir-381的重组质粒,经PCR扩增测序,显示其基因序列与miR-381序列匹配,说明miR-381的基因正确地插入到了载体中;重组过表达慢病毒转染食管鳞癌TE10细胞,通过荧光显微镜观察荧光蛋白的表达情况,看到重组的过表达慢病毒质粒能够高效的感染目的细胞;通过实时qPCR检测发现转染后的TE10细胞中miR-381的表达显著升高,为研究miR-381对ESCC发生发展中的相关信号通路以及生物学功能的作用机制奠定了基础。
[1] Siegel R,Naishadham D,Jemal A.Global cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2] Nana-Sinkam SP,Croce CM.Clinical applications for microRNAs in cancer[J].Clin Pharmacol Ther,2013,93(1):98-104.
[3] Zhang Q,Zhao S,Pang X,etal.MicroRNA-381 suppresses cell growth and invasion by targeting the liver receptor homolog-1 in hepatocellular carcinoma[J].Oncol Rep,2016,35(3):1831-1840.
[4] Liang Y,Zhao Q,Fan L,etal.Down-regulation of MicroRNA-381 promotes cell proliferation and invasion in colon cancer through up-regulation of LRH-1[J].Biomed Pharmacother,2015,75:137-141.
[5] Xia B,Li H,Yang S,etal.MiR-381 inhibits epithelial ovarian cancer malignancy via YY1 suppression[J].Tumour Biol,2016,37(7):9157-9167.
[6] He X,Wei Y,Wang Y,etal.MiR-381 functions as a tumor suppressor in colorectal cancer by targeting Twist1[J].Onco Targets Ther,2016,9:1231-1239.
[7] Wang XC,Zhang ZB,Wang YY,etal.Increased miRNA-22 expression sensitizes esophageal squamous cell carcinoma to irradiation[J].J Radiat Res,2013,54(3):401-408.
[8] Rothschild SI,Tschan MP,Jaggi R,etal.MicroRNA-381 represses ID1 and is deregulated in lung adenocarcinoma[J].J Thorac Oncol,2012,7(7):1069-1077.
[9] 尹慧,王伟,张强,等.MicroRNA-381的表达下降促进结肠癌的增殖与侵袭[J].西南国防医药,2016,26(7):697-700.
[10] Zhou S,Ye W,Ren J,etal.MicroRNA-381 increases radiosensitivity in esophageal squamous cell carcinoma[J].Am J Cancer Res,2015,5(1):267-277.
[11] Zufferey R,Dull T,Mandel RJ,etal.Self-inactivating lentivirus vector for safe and efficientinvivogene delivery[J].J Viral,1998,72(12):9873-9880.
[12] Mátrai J,Chuah MK,Vanden Driessche T.Recent advances in lentiviral vector development and applications[J].Mol Ther,2010,18(3):477-490.
Construction,transfection and expression of hsa-miR-381 over-expressed lentivirus vector
ZHOU Suna1,2,YE Wenguang2,CUI Yaoyou1,LIANG Jun1#,ZHANG Mingxin2*
(1DepartmentofRadiotherapy,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710061,China;2TumorInstitute,FourthMilitaryMedicalUniversity;3DepartmentofGastroenterology,TangduHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:zmx3115@163.com;#Co-correspondingauthor,E-mail:liangjtangdu@163.com)
ObjectiveTo construct hsa-miR-381-over-expressed lentivirus vector,and to investigate the regulation effect of miR-381 in esophageal squamous cell carcinoma TE10 cells after transfection.MethodsThe miR-381 sequence was obtained by PCR amplification,and then inserted into the lentiviral vector LV3 with Green&Puro.The miR-381 sequence was confirmed by double-enzyme cleavage and DNA sequencing and extracted.The recombinant lentivirus plasmid and packaging plasmid pGag/Pol,pRev,and pVSV-G were co-transfected into 293T cells by liposomes.The viral yielded by 293T cell was transfected into TE10 cells.The status of transfection was observed by fluorescence microscope,and the expression of miR-381 was detected by real-time quantitative PCR before and after transfection.ResultsRestriction enzyme digestion and sequencing results showed that recombinant plasmid was successfully constructed and packaged to lentivirus.The miR-381 sequence was confirmed by restriction enzyme digestion and DNA sequencing,and successfully inserted into the vector.The viral titer was 2×108TU/ml.After transfection,the expression of miR-381 was significantly up-regulated in TE10 cells,and the expression abundance of hsa-miR-381 in TE10-381 increased by 456.05 times.ConclusionThe LV3-has-miR-381 lentiviral vector is successfully constructed,and it could significantly increase the miR-381 expression in TE10 cell.
miR-381; lentivirus vector; esophageal squamous cell carcinoma; gene transfection
国家自然科学基金资助项目(81301922)
周苏娜,女,1983-09生,博士,主治医师,E-mail:annyzhou0913@163.com
2016-12-08
Q78
A
1007-6611(2017)03-0241-05
10.13753/j.issn.1007-6611.2017.03.009

