银杏二萜内酯葡胺注射液通过激活Akt/Nrf2通路抑制缺糖缺氧诱导的SH-SY5Y细胞的氧化应激损伤
金治全,许治良,刘 秋,周 军,曹 亮,丁 岗,王振中,萧 伟
(江苏康缘药业股份有限公司,中药制药过程新技术国家重点实验室江苏省企业院士工作站,江苏 连云港 222001)
银杏二萜内酯葡胺注射液通过激活Akt/Nrf2通路抑制缺糖缺氧诱导的SH-SY5Y细胞的氧化应激损伤
金治全,许治良,刘 秋,周 军,曹 亮,丁 岗,王振中,萧 伟
(江苏康缘药业股份有限公司,中药制药过程新技术国家重点实验室江苏省企业院士工作站,江苏 连云港 222001)
目的探讨银杏二萜内酯葡胺注射液(DGMI)抑制缺糖缺氧(OGD)诱导人源性神经母细胞瘤细胞(SH-SY5Y)的氧化应激损伤及其机制。方法SH-SY5Y细胞随机分为正常细胞对照组,OGD模型组,OGD 4 h+DGMI 25 mg·L-1组,OGD 4 h+银杏叶提取物注射液(EGBLI)25 mg·L-1组,OGD 4 h+银杏内酯注射液(LGBI)25 mg·L-1组。药物作用6 h后,CCK-8法检测细胞存活,水溶性四唑盐1(WST-1)显色法法检测SOD活性,荧光探针法(DCFH-DA)检测ROS生成,Western蛋白印迹法检测细胞内血红素加氧酶(HO-1)、醌氧化还原酶(Nqo1)、蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、细胞内核因子E2相关因子2(Nrf2)、磷酸化Nrf2(p-Nrf2)的表达;OGD 4 h+DGMI 25 mg·L-1组加入PI3K抑制剂LY294002(终浓度为0,12.5,25和50 μmol·L-1),检测1 h后Akt,p-Akt,Nrf2和p-Nrf2的蛋白表达。结果与正常细胞对照组相比,OGD模型组SH-SY5Y细胞存活和SOD活性降低(P<0.01),ROS含量升高(P<0.01),降低p-Akt,Nrf2,p-Nrf2,HO-1和Nqo1的表达(P<0.01);与OGD模型组相比,OGD 4 h+药物组作用6 h,细胞存活率和SOD活性显著提高(P<0.01),ROS含量降低(P<0.05,P<0.01),p-Akt,Nrf2,p-Nrf2,HO-1和Nqo1蛋白表达水平提高(P<0.01),且DGMI 25 mg·L-1效果优于EGBLI 25 mg·L-1和LGBI 25 mg·L-1(P<0.05,P<0.01);相较DGMI组,DGMI和LY294002作用1 h后p-Akt和p-Nrf2的表达被显著抑制(P<0.01),抑制效果呈浓度依赖性。结论DGMI 25 mg·L-1对OGD诱导的SH-SY5Y细胞具有抗氧化保护作用,其机制可能与激活Akt/Nrf2通路有关。
银杏二萜内酯葡胺注射液;氧化应激;蛋白激酶B;细胞内核因子E2相关因子2
脑血管病已成为我国居民死亡和成人残疾的主要原因之一,严重危害人类健康,其中又以缺血性脑血管卒中最为常见。来自世界卫生组织的数据表明(HTTP://www.who.int/cardiovascular_diseases/ resources/atlas/en/),每年全世界有1500万人患卒中,有500万人因而死亡,500万人终身残废,给家庭和社会带来沉重负担。目前,最主要的治疗是溶栓以使血运重建,矛盾的是这会引起更严重的缺血再灌注损伤。脑缺血急性期后,脑损伤因缺血再灌注损伤可继发性加重,这是由多种因素参与的复杂病理过程,主要包括细胞炎症反应、能量代谢异常、氧化应激、兴奋性氨基酸终浓度及Ca2+稳态失调等多个环节[1]。
研究表明,在各种神经疾病中,包括慢性神经退行性疾病、急性脑外伤及脑缺血脑损伤等,氧化应激与神经死亡关系密切[2]。神经组织富含对氧自由基敏感的不饱和脂肪酸,又相对缺乏抗氧化物质。因此,易受氧自由基的伤害,导致神经细胞死亡。活性氧(reactive oxygen species,ROS)产生的氧化应激是造成细胞凋亡的重要环节[3],脑缺血可诱发氧化应激,ROS过多或清除能力下降,导致氧化系统和抗氧化系统失衡[4],在脑缺血的病理发病机制中起非常重要的作用[5-6]。在脑缺血损伤中,产生的ROS可直接损伤细胞的脂质体,蛋白质及DNA等[7]。氧化应激是缺血缺氧性脑病发展过程中的重要环节,是产生氧化损伤的更深层原因。越来越多的证据表明,刺激内源性抗氧化系统的表达将是治疗缺血性脑血管病的重要措施[8]。抑制脑缺血诱导的氧化应激对治疗脑缺血具有非常重要的意义。
银杏二萜内酯葡胺注射液(diterpene ginkgolides meglumine injection,DGMI)(康缘药业)用于治疗脑缺血具有良好疗效[9],该注射液由多个银杏二萜内酯组成(图1),包括银杏内酯A(ginkgolide A,GA),GB,GC和GK。除了可特异性拮抗PAF受体,抑制血栓形成以外,DGMI还能通过激活蛋白激酶A(protein kinase A,PKA)和磷脂酰肌醇-3激酶/蛋白质丝氨酸苏氨酸激酶信号通路(PI3K/Akt),抑制细胞凋亡,发挥神经元保护作用[10-11]。为了进一步研究DGMI的神经保护机制,我们以缺糖缺氧(oxygen-glucose deprivation,OGD)的SH-SY5Y细胞作为脑缺血的细胞模型,研究DGMI抑制氧化应激保护神经元的分子机制。
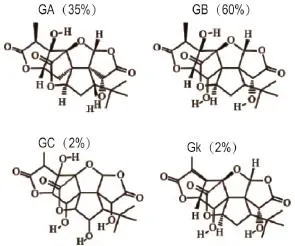
Fig.1 Chemical structures of ginkgolides and their content ratios in DGMI.GA:ginkgolide A;GB:ginkgolide B;GC:ginkgolide C;GK:ginkgolide K
1 材料与方法
1.1 细胞、药品、试剂和仪器
人神经母细胞瘤细胞SH-SY5Y购自中国科学院上海细胞库。
DGMI,江苏康缘药业股份有限公司,批号:141201;银杏叶提取物注射液(extract of ginkgo biloba leaves injection,EGBLI),批号:H6138,台湾济生化学制药厂股份有限公司;银杏内酯注射液(lactones ginkgo biloba injection,LGBI)批号:08130607,成都百裕科技制药有限公司;CCK-8试剂盒,贝博生物;DMEM培养基、胎牛血清,美国Gibco公司;HRP标记HO-1-兔单克隆IgG抗体、Nqo1-兔单克隆IgG抗体、Nrf2兔单克隆IgG抗体、p-Nrf2(Ser40)兔单克隆IgG抗体和β肌动蛋白兔单克隆IgG抗体,英国Abcam公司;HRP标记羊抗兔IgE抗体,美国Santa cruz公司;HRP标记Akt-兔单克隆IgG抗体和p-Akt(Thr308)-兔单克隆IgG抗体,美国CST公司;PI3K抑制剂LY294002、2‘7’-二氯双乙酸盐荧光探针(2,7-dichlorofluorescin diacetate,DCFH-DA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒,美国Sigma公司;磷酸化抑制剂PhosStop EASYpack,瑞士Roche公司。
Thermo scientific 3100二氧化碳培养箱(美国Thermo公司);Flex station 3微孔板检测系统(美国MD公司);ChemiDoc XRS系统(美国Bio-Rad公司);C150三气培养箱(德国Binder公司)。
1.2 缺糖缺氧细胞模型的建立
取对数生长期SH-SY5Y细胞,于5%CO2,37℃培养24 h后,去上清,用无糖DMEM清洗两次,含无细胞空白孔每孔加入相应100 μL无糖DMEM后,置于含5%CO2和95%N2的三气培养箱内于37℃,OGD培养0.5~8 h,CCK-8检测450 nm吸光度值(A450nm),计算细胞存活率,细胞存活率%=[(实验组A450nm-空白孔A450nm)/(正常细胞对照组A450nm-空白孔A450nm)]×100%。选择细胞存活率<60%的OGD时间作为模型组,复氧给不同浓度DGMI(0.19,0.39,0.78,1.56,3.12,6.25,12.5,25和50 mg·L-1),0.5~8 h后检测细胞存活率,选择细胞存活率>80%的DGMI作用时间作为给药组。
1.3 细胞分组
将SH-SY5Y细胞分为正常细胞对照组,OGD模型组,OGD 4 h+DGMI 25 mg·L-1,OGD 4 h+ EGBLI 25 mg·L-1和OGD 4 h+LGBI 25 mg·L-1给药组,OGD 4 h+EGBLI 25 mg·L-1+LY294002(12.5,25和50 μmol·L-1)抑制组,其中OGD 4 h+ EGBLI 25 mg·L-1和OGD 4 h+LGBI 25 mg·L-1组为阳性对照组。
1.4 荧光探针检测ROS水平
取对数生长期SH-SY5Y细胞,密度为2×105L-1,于黑色透明的96孔板每孔接种200 μL,培养过夜。1.3各组细胞置于含5%CO237℃培养6 h,然后加入终浓度为10 nmol·L-1的DCFH-DA,37℃孵育20 min,用HBSS(mmol·L-1:NaCl 137.93,KCl 5.33,NaHCO34.17,KH2PO40.411,Na2HPO40.338)清洗3次,再加入100 μL HBSS,酶标仪检测,激发波长488 nm,发射波长525 nm,用DCFH-DA的荧光强度比值(F525nm:F488nm)表示ROS水平。
1.5 WST-1法检测SOD活性
取对数生长期SH-SY5Y细胞,密度2×105L-1,于24孔板每孔接种1 mL。1.3各组细胞培养6 h,HBSS洗涤2次,加入含0.1%Triton X-100的HBSS 200 μL,超声裂解细胞,使用试剂盒中空白1、空白2、空白3以及相关检测试剂检测各孔450 nm吸光度值(A450nm),SOD活性以黄嘌呤氧化酶(xanthine oxidase,XO)的抑制率表示,XO抑制率(%)=〔(空白1A450nm-空白3A450nm)-(样品A450nm-空白2A450nm)〕/(空白1A450nm-空白3A450nm)×100%。
1.6 Western蛋白印迹检测蛋白表达
BCA法测定蛋白浓度,调整蛋白浓度后取50 μg总蛋白,经SDS-PAGE后,电转蛋白至PVDF膜,用TBST配置的5%BSA封闭2 h,按1∶1000比例加入各蛋白一抗,4℃孵育过夜,TBST洗涤3次后加入HRP标记的二抗(1∶2000),室温孵育2 h后洗涤3次,ECL法显影,ChemiDoc XRS系统拍摄照片。Quantity One软件对蛋白印迹进行积分吸光度(integrated absorbance,IA)分析,蛋白表达水平用IA目标蛋白/IAβ肌动蛋白比值表示。Akt和Nrf2的调控作用与其磷酸化相关,蛋白的磷酸化可在较短时间内完成,而表达则需要相对较长时间,因此检测了1 h和6 h的磷酸化水平,而抗氧化蛋白HO-1和Nqo1的抗氧化能力与表达水平相关,因此只检测了6 h的表达。
1.6.1 SH-SY5Y细胞抗氧化相关蛋白HO-1和Nqo1表达的检测
取对数生长期的SH-SY5Y细胞,调整细胞浓度至5×107L-1,10 mL接种于75 cm2培养皿,置37℃和5%CO2的培养箱中培养过夜。按1.3分组给药,6 h后提取蛋白,检测抗氧化蛋白HO-1和Nqo1的表达。
1.6.2 SH-SY5Y细胞Akt和Nrf2磷酸化水平的检测
细胞OGD作用4 h后,按1.3分组,各给药组复氧1 h和6 h后提取蛋白,检测Akt,p-Akt,Nrf2和p-Nrf2的表达及磷酸化水平。
1.6.3 PI3K抑制剂LY294002对PI3K/Akt信号通路相关蛋白影响的检测
细胞OGD作用4 h后,DGMI给药组同时加LY294002 0,12.5,25和50 μmol·L-1,1 h后,提取蛋白,检测Akt,p-Akt,Nrf2和p-Nrf2的表达,以验证DGMI是否通过此通路抑制氧化应激损伤。
1.7 统计学分析
使用SPSS 16.0统计软件进行分析,实验数据均以x±s表示,两组间比较采用t检验,多组间比较采用ANOVA检验,相关性分析采用Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 DGMI对OGD诱导的SH-SY5Y细胞存活的影响
CCK-8结果(图2A)显示,OGD作用4 h时,SH-SY5Y细胞存活率降低至56.05%,选取OGD 4 h作为模型组。OGD 4 h后给不同浓度DGMI作用6 h后,随给药浓度的增加,细胞存活率呈浓度依赖性上升(r=0.98,P<0.01)(图2B),DGMI 25 mg·L-1组细胞存活率达到87.23%,较模型组相比显著升高(P<0.01)。图2C显示,DGMI 25 mg·L-1给药6 h组细胞存活率提升至81.20%,较模型组相比SH-SY5Y细胞存活率显著升高(P<0.01),提示DGMI能抑制OGD诱导的SH-SY5Y细胞损伤,在后续实验中,本研究采用OGD 4 h作为模型组,DGMI 25 mg·L-1作用6 h进行抗氧化应激研究,检测ROS和SOD以及上游调控蛋白Akt,Nrf2的表达和磷酸化水平。选择1 h做相关通路验证,检测Akt及p-Akt,Nrf2和p-Nrf2的表达。
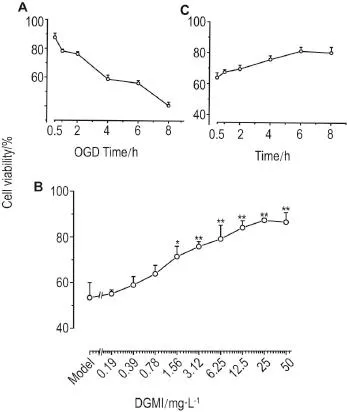
Fig.2 Effect of diterpene ginkgolides meglumine injection(DGMI)on cell viability of oxygen-glucose deprivation(OGD)-damaged SH-SY5Y cells.A:cell viabilities of SH-SY5Y cells after OGD treatment for 0.5-8 h;B:cell viabilities of SH-SY5Y cells treated by OGD for 4 h and followed by different concentrations of DGMI for 6 h;C:cell viabillities of SH-SY5Y cells treated by DGMI 25 mg·L-1for different lengths of time.x±s,n=3.*P<0.05,**P<0.01,compared with model group.
2.2 DGMI对OGD诱导的SH-SY5Y细胞内ROS水平和SOD活性的影响
ROS水平检测结果显示(图3A~B),相较正常细胞对照组,模型组ROS水平显著升高(P<0.01);与模型组相比,给药作用6 h,随着DGMI浓度的升高,ROS呈浓度依赖性降低(r=-0.83,P<0.01)(图3A)。各给药组ROS水平显著降低(P<0.01),提示DGMI,EGBLI和LGBI都能抑制SH-SY5Y细胞内OGD诱导的氧化应激;较EGBLI和LGBI组相比,DGMI组ROS水平降的更低(P<0.01)。
SOD活性检测结果(图3C)显示,与正常细胞对照组相比,模型组SH-SY5Y细胞内SOD活性显著降低(P<0.01);给药作用6 h后,各给药组SHSY5Y细胞的SOD活性显著升高(P<0.05,P<0.01),给药组间无显著差异。
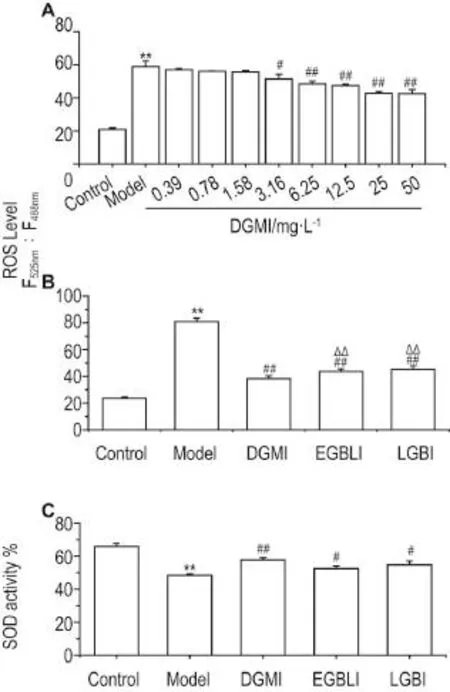
Fig.3 Effect of DGMI on ROS level and superoxide dis⁃mutase(SOD)activityinOGD-damaged SH-SY5Y cells.A:ROS Levels in OGD-damaged SH-SY5Y cells treated with different concentrations of DGMI for 6 h;B and C:ROS levels and SOD activity in OGD-damaged SH-SY5Y cells treated with 25 mg·L-1DGMI,EGBLI and LGBI for 6 h,respectively.s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group;△△P<0.01,compared with DGMI group.
2.3 DGMI作用6 h对OGD诱导的SH-SY5Y细胞内Akt和Nrf2表达和活性的影响
图4结果表明,与正常细胞对照组相比,OGD使SH-SY5Y细胞中的p-Akt,Nrf2和p-Nrf2表达显著降低(P<0.01)。与模型组相比,OGD作用4 h,给药作用6 h,DGMI,EGBLI和LGBI都可显著提升p-Akt,Nrf2和p-Nrf2的表达(P<0.05,P<0.01),细胞内总Akt的表达没有显著变化,p-Nrf2/Nrf2没有变化,说明DGMI,EGBLI和LGBI还可通过提高Nrf2表达以提高其活性,其中DGMI组Nrf2和p-Nrf2表达显著高于EGBLI和LGBI(P<0.01)。

Fig.4 Effect of DGMI on expression of p-Akt,total Akt,total Nrf2 and p-Nrf2 in OGD-damaged SH-SY5Y cells detected by Western blotting.See Fig.3 for cell treatment.B and C were the semi-quantitative result of A.,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group;△△P<0.01,compared with DGMI group.
2.4 DGMI对OGD诱导的SH-SY5Y细胞抗氧化蛋白HO-1和Nqo1表达的影响
Western蛋白印迹检测结果显示(图5),与正常细胞对照组相比,OGD作用4 h后,HO-1及Nqo1的表达显著降低(P<0.01);给药作用6 h后,各给药组HO-1及Nqo1表达显著高于模型组(P<0.01);同时,DGMI组HO-1表达显著高于EGBLI(P<0.01),与LGBI组差异无统计学意义。DGMI组Nqo1表达显著高于EGBLI组和LGBI组(P<0.05,P<0.01)。结果表明,DGMI的抗氧作用与提高HO-1和Nqo1等抗氧化蛋白质的表达有关。

Fig.5 Effect of DGMI 25 mg·L-1on protein expression of HO-1 and Nqo1 in OGD-damaged SH-SY5Y cells by Western blotting.See Fig.3 for cell treatment.B:semi-quantita⁃tive result of A.n=3.**P<0.01,compared with normal con⁃trol group;#P<0.05,##P<0.01,compared with model group;△P<0.05,△△P<0.01,compared with DGMI group.
2.5 DGMI作用1 h对OGD诱导的SH-SY5Y细胞内Akt和Nrf2磷酸化的影响
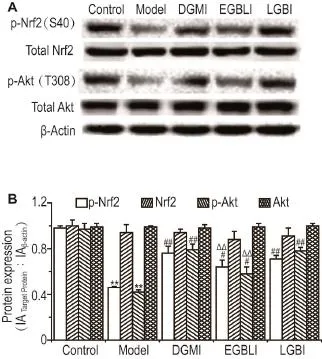
Fig.6 Effect of DGMI on expression of Nrf2,p-Nrf2,total Nrf2,p-Akt and total Akt in OGD-damaged SH-SY5Y cells by Western blotting.Cells treated by OGD for 4 h of followed by DGMI 25 mg·L-1for 1 h.B was the semi-quantitative result of A.n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group;△△P<0.01, compared with DGMI.
Western蛋白印迹检测结果显示(图6),OGD使SH-SY5Y细胞中Akt及Nrf2的磷酸化水平降低(P<0.01);OGD作用4 h,复氧给药1 h,较模型组,DGMI,EGBLI和LGBI均能促进OGD的SH-SY5Y细胞中Akt和Nrf2的磷酸化(P<0.01);同时,DGMI组p-Nrf2和p-Akt表达显著高于EGBLI(P<0.01),与LGBI组相比,差异无统计学意义。
2.6 不同浓度LY294002阻断DGMI对Akt和Nrf2磷酸化的影响
图7结果显示,随着LY294002浓度的增加,p-Akt及p-Nrf2的表达浓度依赖性降低。DGMI激活Nrf2有能被PI3K抑制剂浓度依赖性阻断。提示DGMI能通过激活Akt/Nrf2信号通路,提高Nrf2活性,提高抗氧化应激蛋白质生成,抑制氧化应激的损害。
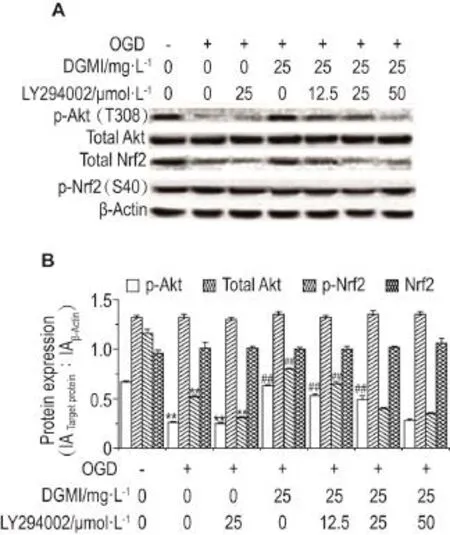
Fig.7 Effect of LY294002 on expression of p-Akt,total Akt,total Nrf2 and p-Nrf2 in OGD-damaged SH-SY5Y cells by Western blotting.Cells treated by OGD for 4 h fol⁃lowed by DGMI 25 mg·L-1and different concentrations of LY294002 for 1 h.B was the semi-quantitative result of A.n=3.**P<0.01,compared with normal control group;##P<0.01,compared with model group.
3 讨论
本研究结果表明,OGD诱导神经细胞的氧化应激,使ROS水平升高,DGMI能浓度依赖性降低OGD诱导的SH-SY5Y细胞中ROS水平,具有保护SH-SY5Y细胞抵抗氧化应激损伤的作用。
本研究结果显示,DGMI、EGBLI和LGBI都能提高OGD的SH-SY5Y细胞中的抗氧化蛋白质的活性和蛋白质水平。OGD使SH-SY5Y细胞内SOD的活性下降,HO-1和Nqo1等蛋白质水平降低,DGMI,EGBLI和LGBI能抑制OGD的诱导的SH-SY5Y细胞中SOD的活性下降,提升HO-1和Nqo1等蛋白的表达;能抑制OGD诱导的SH-SY5Y细胞中抗氧化蛋白表达水平的降低,进而降低OGD诱导的ROS的升高。相比EGBLI和LGBI,DGMI降低OGD诱导的ROS效果更好。
抗氧化蛋白HO-1和Nqo1的表达受Nrf2的调节[13],本研究结果表明,DGMI,EGBLI和LGBI能抑制OGD的SH-SY5Y细胞中抗氧化蛋白质水平和活性,与激活Nrf2/ARE信号有关。其中,DGMI效果更佳。在OGD的SH-SY5Y细胞中,Nrf2(S40)的磷酸化水平下降,活性降低。这些药物能上调OGD的SH-SY5Y细胞中Nrf2(S40)的磷酸化水平。表明这些药物的抗氧化作用与激活Nrf2上调抗氧化蛋白表达。Nrf2是核转录因子,在生理条件下,与胞浆蛋白伴侣分子(Kelch-like ECH-associated protein 1,Keap1)偶联,并与肌动蛋白细胞骨架结合被锚定于细胞质,通过泛素-蛋白酶体途径可促进Nrf2降解[15]。另一部分Nrf2以磷酸化的活性状态存在于细胞核中,介导基因的基本转录。氧化应激情况下Nrf2从胞浆转移至胞核与ARE结合,启动抗氧化基因表达,参与调节细胞的氧化应激反应[14],调控的一大批下游分子具有抗氧化应激、调节炎症损伤、抗细胞凋亡和缓解钙离子超载等多重功能[8]。
在中枢系统中,Nrf2/ARE在细胞内抗氧化反应中起着中枢调节作用,抗氧化蛋白质水平和活性与Nrf2的活化有关。文献表明,Nrf2通过激活下游的HO-1,谷胱甘肽(glutathione,GSH)及Nqo1保护机体免受氧化活性物质的侵害[16]。永久性脑缺血的小鼠脑内,Nrf2与Keap1的解离增加,促进Nrf2核转移,HO-1的表达也随之增加。而在Nrf2基因敲除的小鼠中,这种保护作用消失[17]。醌氧化还原酶Nqo1也已被证实为Nrf2下游的重要的抗氧化酶[18]。因此,抗氧蛋白质的表达与Nrf2的活性有关。Nrf2通过磷酸化激活后,进入细胞核并结合ARE,启动HO-1和Nqo1等表达[19]。
本研究表明,OGD能降低SH-SY5Y细胞中Akt(T308)的磷酸化水平。DGMI能使OGD的SHSY5Y细胞中Akt(T308)的磷酸化水平升高。表明DGMI能激活Akt信号通路。而Nrf2的转录活性受Akt的调节[12],PI3K/Akt信号通路可调节Nrf2-ARE的活性,Akt磷酸化Nrf2(S40),增强Nrf2的活性[20],从而促进细胞的内源性抗氧化作用[21]。Akt有Thr308和Ser473磷酸化位点,其中T308位点的磷酸化可近百倍的增强Akt活性,S473约为5倍[22],Akt的活性主要通过T308磷酸化水平来体现,我们检测了OGD的SH-SY5Y细胞在DGMI与不同浓度的PI3K抑制剂LY294002同时DGMI作用1 h之后的Akt,p-Akt,Nrf2和p-Nrf2的表达,PI3K抑制剂能浓度依赖性的阻断DGMI通过Akt对Nrf2的激活作用,调节Nrf2的活性。证明DGMI对Nrf2的活性的调节通过Akt/Nrf2信号通路。
我们的研究还表明,长时间的给药还能提高Nrf2的表达。文献报道Akt能调节Nrf2的表达[23]。因此,OGD作用4 h后给药6 h,DGMI组Nrf2和p-Nrf2表达显著高于EGBLI和LGBI可能与提高Akt活性有关。
综上所述,DGMI可通过激活PI3K,增强其下游的Akt/Nrf2信号,促进OGD的SH-SY5Y细胞中抗氧化应激蛋白质产生,发挥抗氧化应激作用。激活PI3K/Akt/Nrf2信号通路可能是DGMI抗氧化保护神经细胞的机制之一。EGBLI中的银杏二萜内酯含量很低,黄酮类物质较高。而LGBI中的白果内酯含量高,银杏二萜内酯含量较低。DGMI全部是银杏二萜内酯。EGBLI和LGBI的抗氧化活性不如DGMI,可能与其中银杏二萜内酯含量较低有关。
生物体内抗氧化系统是一个复杂的分子网路,涉及到的信号通路不仅仅有PI3K/Akt/Nrf2这一条;Nrf2的上游调控分子也不止Akt一个,还有其他的上游调控分子如ERK1/2和MAPK等;PI3K/Akt通路下游亦不止Nrf2一个分子,除了Nrf2这个重要分子是否还有其他的分子参与DGMI抗氧化过程有待进一步研究。
[1]Wang GS,Geng DQ.Recent studies on mecha nisms of cerebral ischemia/reperfusion injury[J]. Med Recapitulate(医学综述),2011,17(24):3753-3756.
[2]Reiter RJ.Oxidative processes and antioxidative defense mechanisms in the aging brain[J]. FASEB J,1995,9(7):526-533.
[3]Van Soom A,Yuan YQ,Peelman LJ,De Matos DG,Dewulf J,Laevens H,et al.Prevalence of apoptosis and inner cell allocation in bovine embryos cultured under different oxygen tensions with or without cysteine addition[J].Theriogenology,2002,57(5):1453-1465.
[4]Maritim AC,Sanders RA,Watkins JB.Diabetes,oxidative stress,and antioxidants:a review[J].J Biochem Mol Toxicol,2003,17(1):24-38.
[5]Chen SD,Yang DI,Lin TK,Shaw FZ,Liou CW,Chuang YC.Roles of oxidative stress,apoptosis,PGC-1alpha and mitochondrial biogenesis in cerebral ischemia[J].Int J Mol Sci,2011,12(10):7199-7215.
[6]Saito A,Maier CM,Narasimhan P,Nishi T,Song YS,Yu F,et al.Oxidative stress and neuronal death survival signaling in cerebral ischemia[J]. Mol Neurobiol,2005,31(1-3):105-116.
[7]Meneghini R.Iron homeostasis,oxidative stress,and DNA damage[J].Free Radic Biol Med,1997,23(5):783-792.
[8]Zhang Y.Nrf2-Keapl Signaling pathways and cere⁃bral apoplexy[J].Stroke Nerve Dis(卒中与神经疾病),2014,31(4):372-374.
[9]Zhao BJ,Wang ZZ,Ling Y,Zhou S,Wu SY,Dong SL,et al.PhaseⅢclinical trial of diterpene ginkgolides meglumine injection for syndrome of stagnant phlegm blocking collaterals in convales⁃cence of atherosclerotic thrombotic cerebral infarc⁃tion[J].Chin Tradit Herb Drugs(中草药),2013,44(24):3525-3530.
[10]Liu Q,Xu ZL,Jin ZQ,Zhou J,Bi YA,Wang ZZ,et al.Diterpene ginkgolides meglumine injection attenuates oxygen-glucose deprivation-induced apop⁃tosis of nerve cells via inhibition of calpain signaling pathway[J].J China Pharm Univ(中国药科大学学报),2015,46(6):707-711.
[11]Liu Q,Xu ZL,Zhou J,Li N,Bi YA,Wang ZZ,et al. Neuroprotective effects of YXETNZ injection on SH-SY5Y cells against injury induced by oxygenglucose deprivation[J].Chin Pharmacol Bull(中药药理学通报),2015,31(7):994-999.
[12]Martin D,Rojo AI,Salinas M,Diaz R,Gallardo G,Alam,et al.Regulation of heme oxygenase-1 expres⁃sion through the phosphatidylinositol 3-kinase/Akt pathway and the Nrf2 transcription factor in response to the antioxidant phytochemical carnosol[J].J Biol Chem,2004,279(10):8919-8929.
[13]Jeong WS,Jun M,Kong AN.Nrf2:A potential molecular target for cancer chemoprevention by natural compounds[J].Antioxid Redox Signal,2006,8(1-2):99-106.
[14]Mann GE,Niehueser-Saran J,Watson A,Gao L, Ishii T,de Winter P,et al.Nrf2 ARE Rgulated anti⁃oxidant gene in endothelial and smooth muscle cells in oxidative stress:implications for atheroscle⁃rosis and preeclampsia[J].Acta Physiol Sin(生理学报),2007,59(2):117-127.
[15]Giudice A,Montella M.Activation of the Nrf2-ARE signaling pathway:a promising strategy in cancer prevention[J].Bioessays,2006,28(2):169-181.
[16]Kang MI,Kobayashi A,Wakabayashi N,Kim SG,Yamamoto M.Scaffolding of Keapl to the actin cytoskeleton controls the function of Nrf2 as key regulator of cytoprotective phase 2 genes[J].Proc Natl Acad Sci USA,2004,101(7):2046-2051.
[17]Wang B,Cao WS,Biswal S,Doré S.Carbon monoxide-activated Nrf2 path way leads to protec⁃tion against permanent focal cerebral ischemia[J]. Stroke,2011,42(9):2605-2610.
[18]Lin XM,Zhao J,Yu SS.Protective effects of diallyl sulfide on the focal cerebral ischemia-reperfusion in rats model[J].Stroke Nerve Dis(卒中与神经疾病杂志),2011,28(2):100-103.
[19]Thimmulappa RK,Mai KH,Srisuma S,Kensler TW,Yamamoto M,Biswal S.Identification of Nrf2-regu⁃lated genesinduced bythe chemopreventive agent sulfora phane by oligonucleotide microarray[J].Cancer Res,2002,62(18):5196-5203.
[20]Wang L,Chen Y,Sternberg P,Cai J.Essential roles of the PI3 kinase Akt pathway in regulating Nrf2-dependent antioxidant functions in the RPE[J].Invest Ophthalmol Vis Sci,2008,49(4):1671-1678.
[21]Nakaso K,Yano H,Fukuhara Y,Takeshima T,Wada-Isoe K,Nakashima K.PI3K is a key mole⁃cule in the Nrf2-mediated regulation of antioxida⁃tive proteins by hemin in human neuroblastoma cells[J].FEBS Lett,2003,546(2-3):181-184.
[22]Hers I,Vincent EE,Tavaré JM.Akt signalling in health and disease[J].Cell Signal,2011,23(10):1515-1527.
[23]Umemura K,Itoh T,Hamada N,Fujita Y,Akao Y,Nozawa Y,et al.Preconditioning by sesquiterpene lactone enhances H2O2-induced Nrf2/ARE activation[J].Biochem Biophys Res Commun,2008,368(4):948-954.
Diterpene ginkgolides meglumine injection inhibits oxidative stress induced by oxygen-glucose deprivation by activating Akt/Nrf2 pathway in SH-SY5Y cells
JIN Zhi-quan,XU Zhi-liang,LIU Qiu,ZHOU Jun,CAO Liang,DING Gang, WANG Zhen-zhong,XIAO Wei
(Jiangsu Kanion Pharmaceutical Co.,Ltd.State Key Laboratory of New Pharmaceutical Process for Traditional Chinese Medicine,Enterprises Academician Workstations in Jiangsu Province, Lianyungang 222001,China)
OBJECTIVETo investigate the protective effects and mechanism of diterpene ginkgolides meglumine injection(DGMI)against oxidative stress induced by oxygen-glucose deprivation(OGD)in SH-SY5Y cells.METHODSSH-SY5Y cells were divided into five groups:normal control,model control (OGD group)and drug(25 mg·L-1)administration groups including DGMI group,extract of ginkgo biloba leaves injection group(EGBLI)and lactones ginkgo biloba injection group(LGBI).The cells suffered from oxygen-glucose deprivation(OGD)for 4 h,followed by reoxygenation with drugs for 6 h. Then,cell viabilities were detect using CCK-8 assays,reactive oxygen species(ROS)levels using fluorescence probe DCFH-DA and superoxide dismutase(SOD)activities using WST-1 test.Western blotting was used to detected protein levels of hemeoxygenase-1(HO-1),NAD(P)H,quinone oxidore⁃ductase l(Nqo1),protein kinase B(Akt),phosphorylated Akt(p-Akt),nuclear factor-E2-related factor2 (Nrf2)and phosphorylated Nrf2(p-Nrf2).The cells were induced by OGD for 4 h,followed by reoxygen⁃ation and DGMI for 1 h,combined with different concentrations of PI3K inhibitor(LY294002)(at the final concentration of 12.5,25 and 50 μmol·L-1)before the protein levels of AKT,p-AKT,Nrf2 and p-Nrf2 were detected by Western blotting.RESULTSSH-SY5Y cells induced by OGD for 4 h resulted in an increase in ROS(P<0.01),but a decrease in cell viabilities(P<0.01),SOD activities(P<0.01),and antioxidant protein levels(Akt,p-Akt,Nrf2,p-Nrf2,HO-1 and Nqo1)(P<0.01).Compared with OGD group,treatment with reoxygenation and drugs(DGMI,EGBLI and LGBI respectively)for 6 h resulted in a decrease in ROS(P<0.01),but an increase in cell viabilities,SOD activities and antioxidant protein levels of p-Nrf2, HO-1,Nqo1 and p-Akt(P<0.05,P<0.01).DGMI group showed the best efficiently.Moreover,after OGD for 4 h,compared with DGMI group,combining reoxygenation and DGMI with LY294002 for 1 h resulted in a concentration-dependent inhibition of the protein levels of p-AKT and p-Nrf2(P<0.01).CONCLUSIONDGMI 25 mg·L-1can inhibit oxidative stress in SH-SY5Y cells induced by OGD by increasing the activity and expression of Nrf2 through PI3K/Akt pathway,which may be one of the mechanisms by which DGMI protects neurons from stroke.
diterpene ginkgolides meglumine injection;oxidative stress;protein kinase B;nuclear factor-E2-related factor 2
XIAO Wei,E-mail:kanionlunwen@163.com,Tel:(0518)81152367
R285.5
:A
:1000-3002-(2017)01-0065-08
10.3867/j.issn.1000-3002.2017.01.008
2016-01-06 接受日期:2016-09-05)
(本文编辑:贺云霞)
国家科技重大专项(2013ZX09402203)
金治全,男,硕士,主要从事药物作用机制研究,E-mail:jin.zq@163.com;萧 伟,男,博士,高级工程师,主要从事中药新药的研究与开发。
通迅作者:萧伟,E-mail:kanionlunwen@163.com,Tel:(0518)81152367
Foundation item:The project supported by National Science and Technology Major Proiect of China(2013ZX09402203)

