黄芩苷改善Aβ25-35诱导的小鼠学习和记忆障碍及可能机制
肖 弯,曹晓璐,2,张 容,高成志,杜 晶,殷婷子,张 颖,洪 星,胡霞敏,2,任 波
(武汉科技大学1.医学院药学系,2.心脑血管药物研究基地,3.医学院基础医学部,湖北武汉 430065)
黄芩苷改善Aβ25-35诱导的小鼠学习和记忆障碍及可能机制
肖 弯1,曹晓璐1,2,张 容1,高成志1,杜 晶1,殷婷子1,张 颖1,洪 星1,胡霞敏1,2,任 波3
(武汉科技大学1.医学院药学系,2.心脑血管药物研究基地,3.医学院基础医学部,湖北武汉 430065)
目的观察黄芩苷对Aβ25-35诱导的模型小鼠学习记忆能力的改善作用及对小鼠海马区自噬和自噬相关基因的影响,探讨黄芩苷治疗阿尔茨海默病(AD)的可能机制。方法C57BL/6小鼠侧脑室注射3 μL浓度为3 mmol·L-1的凝聚态Aβ25-35制备AD模型,ip给予黄芩苷25,50和100 mg·kg-1,连续给药15 d。通过旷场实验观察小鼠的运动总距离和中央格停留时间,水迷宫定位航行实验观察其潜伏期,空间搜索实验观察原象限停留时间。透射电镜观察海马区自噬小体的生成,Western蛋白印迹法测定中微管结合蛋白1轻链3分子(LC3)和Beclin1的表达。结果脑室注射Aβ25-35可引起小鼠旷场实验运动总距离减少,从(3984±321)cm减少到(2790±306)cm,中央格停留时间由(3.6±1.2)s延长到(8.8±2.9)s,也可使水迷宫实验到达平台总时间由(22.0±1.9)s增加到(38.8±2.2)s;同时观察到海马区早期或晚期自噬泡形成。Western蛋白印迹结果显示,LC3和Beclin1蛋白表达升高(P<0.05)。黄芩苷50和100 mg·kg-1连续给药15 d能延长旷场实验运动总距离,分别为3705±337和(3968±448)cm;中央格停留时间分别缩短为5.6±1.8和(3.9±1.5)s;水迷宫实验到达平台总时间缩短为28.6±1.9和(22.9±1.7)s。透射电镜可见海马区线粒体肿胀,空泡状双层膜结构或者自噬泡形成;LC3和Beclin1蛋白表达明显升高(P<0.01)。结论黄芩苷对AD小鼠的学习记忆损伤有一定的改善作用,作用机制可能与其升高AD小鼠海马区自噬水平有关。
黄芩苷;阿尔茨海默病;自噬;β-淀粉样肽;学习障碍;记忆障碍
自噬是真核生物降解自身受损的细胞器和回收蛋白质等大分子物质的过程,参与真核生物的细胞退化,且在真核生物疾病的发生发展中起关键作用[1-2]。直到近十年来一系列自噬相关基因(Atg)和它们的编码蛋白(ATG)的发现,自噬的分子机制逐渐为人所知。阿尔茨海默病(Alzheimer disease,AD)的研究和药物开发已经成为医学界关注的老年问题,目前倾向于认为多种机制参与了AD特征性病理结构的形成过程,如Aβ毒性和tau蛋白异常修饰等,其分别是导致老年斑和神经原纤维缠结的主要原因,而Aβ是能直接诱导脑内炎性反应的刺激物[3]。研究发现,在神经退行性疾病中,蛋白酶体对突变的polyQ,tau和α突触核蛋白等蛋白质失去作用,不能将这些突变的蛋白质清除,导致这些蛋白质的大量聚集[4-5]。AD大脑中,淀粉样前体蛋白、病理性β淀粉样肽、早老蛋白1在肿胀的神经突的自噬泡内高聚集,提示自噬参与AD病程[6-8],但是上调的自噬水平并不足以有效清除毒性蛋白[9]。因此,提高脑内自噬水平,清除聚集的蛋白质是治疗神经退行性疾病的关键。黄芩苷是从黄芩根中提取分离出来的一种黄酮类化合物,具有显著的生物活性,被广泛应用于炎症、流感和其他疾病的治疗。最近的研究表明,黄芩苷能防止缺血再灌注引起的神经细胞死亡,增强神经系统功能[10]。有研究显示,黄芩苷能够透过血脑屏障分布脑内,尤其在海马、纹状体、皮质和丘脑部分[11]。为此,本研究通过观察黄芩苷对Aβ25-35诱导的小鼠的学习记忆能力的影响,探讨黄芩苷治疗AD的可能机制,为黄芩苷用于AD临床提供理论依据。
1 材料与方法
1.1 主要试剂和仪器
Aβ25-35,1 mg(美国Sigma公司),规格1 mg的Aβ25-35加314.5 μL的无菌生理盐水中制成3 mmol·L-1的溶液,密封置于37℃经7 d形成凝聚态,-20℃保存备用。;黄芩苷由武汉烟草集团有限公司提供(纯度96%);鼠抗人Beclin1多克隆抗体购自美国Santa Cruz公司(产品编号:SC-48341);兔抗小鼠微管结合蛋白1轻链分子3(microtubule-associated protein 1 light chain 3,LC3)多克隆抗体(产品编号:#3868)购自美国Cell Signaling公司。
ZH-蓝星C/s型脑立体定位仪,安徽正华生物仪器设备有限公司。微量注射器,5μL,瑞士Hamilton公司。Morris水迷宫实验系统(XR-XM101),上海欣软信息科技公司。Xmaze旷场实验分析系统,上海欣软信息科技公司。LKB2V型超薄切片机,日立H2600型透射电镜由武汉大学医学院电镜实验室提供。
1.2 动物及AD模型构建
72只2月龄雄性C57小鼠,体质量20~25 g,购自湖北省疾病预防控制中心,动物许可证号:SCXK(鄂)2015-0018。小鼠适应性饲养7 d后,水迷宫实验筛选合格的小鼠,小鼠从任意2个象限入水,在2 min内无法找到隐藏的平台视为不合格。手术前1 d禁食、禁水12 h。称重标记小鼠后,每鼠ip给予10%水合氯醛3.5 mL·kg-1麻醉,将麻醉后动物俯卧位固定于脑立体定位仪上。75%乙醇消毒术野,减压开头顶正中皮肤,钝性分离各层至颅骨,找到前囟、对耳线。采用微量注射器行脑室注射(前卤后0.22 mm,旁开1.0 mm,深度2.5 mm)[11],给药3 μL,速度0.5 μL·min-1,留针5 min,假手术组给予同等体积的生理盐水。注射后分层缝合头顶部的肌肉和皮肤,常规消毒、缝合伤口。
1.3 分组及给药
1.2项处理的小鼠分为假手术组、模型组和黄芩苷25,50和100 mg·kg-1,每组12只。脑室注射3 μL浓度为3 mmol·L-1的凝聚态Aβ25-35后1 h,ip注射给予黄芩苷连续15 d,假手术组和模型组给予同等体积的生理盐水。
1.4 Morris水迷宫实验[13-14]
水迷宫装置为一圆形水池,直径120 cm,水深30 cm,加入白色食用色素使水不透明,水温维持在19~21℃。池壁标记Ⅰ,Ⅱ,Ⅲ和Ⅳ4个入水点,在第Ⅲ象限中央水下1~2 cm处放置平台。脑室注射后第10天水迷宫检测小鼠学习记忆能力,一共持续5 d,包括①定位航行实验:实验时将小鼠头朝池壁依次从4个入水点放入水池中,同时启动监测装置,跟踪并记录动物游泳轨迹。给予小鼠60 s时间寻找平台,若小鼠入水后60 s未找到平台,则将其牵引至平台并停留10 s。每只小鼠完成4个象限测试为1次训练,每天训练2次,连续5 d;②空间搜索实验:第5天训练结束后撤去平台,将小鼠从距离原平台位置最远的象限(第Ⅰ象限)放入水中,记录并分析小鼠在原平台所在象限的时间。
1.5 旷场实验测定动距离、跨格次数以及中央格数停留时间
由于河道下方土层情况不明,钢板桩施工过程中,可能遇到存在石块、杂物、建筑垃圾及护岸混凝土残块等的土层而导致钢板桩沉桩受阻,无法顺利打至设计高程。
脑室注射后第15天旷场实验观察小鼠的空间认知能力。将旷场划分为25个大小相同的方格,设定四周16个方格为外周区域,其余9个方格为中心区域,实验环境由2台15 W红色白炽灯提供照明。操作者将小鼠小心放人旷场正中格,用摄像系统记录动物5 min的行为变化,包括运动距离、跨格次数以及中央格数停留时间。实验共进行2次,每只小鼠实验结束后清除粪便,用70%乙醇喷洒旷场底部并用洁净纱布抹干,以免前只小鼠的残留气味造成对本次实验的影响。
1.6 透射电镜观察海马区自噬小体[15]
行为学实验结束后,小鼠10%水合氯醛麻醉后,2%戊二醛左心室灌注固定,分离海马CA1区,4%多聚甲醛后固定2 h,环氧树脂包埋,使用振动切片机切成超薄切片(90 nm)。透射电子显微镜观察并摄片。
1.7 Western蛋白印迹检测海马区Beclin1蛋白和LC3蛋白表达
行为学实验结束后活杀小鼠,取新鲜脑组织,用蛋白裂解液提取总蛋白,常规电泳,转膜,封闭后分别加入Beclin1一抗(1∶5000)和LC3一抗(1∶1000),4℃过夜,TBST洗涤,加入辣根过氧化物酶标记二抗,37℃1 h,化学发光显色。用Quantity One(version 4.6)分析软件测定各条带的积分吸光度值,目标蛋白与内标蛋白积分吸光度值比值表示蛋白相对表达量。
1.8 统计学分析
2 结果
表1结果显示,与假手术组比较,模型组运动总距离减少,中央格停留时间延长(P<0.05);与模型组比较,黄芩苷25 mg·kg-1组小鼠运动总距离和中央格停留时间无显著差异,黄芩苷50和100 mg·kg-1组小鼠运动距离增加,中央格停留时间减少(P<0.01)。
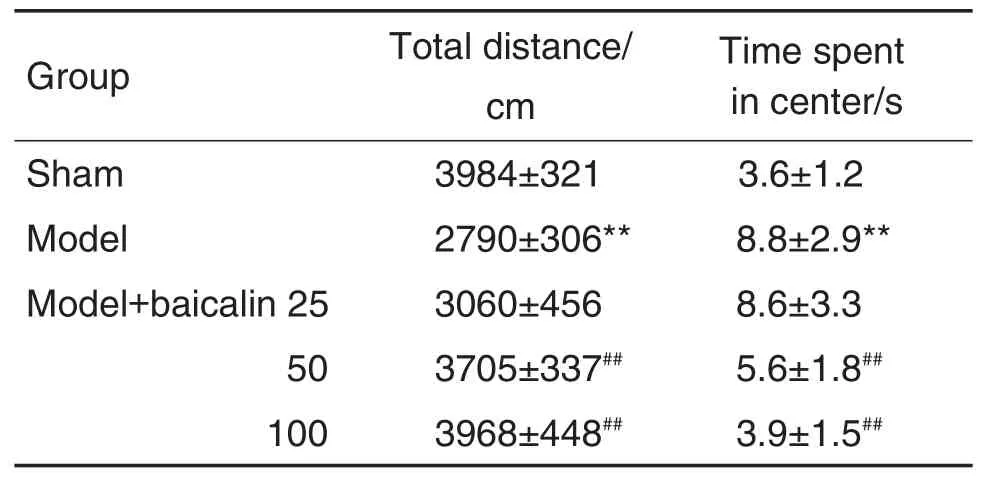
Tab.1 Effect of baicalin on total distance and time spent in center in open-field test of mice
2.2 黄芩苷对Aβ25-35诱导小鼠学习记忆能力的影响
定位航行实验(表2)结果显示,训练第1天到第3天,模型组动物的平均潜伏期与其他组无明显差别;而且随着训练次数的增加,到达平台的潜伏期不断缩短。训练第4天至第5天,模型组小鼠的上台潜伏期和游泳距离明显高于假手术组和黄芩苷50和100 mg·kg-1组(P<0.05)。
空间搜索实验(表3)结果显示,实验第5天撤除平台,模型小鼠在平台所在象限(第Ⅲ象限)中游泳的时间明显低于假手术组(P<0.05),与模型组比较,黄芩苷25 mg·kg-1组在平台所在象限游泳时间无明显改变,黄芩苷50和100 mg·kg-1组小鼠在平台象限停留的时间明显延长(P<0.05)。
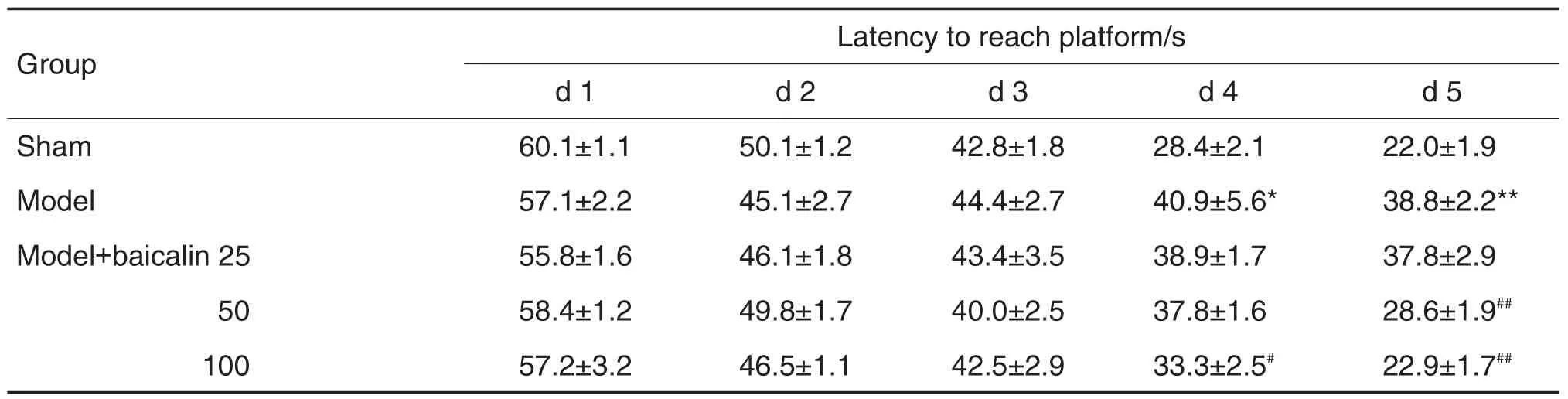
Tab.2 Effect of baicalin on latency to reach platform in navigation test of mice
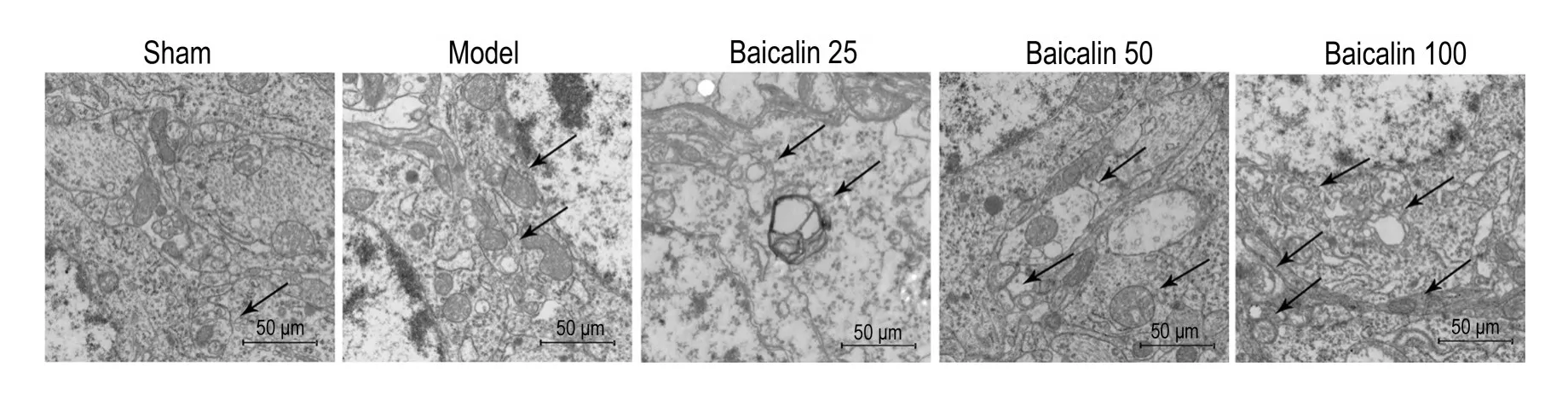
Fig.1 Effect of baicalin on autophagic vacuoles in hippocampus of mice by electron microscopy.See Tab.1 for the treatment.Arrows show autophagosomes and late-autophagic compartments in hippocampus.
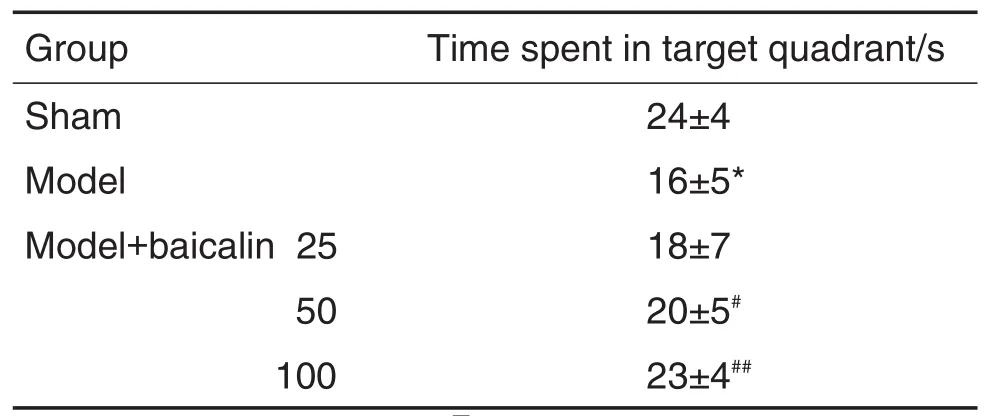
Tab.3 Effect of baicalin on time spent in target quad⁃rant in space exploration test of mice
2.3 黄芩苷对Aβ25-35诱导的小鼠海马自噬水平的影响
透射电镜观察发现(图1),模型组海马组织出现双层膜环绕线粒体形成的自噬体,黄芩苷50和100 mg·kg-1处理后,海马CA1区内线粒体肿胀变性,其周围有空泡状双层膜结构,同时发现有双层膜环绕形成的自噬泡,里面包含可见的线粒体轮廓和其他未被完全分解的细胞器碎片。提示黄芩苷激活AD小鼠脑内的自噬水平。
2.4 黄芩苷对Aβ25-35诱导的小鼠海马LC3和Beclin1蛋白的影响
Western蛋白印迹(图2)检测结果显示,与假手术组相比,模型组LC3Ⅰ向LC3Ⅱ转化增多(P<0.05),Beclin1表达升高(P<0.01);与模型组相比,黄芩苷25 mg·kg-1处理对LC3Ⅱ/LC3Ⅰ的比值和Beclin1的表达无显著影响,给予黄芩苷50和100 mg·kg-1处理后,LC3Ⅱ/LC3Ⅰ的比值逐渐升高(P<0.01),Beclin1表达显著上升(P<0.05)。
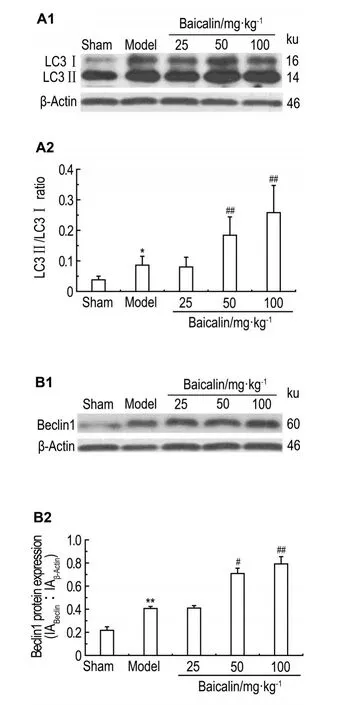
Fig.2 Effect of baicalin on protein expression of micro⁃tubule associated protein 1 light chain 3(LC3)Ⅱ/LC3Ⅰ(A)and Beclin1(B).See Tab.1 for the treatment.A2 and B2 were the semiquantitative results of A1 and B1.IA:integrated absorbance.x±s,n=6.*P<0.05,**P<0.01,compared with sham group;#P<0.05,##P<0.01,compared with model group.
3 讨论
本研究发现,黄芩苷能改善小鼠学习及认知能力。实验采用脑室注射Aβ25-35外源性给予毒性蛋白诱导自噬进一步观察该作用是否与自噬被激活有关。Chen等[9]在淀粉前体蛋白/早老蛋白1模式小鼠上也观察到自噬小体高于正常水平,而这种模式小鼠脑内有明显的Aβ沉积,这种病理性Aβ沉积诱导的自噬不足以有效清除毒性蛋白。黄芩苷治疗后,小鼠海马区自噬体数目明显增多,提示黄芩苷诱导了AD小鼠海马区自噬水平进一步升高,结合行为学结果分析,这一升高能够有效清除沉积的淀粉肽,改善AD小鼠的学习记忆功能。LC3和Beclin1均作为自噬相关基因,参与了自噬体的形成[16]。其中,LC3是能靶向定位于自噬体膜,参与自噬的形成。当自体吞噬发生时,Ⅰ型LC3经泛素样加工修饰过程与自噬膜表面的磷脂酰乙醇胺结合,形成Ⅱ型LC3,Ⅱ型LC3蛋白结合并始终位于胞内自噬体的膜上,其含量与自噬泡数量成正比[17]。Beclin1是酵母ATG6/vps30的同源物,与3-肌醇磷酸3激酶形成复合体参与自噬体形成。Beclin1作为自噬的重要正性调控元件,在淀粉样前体蛋白的调控中发挥作用,其缺失导致AD模型小鼠淀粉肽沉积增多,加重AD的发生发展[18]。本研究发现,黄芩苷处理可升高自噬紧密相关的LC3和Beclin1蛋白表达,提示黄芩苷可能通过自噬的激活清除毒性蛋白,发挥神经保护作用。
[1]Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[2]Mizushima N,Levine B,Cuervo AM,Klionsky DJ. Autophagy fights disease through cellular selfdigestion[J].Nature,2008,451(7182):1069-1075.
[3]Kirkitadze MD,Kowalska A.Molecularmecha⁃nisms initiating amyloid beta-fibril formation in Alzheimer′s disease[J].Acta Biochim Pol,2005,52(2):417-423.
[4]Martinez-Vicente M.Autophagy in neurodegenera⁃tive diseases:From pathogenic dysfunction to therapeutic modulation[J].Semin Cell Dev Biol,2015,40:115-126.
[5]Hu Z,Yang B,Mo X,Xiao H.Mechanism and regulation of autophagy and its role in neuronal diseases[J].Mol Neurobiol,2015,52(3):1190-1209.
[6]Komatsu M,Waguri S,Chiba T,Murata S,Iwata JA,Ueno T,et al.Loss of autophagy in the centralnervous system causes neurodegeneration in mice[J].Nature,2006,441(795):880-884.
[7]Pickford F,Masliah E,Britschgi M,Lucin K,Narasimhan R,Jaeger PA,et al.The autophagyrelated protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice[J].J Clin Invest,2008,118(6):2190-2199.
[8]Salminen A,Kaarniranta K,Kauppinen A,Ojala J,Haapasalo A,Soininen H,et al.Impaired autophagy and APP processing in Alzheimer′s disease:The potential role of Beclin 1 interactome[J].Prog Neurobiol,2013,106-107:33-54.
[9]Chen X,Kondo K,Motoki K,Homma H,Okazawa H. Fasting activates macroautophagy in neurons of Alzheimer′s disease mouse model but is insuffi⁃cient to degrade amyloid-beta[J].Sci Rep,2015,5:12115.
[10]Cheng F,Lu Y,Zhong X,Song W,Wang X,Sun X,et al.Baicalin's therapeutic time window of neuro⁃protection during transient focal cerebral ischemia and its antioxidative effects in vitro and in vivo[J]. EvidBasedComplementAlternatMed,2013,2013:120261.
[11]Zhang L,Xing D,Wang W,Wang R,Du L.Kinetic difference of baicalin in rat blood and cerebral nuclei after intravenous administration of Scutellariae Radix extract[J].J Ethnopharmacol,2006,103(1):120-125.
[12]Lu P,Mamiya T,Lu L,Mouri A,Ikejima T,Kim HC,et al. Xanthoceraside attenuates amyloid β peptide25-35-induced learning and memory impairmentsinmice[J].Psychopharmacology(Berl),2012,219(1):181-190.
[13]Yang R,Chen L,Wang H,Xu B,Tomimoto H,Chen L.Anti-amnesic effectofneurosteroid PREGS in Aβ25-35-injected mice through σ1 receptorand α7nAChR-mediated neuroprotection[J].Neu⁃ropharmacology,2012,63(6):1042-1050.
[14]Mckee AC,Carreras I,Hossain L,Ryu H,Klein WL,Oddo S,et al.Ibuprofen reduces Abeta,hyper⁃phosphorylated tau and memory deficits in Alzheimer mice[J].Brain Res,2008,1207:225-236.
[15]Pyo JO,Yoo SM,Ahn HH,Nah J,Hong SH,Kam TI,et al.Overexpression of Atg5 in mice activates autophagy and extends lifespan[J].Nat Commun,2013,4:2300.
[16]Klionsky DJ,Cuervo AM,Seglen PO.Methods for monitoring autophagy from yeast to human[J]. Autophagy,2007,3(3):181-206.
[17]Klionsky DJ,Abdalla FC,Abeliovich H,Abraham RT,Acevedo-Arozena A,Adeli K,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[18]Jaeger PA,Pickford F,Sun CH,Lucin KM,Masliah E,Wyss-Coray T.Regulation of amyloid precursor protein processing by the Beclin 1 complex[J]. PLoS One,2010,5(6):e11102.
Baicalin attenuates Aβ25-35induced learning and memory disorders in mice and its possible mechanism
XIAO Wan1,CAO Xiao-lu1,2,ZHANG Rong1,GAO Cheng-zhi1,DU Jing1,YIN Ting-zi1, ZHANG Ying1,HONG Xing1,HU Xia-min1,2,REN Bo3
(1.Department of Pharmacy,School of Medicine,2.Cardiovascular and Cerebral Vascular Drug Research Base,3.Department of Basic Medicine,School of Medicine,Wuhan University of Science and Technology,Wuhan 430065,China)
OBJECTIVETo observe the effect of baicalin on Aβ25-35induced learning and memory deficits and changes in autophagy-related genes in mice so as to explore the related mechanisms of Alzheimer disease(AD)treatment.METHODSC57 mice were administered with 3 μL Aβ25-353 mmol·L-1by intracerebroventricular injection to establish an AD model.Baicalin was given by intracerebroventricular injection at the dose of 25,50 and 100 mg·kg-1for 15 d,respectively.The total distance and the central grid residence time were measured in the open-field test.The escape latency and the time to reach the platform were monitored in the Morris water maze trial.The autophagic vacuoles in the hippocampus ofthe mice were observed by transmission electron microscopy before the protein expressions of microtu⁃bule-associated protein 1 light chain 3(LC3)and Beclin1 in brain tissue were analyzed by Western blot⁃ting assay.RESULTSIntracerebroventricular injection of Aβ25-35could reduce the total distance from (3984±321)cm to(2790±306)cm and extend central grid residence time from(3.6±1.2)s to(8.8±2.9)s in the open-field test.The escape latency of water maze also increased from(22.0±1.9)s to(38.8±2.2)s. Autophagic vacuoles or late autophagic vacuoles and increased Beclin1 and LC3 and protein level were observed in the hippocampus after Aβ25-35injection.Intraperitoneal injection of Baicalin 50 and 100 mg·kg-1for fifteen consecutive days extended the total distance in open-field test to(3705±337)cm and(3968±448)cm,respectively,while the central grid residence time was reduced to(5.6±1.8)s and (3.9±1.5)s,respectively.The total time taken to reach the platform in water maze test was reduced to(28.6± 1.9)s,(22.9±1.7)s.Mitochondrial swelling,vacuolar membrane structure or autophagic vacuoles were visible in the hippocampus.LC3 and Beclin1 protein expression was significantly up-regulated(P<0.01).CONCLUSIONBaicalin shows protective effect against Aβ25-35induced learning and memory deficits, and this effect may be related to the activation of autophagy in the mouse hippocampus.
baicalin;Alzheimer disease;autophagy;β-amyloid peptide;learning disorder;memory disorder
s:HU Xia-min,E-mail:huxiaming@163.com,Tel:(027)68862810;REN Bo,E-mail:renb08@sina.com, Tel:(027)68893430
R285.5
A
1000-3002-(2017)01-0059-06
10.3867/j.issn.1000-3002.2017.01.007
2015-10-22接受日期:2016-06-08)
(本文编辑:乔 虹)
国家自然科学基金(31171327)
肖 弯,女,硕士研究生,Tel:(027)68893283,E-mail:xiaowanwust@sina.com;胡霞敏,女,博士,教授,主要从事新药研发与神经药理学研究。
胡霞敏,E-mail:huxiaming@163.com,Tel:(027)68862810;任 波,E-mail:renbo8@sina.com,Tel:(027)68893430
Foundation item:The project supported by National Natural Science Foundation of China(31171327)

