去甲斑蝥素作用早期对人肝癌细胞活性氧及NF-E2相关因子2/抗氧化反应元件信号通路的激活
陈 静,崔宝弟,孙震晓
(北京中医药大学中药学院,北京 100102)
去甲斑蝥素作用早期对人肝癌细胞活性氧及NF-E2相关因子2/抗氧化反应元件信号通路的激活
陈 静*,崔宝弟*,孙震晓
(北京中医药大学中药学院,北京 100102)
目的探究去甲斑螯素(NCTD)诱导人肝癌HepG2细胞凋亡及G2/M期阻滞的早期事件,分析NCTD作用早期HepG2细胞内活性氧自由基(ROS)的变化规律及NCTD对NF-E2相关因子/抗氧化反应元件(Nrf2/ARE)信号通路的影响。方法NCTD30,60和120 μmol·L-1分别作用于体外培养的人肝癌HepG2细胞3,6,12,24,48和72 h,MTT法检测NCTD对细胞存活的影响;流式细胞术检测NCTD 60 μmol·L-1作用细胞12,24和48 h对细胞周期和细胞凋亡的影响;DCFH-DA探针结合流式细胞术检测NCTD 30,60和120 μmol·L-1作用于3,6和12 h对HepG2细胞内ROS的影响;荧光素酶法测定NCTD同时转染ARE和荧光素酶报告基因的HepG2C8细胞的荧光强度;实时荧光定量PCR检测对血红素氧合酶-1(HO-1)和醌氧化还原酶-1(NQO1)mRNA表达的影响。结果NCTD 30,60和120 μmol·L-1作用3和6 h对HepG2细胞存活无明显影响,而作用24,48和72 h对HepG2细胞有明显生长抑制作用(P<0.01);NCTD 60 μmol·L-1作用12 h后可诱导HepG2细胞发生凋亡及G2/M期阻滞,12,24和48 h凋亡细胞比例分别由12 h细胞对照组(4.00±1.98)%增加到(12.10±1.70)%,24 h对照组(4.05±0.21)%增加到(31.80± 6.50)%,48 h对照组(3.90±0.85)%增加到(33.30±1.41)%;12,24和48 h G2/M期细胞比例分别由12 h对照组的(16.51±1.58)%增加到(40.89±0.18)%,24 h对照组的(16.99±1.32)%增加到(55.29±3.99)%,48 h对照组的(14.45±0.59)%增加到(50.66±5.88)%,相应各时相NCTD处理组G1期细胞比例明显下降(P<0.01);NCTD 30,60和120 μmol·L-1作用HepG2细胞3,6和12 h,ROS无明显变化,作用HepG2C8细胞6和12 h可明显激活Nrf2/ARE信号通路,下游基因HO-1和NQO1 mRNA表达显著上调(P<0.05)。结论NCTD作用HepG2细胞早期可明显激活Nrf2/ARE信号通路;ROS激活可能不是NCTD诱导人肝癌HepG2细胞凋亡及G2/M期阻滞的主要原因。
去甲斑蝥素;细胞凋亡;细胞周期;Nrf2/ARE信号通路;活性氧自由基;血红素加氧酶-1;NAD(P)H:醌氧化还原酶-1
去甲斑蝥素(norcantharidin,NCTD)是我国自主研发的一种新型抗肿瘤药物,兼有抗肿瘤和升高外周血白细胞的作用,近年来主要用于消化道肿瘤和肺癌的治疗,其中对肝癌的治疗效果最好[1],也可与其他化疗药物联用来提高疗效、减少副作用[2]。尽管有关NCTD抗癌活性研究已经有不少报道[3-8],但对其细胞毒作用的早期事件仍缺乏研究。
研究表明,高浓度活性氧(reactive oxygen species,ROS)或低浓度ROS长时间作用于细胞,均可导致细胞周期阻滞[9]或细胞凋亡[10],而低浓度ROS短期作用可以引起细胞产生氧化应激,激活NF-E2相关因子2/抗氧化反应元件(NF-E2-related factor 2/ antioxidant response element,Nrf2/ARE)信号通路[11],Nrf2/ARE信号通路在机体抵抗内外氧化和化学刺激等方面均发挥重要作用。本研究主要在NCTD体外作用人肝癌HepG2细胞的时效、量效关系基础上,进一步探索NCTD对细胞内ROS及细胞氧化应激信号通路Nrf2/ARE的影响,进一步揭示NCTD的抗癌机制。
1 材料与方法
1.1 试剂和药品
1640培养基,胎牛血清,MEM非必需氨基酸购自美国Gibco公司;Trizol Reagent购自美国Invitrogen公司;无RNA酶水购自美国AMERESCO公司;PrimeScriptTM1ststrand cDNA Synthesis试剂盒购自日本TaKaRa公司;PCR引物购自生工生物工程(上海)股份有限公司;细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;RNA酶抑制剂购自美国Promega公司;DCFH-DA探针购自美国Sigma公司。
1.2 主要仪器
低温高速台式离心机购自美国Kendro仪器公司,小动物活体成像仪购自美国Caliper公司,荧光定量PCR(qRT-PCR)仪购自日本Bio-Rad公司,流式细胞仪购自美国Becton Dickinson公司,微量RNA浓度检测仪购自美国Biotek公司。
1.3 细胞系
人肝癌HepG2细胞,北京中医药大学生物制药实验室冻存;HepG2C8细胞为转染了抗氧化元件ARE和荧光素酶基因的HepG2细胞,由北京大学医学部余四旺老师惠赠。
1.4 细胞培养
HepG2细胞用含10%(V/V)胎牛血清,1%双抗(青霉素100 U·mL-1和链霉素100 μg·mL-1)的RPMI 1640培养基,在37℃,5%CO2的饱和湿度培养箱中培养,2~3 d换液传代1次。取对数生长期细胞为实验对象。HepG2C8细胞培养参照文献[12-13],用含10%(V/V)胎牛血清,1%双抗,1% MEM非必需氨基酸的RPMI 1640培养基,在37℃,5%CO2的饱和湿度细胞培养箱中培养,2~3 d换液传代1次。取对数生长期细胞为实验对象。
1.5 MTT法检测细胞存活
将HepG2细胞以每孔2×103的密度铺于96孔板中,培养24 h后用NCTD 30,60和120 μmol·L-1处理。每个浓度设置8个平行孔,细胞对照组的孔内加入正常培养基作为对照。分别于3,6,12,24,48和72 h加入终浓度为0.5 g·L-1的MTT继续孵育4 h后,吸去孔内MTT。每孔加入150 μL DMSO,置微量振荡器上振荡10 min,在酶标仪570 nm波长处读取吸光度值(A),并计算NCTD对HepG2细胞的增殖抑制率(%)。抑制率(%)=(1-加药组A570nm/对照组A570nm)×100%。
1.6 流式细胞仪检测细胞凋亡与周期
将HepG2细胞以每孔6×104的密度铺于6孔板中,24 h后用NCTD 60 μmol·L-1处理12,24和48 h后,收集每个孔中的全细胞,每个时间点设置3个平行对照,实验完全独立得重复3次。细胞对照组细胞加入正常培养基作为对照。按说明书用流式细胞仪检测细胞凋亡和周期变化。
1.7 细胞内ROS水平检测
将HepG2细胞以每孔3×105的密度接种于6孔板中,24 h后实验组换含浓度分别为NCTD30,60和120 μmol·L-1的完全培养基,细胞对照组细胞加入正常培养基作为对照。分别于3,6和12 h后收集每个孔中的全细胞,加入终浓度为100 μmol·L-1的DCFH-DA探针溶液黑暗孵育30 min后,洗去多余的探针,用流式细胞仪在488 nm激发波长,525 nm发射波下检测荧光强度[14-15],荧光强度数值与ROS水平成正相关关系。每个时间点、每个浓度设置3个平行对照。
1.8 荧光素酶法检测HepG2C8细胞荧光强度
将转染ARE及荧光素酶报告基因的HepG2细胞HepG2C8细胞以每孔1×104的密度常规接种于96孔板中,24 h后实验组换含浓度分别为NCTD 30,60和120 μmol·L-1的完全培养基,叔丁基对苯二酚(tert-butylhydroquinone,tBHQ)为Nrf2的激活剂,以tBHQ为阳性药,分别在3,6和12 h时,在96孔板中添加100 μL用PBS稀释的荧光素酶底物,立即用小动物成像仪检测96孔板中每个孔的总荧光强度。
1.9 qRT-PCR技术检测血红素加氧合酶-1(heme oxygenase-1,HO-1)、NAD(P)H:醌氧化还原酶-1〔NAD(P)H:quinoneoxidoreductase 1,NQO1〕mRNA的表达
将HepG2细胞以每孔3×105的密度接种于6孔板中,24 h后实验组换含浓度分别为NCTD 30,60和120 μmol·L-1的完全培养基,分别在3,6和12h后收集每个孔中全细胞,按照Trizol说明书提取RNA,合成cDNA;实时qRT-PCR的反应条件:95℃,10 min;95℃,15 s;60℃,1 min,共40个循环,以β肌动蛋白为内参,2-ΔΔCt法计算mRNA的相对表达水平。qRT-PCR引物见表1。
1.10 统计学分析

Tab.1 Prime sequence of qRT-PCR
2 结果
2.1 去甲斑蝥素对HepG2细胞存活的影响
NCTD 30,60和120 μmol·L-1在3和6 h内,NCTD 30和60 μmol·L-1在12 h内对HepG2细胞生长无明显抑制作用;NCTD 120 μmol·L-1作用12 h、NCTD 30,60和120 μmol·L-1作用24,48和72 h对HepG2细胞生长有明显抑制作用(P<0.01),抑制作用与用药浓度及时间呈正比(图1)。3,6,12,24,48和72 h的浓度效应相关系数分别为0.479,0.544,0.892(P<0.01),0.797(P<0.01),0.900(P<0.01)和0.941(P<0.01)。30,60和120 μmol·L-1的时间效应相关系数分别为0.829(P<0.01),0.899(P<0.01)和0.933(P<0.01)。
NCTD对HepG2细胞存活的影响发现,NCTD 30,60和120 μmol·L-1分别作用3,6和12 h,除120 μmol·L-1作用12 h对HepG2细胞生长有一定抑制作用外,其他作用浓度和时间对该细胞生长均无明显抑制作用,故选择NCTD 30,60和120 μmol·L-1作用3,6和12 h研究其对HepG2细胞内ROS含量的影响。
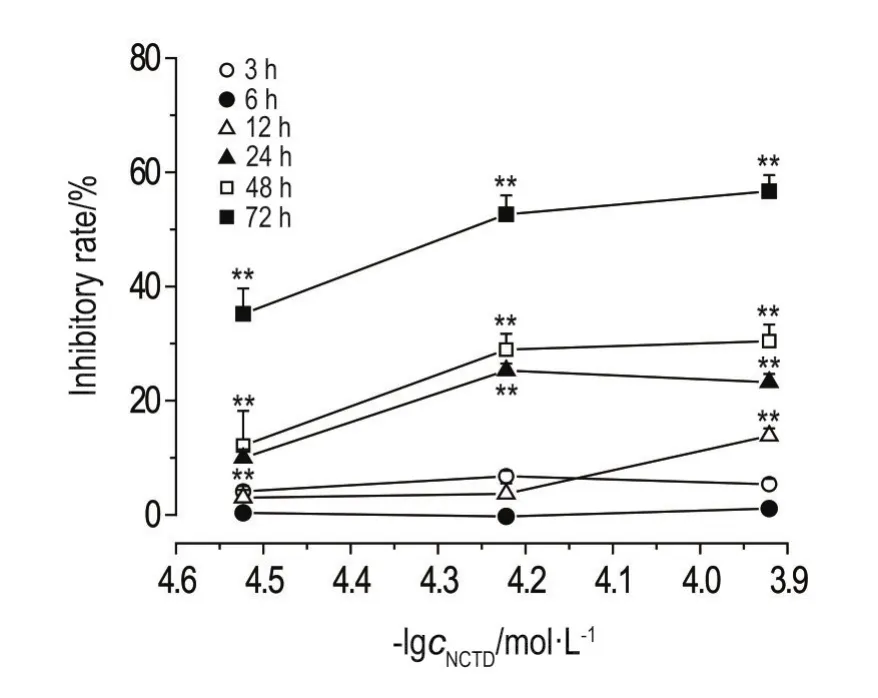
Fig.1 Inhibitory rate of norcantharidin(NCTD)on HepG2 cells for 3-72 h by MTT assay.,n=3.**P<0.01,compared with cell control group.The inhibitory rate of cell control was taken as 0%.
2.2 去甲斑蝥素对HepG2细胞凋亡的影响
流式结果(图2)显示,NCTD 60 μmol·L-1作用HepG2细胞12 h即可以检测到明显的细胞凋亡,12,24和48 h凋亡细胞比例分别由12 h由细胞对照组的(4.00±1.98)%增加到NCTD 60 μmol·L-1组的(12.10±1.70)%(P<0.05),24 h细胞对照组的(4.05±0.21)%增加到NCTD 60 μmol·L-1组的(31.80±6.50)%(P<0.01),48 h细胞对照组的(3.90±0.85)%增加到NCTD 60 μmol·L-1组的(33.30±1.41)%(P<0.01)。
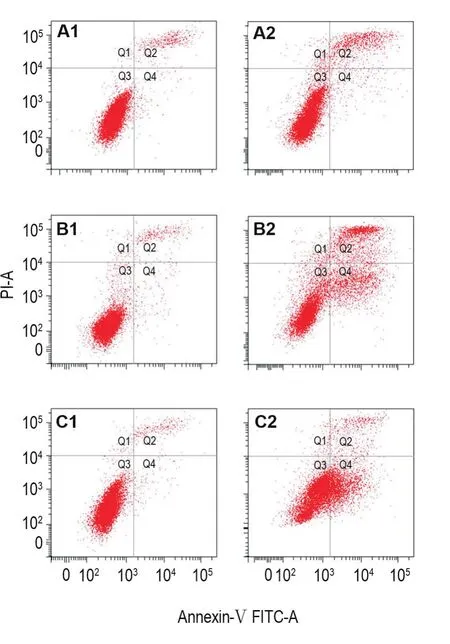
Fig.2Apoptosis of HepG2 cells induced by NCTD detected by flow cytometry analysis.A1:cell control group for 12 h;B1:cell control group for 24 h;C1:cell control group for 48 h;A2:NCTD 60 μmol·L-1for 12 h;B2:NCTD 60 μmol·L-1for 24 h;C2:NCTD 60 μmol·L-1for 48 h.
2.3 去甲斑蝥素对HepG2细胞周期的影响
如流式结果(图3)所示,NCTD 60 μmol·L-1处理HepG2细胞12 h即诱导细胞发生明显的G2/M期阻滞,由细胞对照组的(16.51±1.58)%增加到NCTD 60 μmol·L-1组的(40.89±0.18)%(P<0.01),24 h由细胞对照组的(16.99±1.32)%增加到NCTD 60 μmol·L-1组的(55.29±3.99)%(P<0.01),48 h由细胞对照组的(14.45±0.59)%增加到NCTD 60 μmol·L-1组的(50.66±5.88)%(P<0.01)。
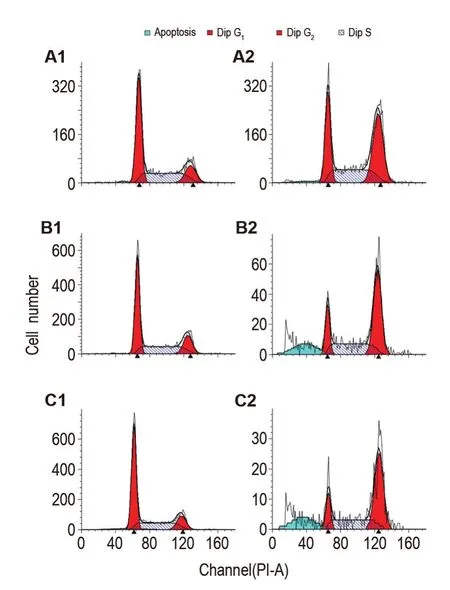
Fig.3 Cell cycle of HepG2 cells induced by NCTD. A1:cell control group for 12 h;B1:cell control group for 24 h;C1;cell control group for 48 h;A2:NCTD 60 μmol·L-1for 12 h;B2:NCTD 60 μmol·L-1for 24 h;C2:NCTD 60 μmol·L-1for 48 h.
2.4 去甲斑蝥素对HepG2细胞内ROS含量的影响
NCTD在所选浓度范围内作用HepG2细胞3~12 h,对细胞ROS含量的影响无统计学意义(图4)。
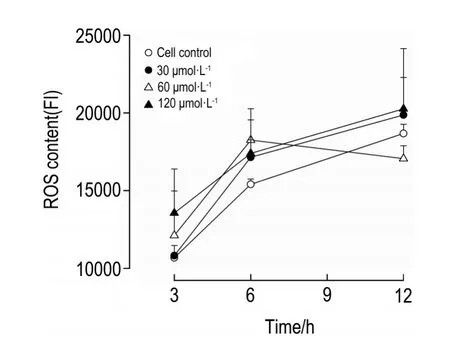
Fig.4 Effect of NCTD on reactive oxygen species(ROS)content in HepG2 cells.FI:fluorescence intensity.
2.5 去甲斑蝥素对HepG2C8细胞中Nrf2/ARE信号通路的激活作用
NCTD 30 μmol·L-1作用6和12 h对HepG2C8细胞中ARE均有显著激活作用(P<0.05,P<0.01),NCTD 60和120 μmol·L-1在3,6和12 h内对HepG2C8细胞中ARE均有明显激活作用(P< 0.05,P<0.01)。随着NCTD浓度的增加,同一时间点激活作用逐渐增强。与细胞对照组相比,NCTD 60 μmol·L-1作用6 h对ARE的激活作用达到1.7倍,NCTD 120 μmol·L-1作用6和12 h对ARE的激活作用分别达到3.3和5.4倍(图5)。
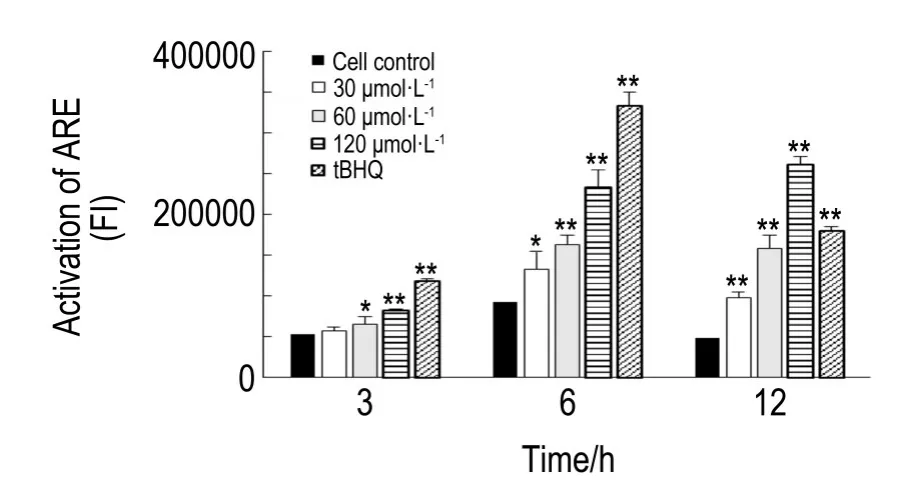
Fig.5 Effect of NCTD on activation of ARE in epG2C8 cells trasfected with ARE and luciferase report gene in HepG2 cells.tBHQ:tert-butylhydroquinone,positive control.n=3.*P<0.05,**P<0.01,compared with cell control group.
2.6 去甲斑蝥素对HO-1和NQO1 mRNA表达的影响
与细胞对照组比较,NCTD30,60和120μmol·L-1作用HepG2细胞3 h对HO-1和NQO1 mRNA表达无明显影响,作用6 h,对HO-1和NQO1 mRNA表达均有明显激活作用(对HO-1 mRNA表达激活分别为P<0.05,P<0.05,P<0.01;对NQO1 mRNA表达激活均为P<0.01),作用12 h仍保持明显激活作用(对HO-1 mRNA表达激活分别为P<0.05,P<0.01,P<0.01;对NQO1 mRNA表达激活分别为P<0.05,P<0.05,P<0.01),HO-1mRNA表达与6 h基本持平(30 μmol·L-1)或显著增强(60和120 μmol·L-1)(均P<0.01),而NQO1 mRNA的表达12 h比6 h明显减弱(30 μmol·L-1)(P<0.01)(图6)。
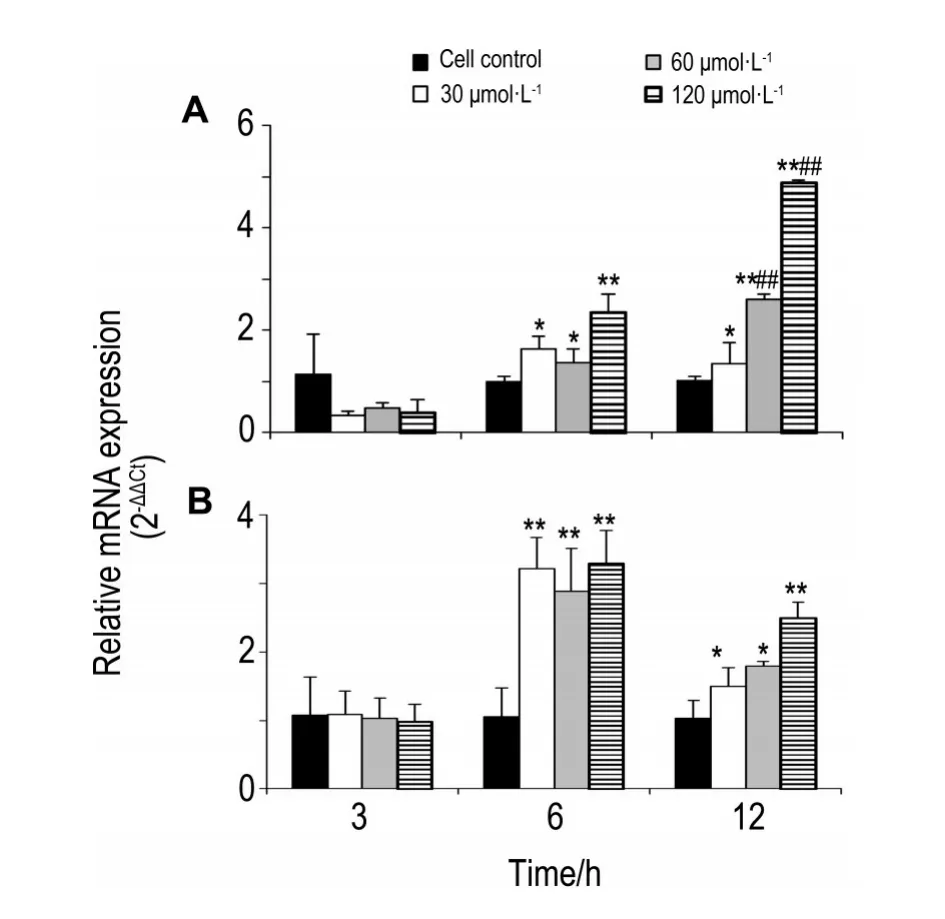
Fig.6 Effect of NCTD on mRNA expression of heme oxygenase-1(HO-1)(A)and NAD(P)H:quinoneoxido⁃reductase 1(NQO1)(B)in HepG2 by qRT-PCR.*P<0.05,**P<0.01,compared with cell control group;##P<0.01,compared with corresponding 6 h treatment group.
3 讨论
本研究结果表明,NCTD在一定作用时间和浓度下对HepG2细胞存活有明显抑制作用,且抑制效果与药物作用时间和浓度成正相关。从NCTD对HepG2细胞凋亡和周期的影响可见,HepG2细胞在NCTD作用12 h后发生明显的G2/M期阻滞及凋亡,因而探究发生在NCTD作用HepG2细胞12 h内的早期生物学事件对理解NCTD诱导细胞凋亡和G2/M期阻滞有重要价值。
曾有报道,NCTD可以促进肿瘤细胞ROS的产生并进一步引起细胞凋亡[19-20],但本研究通过流式细胞术检测发现,NCTD 30~120 μmol·L-1作用3~12 h对HepG2细胞中ROS水平无明显影响,推测这个阶段ROS产生可能不是NCTD诱导人肝癌HepG2细胞凋亡及G2/M期阻滞的主要原因,NCTD对肿瘤细胞内ROS水平的影响可能受细胞系[19]及ROS分析方法的影响[20],目前研究数据虽不支持细胞内ROS激活与NCTD诱导细胞凋亡与周期阻滞有正相关性,但不排除NCTD作用肿瘤细胞更早期时产生的ROS已打开细胞凋亡或周期阻滞相关信号通路,二者的关系尚需进一步研究。我们在NCTD对其他肿瘤细胞的抑制作用中曾发现,NCTD对肿瘤细胞中微管的聚合有明显的抑制作用[21-22],推测NCTD直接作用于细胞骨架等结构继而引起细胞周期阻滞或凋亡在NCTD诱导HepG2细胞周期阻滞和凋亡中占主要地位。
本研究根据Nrf2/ARE信号通路激活机制,用转染了ARE的HepG2C8细胞作为实验工具,检测NCTD对Nrf2/ARE信号通路的激活作用。结果显示,在12 h内,NCTD 30,60和120 μmol·L-1有明显激活Nrf2/ARE信号通路的作用,且激活效率有一定浓度依赖性。已知细胞内ROS可以作为第二信使激活Nrf2/ARE抗氧化信号通路[23],在本研究观察时间内虽然未检测到NCTD对HepG2细胞内ROS水平的影响,NCTD对HepG2细胞内Nrf2/ ARE信号通路的激活仍有可能与更早期的ROS产生有关。有研究表明,Nrf2/ARE信号通路与肿瘤细胞的耐药性密切相关[24],Nrf2/ARE抗氧化信号通路的激活可以抵抗细胞内ROS的过量生成,若ROS与NCTD的抗肿瘤作用相关,Nrf2/ARE信号通路抑制剂与NCTD联合用药可能会增强NCTD的抗肿瘤作用,需进一步开展联合用药及效果评估研究。另外,大量研究表明,细胞的转化及恶性肿瘤的发生与转移与细胞内ROS的产生有关[25],NCTD可以激活Nrf2/ARE信号通路,为NCTD作为一种癌症预防药物的研发提供了思路。
[1]Pan CY,Gu XG.Research advance in effective mechanisms of norcantharidin in anti-liver cancer[J].J Mod Oncol(现代肿瘤医学),2015,23(4):575-577.
[2]Li ZY,Ma QT,Zhang Y,Wang XC,Liu YL. Gemcitabine and cisplatin combined with norcan⁃tharidin sodium for the treatment of advanced NSCLC[J].Chin J Cancer Prev Treat(中华肿瘤防治杂志),2014,21(4):293-295.
[3]Peng C,Li Z,Niu Z,Niu W,Xu Z,Gao H,et al. Norcantharidin suppresses colon cancer cell epithelialmesenchymal transition by inhibiting the αvβ6-ERKEts1 signaling pathway[J].Sci Rep,2016,6:20500.
[4]Hsieh CH,Chao KS,Liao HF,Chen YJ.Nocantharidin,derivative of cantharidin,for cancer stem cells[J].Evid Based Complement Alternat Med,2013,2013:838651.
[5]Li XP,Jing W,Sun JJ,Liu ZY,Zhang JT,Sun W,etal.A potential small-molecule synthetic anti⁃lymphangiogenic agent norcantharidin inhibits tumor growth and lymphangiogenesis of human colonic adenocarcinomas through blocking VEGF-A,-C,-D/ VEGFR-2,-3″multi-points priming″mechanisms in vitro and in vivo[J].BMC Cancer,2015,15:527.
[6]Wu Y,Cao CM,Wang HQ,Li ZM,Sun ZX.Nor⁃cantharidin downregulates programmed cell death 4 expression in human gastric cancer cells[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(4):622-628.
[7]Cui BD,Wang M,Sun ZX.The inhibition of norcantharidin on human lung adenocarcinoma A549 cells[J].Carcinog Teratog Mutag(癌变·畸变·突变),2015,27(1):21-25.
[8]Li ZM,Sun ZX.The effect and the synergistic mechanism of irinotecan combined with norcan⁃tharidin in human gastric cancer cell line BGC-823[J].Prog Biochem Biophys(生物化学与生物物理进展),2015,42(2):169-181.
[9]Lin SS,Huang HP,Yang JS,Wu JY,Hsia TC,Lin CC,et al.DNA damage and endoplasmic retic⁃ulum stress mediated curcumin-induced cell cycle arrest and apoptosis in human lung carcinoma A-549 cells through the activation caspases cascadeand mitochondrial-dependent pathway[J].Cancer Lett,2008,272(1):77-90.
[10]Liao YH,Tang Y,Qian NS,Dou KF.Oxidative stress and cell apoptosis[J].J Xinxiang Med Univ(新乡医学院学报),2011,28(1):110-113.
[11]Wang N,Ma HP,Qi XZ,Meng P,Jia ZP.Pro⁃gression of Nrf2-ARE signaling pathway in protection of oxidative stress injury of the body[J].Med Pharm J Chin PLA(解放军医药杂志),2015,27(12):21-27.
[12]Hagos GK,Abdul-Hay SO,Sohn J,Edirisinghe PD,Chandrasena RE,Wang Z,et al.Anti-inflammatory,antiproliferative,and cytoprotective activity of NO chimera nitrates of use in cancer chemoprevention[J].Mol Pharmacol,2008,74(5):1381-1391.
[13]Xi MY,Jia JM,Sun HP,Sun ZY,Jiang JW,Wang YJ,et al.3-Aroylmethylene-2,3,6,7-tetra⁃hydro-1H-pyrazino[2,1-a]isoquinolin-4(11bH)-ones as potent Nrf2/ARE inducers in human cancer cells and AOM-DSS treated mice[J].J Med Chem,2013,56(20):7925-7938.
[14]Huang QT,Chen JH,Hang LL,Liu SS,Zhong M. Activation of PAR-1/NADPH oxidase/ROS signaling pathways is crucial for the thrombin-induced sFlt-1 production in extravillous trophoblasts:possible involvement in the pathogenesis of preeclampsia[J].Cell Physiol Biochem,2015,35(4):1654-1662.
[15]Liu D,Shi P,Yin X,Chen Z,Zhang X.Effect of norcantharidin on the human breast cancer Bcap-37 cells[J].Connect Tissue Res,2012,53(6):508-512.
[16]Maiese K.Environmental stimulus package:poten⁃tial for a rising oxidative deficit[J].Oxid Med Cell Longev,2009,2(4):179-180.
[17]Jorgensen ED,Zhao H,Traganos F,Albino AP,Darzynkiewicz Z.DNA damage response induced by exposure of human lung adenocarcinoma cells to smoke from tobacco-and nicotine-free cigarettes[J].Cell Cycle,2010,9(11):2170-2176.
[18]Cai R,Bu JG,Xu JJ,Zheng JF,Zhang JR.Recent progress in the molecular carcinogenic mechanism of heavy metal exposure[J].Med Recapitulate(医学综述),2014,20(10):1786-1789.
[19]Shen B,He PJ,Shao CL.Norcantharidin induced DU145 cell apoptosis through ROS-mediated mito⁃chondrial dysfunction and energy depletion[J]. PLoS One,2013,8(12):e84610.
[20]Chang C,Zhu YQ,Mei JJ,Liu SQ,Luo J.Involve⁃ment of mitochondrial pathway in NCTD-induced cytotoxicity in human hepG2 cells[J].J Exp Clin Cancer Res,2010,29(1):145.
[21]Hong XF,Li BS,Sun ZX.Inhibitory effect of nor⁃cantharidin on tubulin polymerization in vitro[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(5):630-634.
[22]Li RJ,Hong XF,Ji YY,Sun ZX.Norcantharidin induced mitotic arrest and apoptosis in human ovarian cancer SK-OV-3 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(2):180-186.
[23]Chen N,Hu R,Guo QL.Role of Nrf2 in chemopre⁃vention of cancer[J].Pharm Biotech(药物生物技术),2010,17(5):452-456.
[24]Jaramillo MC,Zhang DD.The emerging role of the Nrf2-Keap1 signaling pathway in cancer[J].Genes Dev,2013,27(20):2179-2191.
[25]Xiong SS,Shi YY,Shi HP.Research status of reactive oxygen species and tumor[J].Chin J Caner Prev Treat(中华肿瘤防治杂志),2014,21(13):1045-1048.
Early events of norcantharidin reactive oxygen species and NF-E2-related factor 2/antioxidant response element pathway of HepG2 cells
CHEN Jing*,CUI Bao-di*,SUN Zhen-xiao
(College of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China)
OBJECTIVETo investigate the early events of norcantharidin(NCTD)induced cell apoptosis and cell cycle arrest,the variation of reactive oxygen species(ROS)and the NF-E2-relate⁃dactor 2/antioxidant response element(Nrf2/ARE)pathway in human HepG2 cells.METHODSThe cyto⁃toxicity was measured by MTT assay.Apoptosis and cell cycle was analyzed by flow cytometry.The intra toxicity ROS production was evaluated by flow cytometry analysis with DCFH-DA probe and the effect of NCTD on Nrf2/ARE pathway was detected by luciferase assay in HepG2C8 cells under the same condition. The mRNA expression of heme oxygenase-1(HO-1)and NAD(P)H:quinone oxidoreductase 1(NQO1) antioxidase gene in Nrf2/ARE pathway downstream was evaluated by quantitative real-time PCR.RESULTSNo significant cytotoxicity was detected after HepG2 cells were treated with NCTD 30,60 and 120 μmol·L-1for 3 and 6 h,but cellular viability was inhibited significantly by NCTD 30,60 and 120 μmol·L-1for 24,48 and 72 h(P<0.01).Cell apoptosis and G2/M phase arrest occurred after HepG2 cells were treated with NCTD 60 μmol·L-1for 12,24 and 48 h.The percentage of apoptosis increased from(4.00±1.98)%to(12.10±1.70)%for 12 h,from(4.05±0.21)%to(31.8±6.50)%for 24 h,and from (3.90±0.85)%to(33.30±1.41)%for 48 h,respectively.The percentage of G2/M phase increased from (16.51±1.58)%to(40.89±0.18)%for 12 h,from(16.99±1.32)%to(55.29±3.99)%for 24 h,and from (14.45±0.59)%to(50.66±5.88)%for 48 h,respectively.Compared with cell control group,the percentage of G1phase had a significant decrease in the group with NCTD treated at different time points(P<0.01).No significant change in ROS in HepG2 cells was detected after the treatment with NCTD 30,60 and 120 μmol·L-1for 3,6 and 12 h.Nrf2/ARE pathway in HepG2C8 cells was activated by NCTD 30,60 and 120 μmol·L-1for 6 and 12 h.mRNA expression of HO-1 and NQO1 had a signifi⁃cant activation in HepG2 cells after treatment with NCTD 30,60 and 120 μmol·L-1for 6 and 12 h(P<0.05).CONCLUSIONNCTD can activate Nrf2/ARE pathway in the early stage in HepG2 cells,which may inhibit the intracellular ROS production in the early stage.Activation of ROS may not be the main event in NCTD induced HepG2 cell apoptosis and G2/M phase arrest.
norcantharidin;apoptosis;cell cycle;Nrf2-ARE pathway;reactive oxygen species; heme oxygenase-1;NAD(P)H:quinone oxidoreductase 1
SUN Zhen-xiao,E-mail:sunzxcn@hotmail.com,Tel:(010)84738646
R285.5,R979.1
A
1000-3002-(2017)01-0094-07
10.3867/j.issn.1000-3002.2017.01.012
2016-05-03接受日期:2016-09-18)
(本文编辑:乔 虹)
国家自然科学基金项目(81473418);国家林业局野生动植物保护项目(2012-2016)
陈 静,女,硕士研究生,主要从事中药分子细胞药理学与毒理学研究,E-mail:476494894@qq.com,Tel:(010)84738646;崔宝弟,女,硕士研究生,主要从事中药及其有效成分抗肿瘤分子细胞药理学研究,Tel:(010)84738646,E-mail:1293772869@qq.com
孙震晓,E-mail:sunzxcn@hotmail.com,Tel:(010)84738646
*共同第一作者。
Foundation item:The project supported by National Natural Science Foundation of China(81473418);and Wildlife Protection Project of the State Forestry Administration(2012-2016)
*Co-first author.

