藤黄酸的心脏毒性及其基于细胞表型的多指标量化表征
祝 婕,王 萌,朱 彦
(1.天津中医药大学天津市现代中药重点实验室,省部共建国家重点实验室培育基地,天津 300193;2.天津国际生物医药联合研究院中药新药研发中心,天津 300457)
藤黄酸的心脏毒性及其基于细胞表型的多指标量化表征
祝 婕1,2,王 萌1,2,朱 彦1,2
(1.天津中医药大学天津市现代中药重点实验室,省部共建国家重点实验室培育基地,天津 300193;2.天津国际生物医药联合研究院中药新药研发中心,天津 300457)
目的建立基于细胞表型心脏毒性多指标同步量化表征方法,评价广谱抗癌药藤黄酸的心脏毒性。方法采用H9c2心肌细胞系,以多柔比星(Dox)和胺碘酮(Ami)为阳性药对照,1‰DMSO为溶剂对照组,次乌头碱为阴性对照组,应用高内涵分析多通道活细胞成像,收集细胞形态变化以及各指标探针的荧光强度,考察1×10-14~1×10-8mol·L-1浓度范围药物对心肌细胞存活率、细胞核、线粒体形态和功能及胞内钙离子含量的影响,以药物半数有效量(EC50)判断药物对心肌细胞影响程度,以Z′值判断所建方法的精密度和假阳性率。结果Dox降低细胞数,导致细胞核胀大,线粒体质量增加,EC50分别为0.72,0.014和1.21 μmol·L-1,且在浓度为10 μmol·L-1时导致胞内钙稳态失衡。Ami导致心肌细胞数下降,细胞核缩小及线粒体质量减少,EC50值分别为14.83,6.72和4.54 μmol·L-1,高通量筛选Z′值平均为0.5。次乌头碱对心肌细胞的细胞核和胞内钙离子含量无影响,但改变了线粒体的纹理,纹理分析值降低。藤黄酸对心肌细胞有严重的杀伤作用,使细胞存活率下降,细胞核减小以及胞内钙离子浓度降低,EC50分别为0.24,1.16和0.41 μmol·L-1。藤黄酸使线粒体质量降低,线粒体纹理数值降低以及线粒体面积增加,EC50分别为1.21,0.99和0.44 μmol·L-1。结论使用高内涵分析多通道活细胞成像技术所评价的阳性药EC50效量和现有报道接近;多指标同步量化对藤黄酸的心脏毒性进行了较为全面的分析,并对其毒性作用机制做出初步的判断。
心脏毒性;藤黄酸;H9c2细胞;高内涵筛选
目前,抗癌药物引起引起的心脏毒性成为重点关注问题,蒽环类药物如多柔比星(doxorubicin,Dox)和柔红霉素等对心肌的主要毒性反应的细胞表征为诱导细胞死亡,线粒体DNA损伤,线粒体功能失常以及胞内钙稳态失衡。蒽环类药物在临床使用中因出现严重心脏毒性反应而被撤市或限制使用[1-2]。BCR-ABL酪氨酸激酶小分子抑制剂(small molecule tyrosine kinase inhibitors,小分子TKI)如伊马替尼、达沙替尼和尼洛替尼等通过激活内质网的压力反应诱导心肌细胞凋亡[3]。另一类产生心脏毒性的药物为治疗心脏疾病的药物,如第三类治疗心律失常药盐酸胺碘酮(amiodarone,Ami),已被美国FDA列入心脏毒性的名单中。因此,药物的临床前心脏毒性安全性评价及预测不仅减少不必要的经济和资源的浪费,而且也可为安全用药提供实验数据支持。
藤黄(gamboge)为藤黄科植物藤黄(Garcinia hanburyiHook.F.)分泌的干燥树脂,其中藤黄酸是其主要有效成分[4]。藤黄酸已被开发为一种广谱抗肿瘤药,对多种肿瘤有显著疗效,如对人肝癌细胞株的增殖有明显的抑制作用,还可明显抑制胃腺癌细胞株的增殖[3]。藤黄酸可通过诱导细胞凋亡、阻滞细胞周期进程、抑制癌细胞转移和抑制血管生成等多方面机制达到抗癌效果[5]。现有安全性评价研究表明,藤黄酸具有肾毒性和肝毒性[6]。藤黄酸为具潜力的抗癌药物,其心脏毒性的评价也是必要的。因此,本实验旨在建立量化多重评价心脏毒性的指标,并基于细胞表型综合评价藤黄酸对心脏的毒性作用。
心脏毒性可发展为急性、亚急性和慢性疾病。临床上急性和亚急性心脏毒性的特点为心室负极化的异常表现、QT间期延长、室上性以及室性心律失常。慢性心脏毒性表现为心脏无症状收缩和左心室舒张功能异常[7]。细胞水平的急性心脏毒性则表现为心肌细胞迅速死亡。但是在较温和的环境刺激下形成的早期应答反应是胞内钙稳态的失衡,但这个过程是可逆的。心脏如受长期毒性刺激,则诱发心肌肥厚,进而导致不可逆的心肌病,最终将使患者心力衰竭。心衰是心肌细胞大量死亡造成的结果,其中包括细胞凋亡和坏死。导致心肌死亡的分子通路有很多,包括细胞因子的活化、线粒体诱导细胞凋亡、胞内Ca2+超载及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的活化等通路[8]。高内涵提供了一个灵敏精确的方法检测这些指标在细胞表型的微弱变化。但这些变化却不被电生理或其他传统的体外方法所发现[9]。体内模型虽仍然是最被广泛认可的检测方法,但存在低通量,高投入的弊端,并对人体的生理反应的预测能力有限,这导致动物模型在毒理学研究中的应用减少[10-13],而高内涵细胞影像技术则越来越被重视和应用[14]。例如,利用探针观察四重荧光标记的细胞核、线粒体膜电位、质膜完整性和胞内钙离子浓度的变化,可从多参数细胞表型变化验证已知心肌毒性的药物有Dox、抗霉素A、Ami、双氯芬酸、齐多夫定和硝苯地平对CytivaTM心肌细胞的毒性影响,以及不同药物的不同影响效果[9]。此外,以细胞活力、线粒体完整性及活性氧(reactive oxygen species,ROS)的生成量为指标的高内涵检测方法等都得到了业界的认可和应用[14]。因此基于以上方法我们建立了一个以H9c2,一种来源于胚胎期BD1X大鼠心脏组织的亚克隆细胞系为模型,表现出骨骼肌细胞特性[15]。Hoechst33342标记细胞核用于测量细胞数和细胞核面积,MitoTracker Deep Red FM标记线粒体表示线粒体质量,Fluo4 AM用来表示胞内钙离子含量等。Z’值代表评价方法本身的可信度,阳性对照组提供最大响应信号,阴性对照组给出最小响应信号,通过两者的平均值和标准差值决定了评价方法检测信号的动态范围,Z’值≥0.5表示信号范围较大,评价方法可靠[16]。本研究采用高内涵综合量化方法来评价藤黄酸对心肌细胞的毒性作用。
1 材料与方法
1.1 药物、试剂和仪器
H9c2心肌细胞,中国科学院典型培养物保藏委员会上海细胞库;DMEM高糖培养基和胰蛋白酶(含EDTA),美国Gibco公司;胎牛血清和青链霉素,美国HyClone公司;Dox和Ami,美国Sigma公司;次乌头碱和藤黄酸,天津中医药中药重点实验室;DMSO,中国北京索莱宝科技有限公司;荧光探针Hoechst 33342和MitoTracker Deep Red FM,美国Invitrogen公司,Rhod2 AM探针和Fluo-4 AM荧光探针,日本同仁公司。细胞培养瓶,96孔透底黑板和1.5 mL EP管,美国Corning公司。IL-161HI⁃CO2恒温培养箱,中国施都凯仪器设备有限公司;Operetta高内涵筛选系统;美国PerkinElmer仪器有限公司。
1.2 细胞培养和传代
H9c2细胞用含10%胎牛血清、青霉素100 kU·L-1、链霉素100 mg·L-1以及pH 7.2的DMEM高糖培养基培养,置于37℃,5%CO2恒温培养箱中。隔天弃去原培养基,加入2mL胰蛋白酶-EDTA消化传代。
1.3 样品配置
将Dox、Ami、次乌头碱和藤黄酸用DMSO溶解并配成10mmol·L-1的母液,样品母液置于1.5 mL EP管中,-20℃中密封保存。细胞给药时用DMEM高糖培养基逐级稀释,4种药物的浓度均稀释成0.014,0.041,0.12,0.37,1.1,3.3和10 μmol·L-1。
1.4 高内涵多指标心脏毒性检测方法的优化
收集对数生长期细胞,以每孔5000个细胞密度加入96孔黑色透明底的培养板中,每孔100 μL,37℃,5%CO2培养箱中培养24 h。换入各浓度的Dox、Ami、次乌头碱和藤黄酸100 μL每孔培养24 h后,荧光探针标记细胞器:①将荧光探针Hoechst33342母液稀释1千倍到DMEM基础培养基中;再将MitoTracker Deep Red FM母液稀释1万倍到含有Hoechst 33342的培基中作为“鸡尾酒”染色剂;②弃去培养板中的培基,换成“鸡尾酒”染色剂,每孔100 μL,在孵箱中避光培养20 min;③将Fluo-4 AM或者Rhod-2 AM母液稀释1000倍到基础培基中;④弃去培养板中的染色剂,换入含有Rhod-2 AM的培基,每孔50μL,避光孵育30 min;⑤将培养板避光取出,准备进行活细胞成像。
1.5 活细胞成像
使用High Content Screening高内涵系统对细胞进行全自动成像。成像条件设置如下:20倍物镜第一通道(选取激发光360~400 nm/发射光410~480 nm)Hoechst33342标记细胞核;第二通道(选取激发光620~640 nm/发射光650~760 nm)MitoTracker Deep Red FM标记线粒体;第三通道(选取激发光460~490 nm/发射光500~550 nm)Fluo-4 AM或(选取激发光520~550 nm/发射光560~630 nm)Rhod-2 AM标记胞内钙,每孔7个视野同时拍照。利用Columbus图像处理及二次处理软件对细胞表型结果进行分析。①通过标记细胞核,计数每孔细胞数;②对细胞核形态进行分析,检测细胞核面积的变化;③通过计算钙离子的探针的荧光强度测定细胞内钙离子含量;④MitoTrack⁃er Deep Red染色线粒体,根据探针荧光强度的变化表征线粒体呼吸强度,统计为线粒体质量;⑤检测细胞内线粒体形态的变化如线粒体面积;⑥通过纹理分析方法如SER Ridge,观察线粒体的形状。综合以上不同细胞器,6种指标评价药物对心肌细胞的毒性作用。
1.6 数据处理及二次分析
高内涵筛选系统结合了自动荧光显微镜成像功能,可以对单次实验进行高通量多指标分析。Columbus高效有序的图像数据管理和分析系统对数据进行二次分析和管理,以及数据软件graph pad综合分析得到剂量-效应曲线。实验结果数据用表示,采用SPSS17.0数据统计软件,对数据进行正态性检验,多组间比较采用单因素方差分析,分析方法为LSD。
2 结果
2.1 胺碘酮、多柔比星、次乌头碱和藤黄酸对细胞核的影响
2.1.1 细胞存活
抗心律失常药Ami对心肌细胞产生毒性作用,活细胞数随浓度的增加呈下降的趋势,Ami约在10 μmol·L-1的浓度下对细胞有明显的杀伤作用,其EC50值为14.83 μmol·L-1(图1 B);Dox对细胞有较高的致死率,使活细胞数下降,EC50值为0.72 μmol·L-1,DNA损伤使得细胞核荧光染料Hoechst 33342的荧光强度降低(图1 C);阴性对照次乌头碱并未对H9c2心肌细胞活力造成影响(图1 D);藤黄酸的毒性作用则较强,抑制细胞存活的半数有效浓度为0.24 μmol·L-1(图1 E)。
2.1.2 细胞核面积
细胞核面积指标结果显示,与溶剂对照组相比,Ami则使细胞核皱缩,其EC50值为6.72 μmol·L-1(图2A);Dox使细胞核胀大,细胞核面积在浓度1 μmol·L-1时有显著性增加(P<0.01),其EC50为 0.014 μmol·L-1(图2 B);次乌头碱并未对细胞核造成影响(图2 C);而藤黄酸对细胞核有明显的皱缩作用,使细胞核面积减小,与Ami处理组相似,EC50值为1.16 μmol·L-1(图2 D)。

Fig.1 Effect of amiodarone(Ami,B),doxorubicin(Dox,C),hypaconitine(D)and gambogic acid(E)on nuclei of H9c2 cells by high content analysis imaging system labeling with Hoechst33342(blue).The cells were treated with from 0.014 to 10 μmol·L-1compounds for 24 h respectively.n=3.*P<0.05,**P<0.01,compared with control group.
2.2 胺碘酮、多柔比星、次乌头碱和藤黄酸对胞内钙离子的影响
钙离子染料的荧光值与正常组的荧光值做比对结果发现,与正常组相比,Ami 10 μmol·L-1对导致钙离子含量下降(图3 A);Dox对胞内钙离子含量稍微有影响,在10 μmol·L-1时有显著性差异(P<0.01)(图3 B);次乌头碱对胞内钙离子无影响(图3 C);藤黄酸使胞内钙离子含量降低,EC50值为0.41 μmol·L-1(图3 D)。
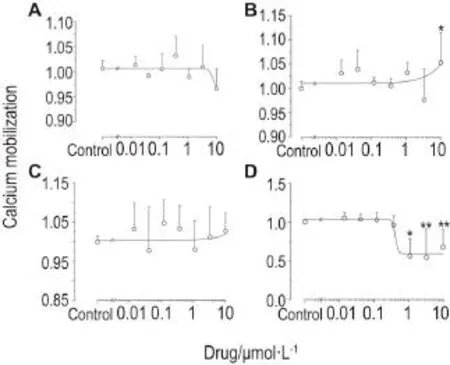
Fig.3 Effect of Ami(A),Dox(B),hypaconitine(C)and gambogic acid(D)on cellular calcium mobilization of H9c2 cell lines.H9c2 cells were exposed to compounds for 24 h at a concentration from 0.014 to 10 μmol·L-1.n=3.*P<0.05,**P<0.01,compared with control group.
2.3 胺碘酮、多柔比星、次乌头碱和藤黄酸对线粒体的影响
2.3.1 线粒体质量
图4 B显示,H9c2细胞受到Ami刺激后,原有的颗粒状线粒体聚集成滴状;线粒体的质量降低,EC50值为4.54 μmol·L-1;Dox诱导线粒体失常,使线粒体形状明显由椭圆形变成了线形,线粒体质量稍有增加,其EC50值为1.21 μmol·L-1(图4 C);次乌头碱对细胞的线粒体未造成损伤(图4 D);藤黄酸作用细胞后,线粒体质量减小,其EC50值为1.21 μmol·L-1(图4E)。
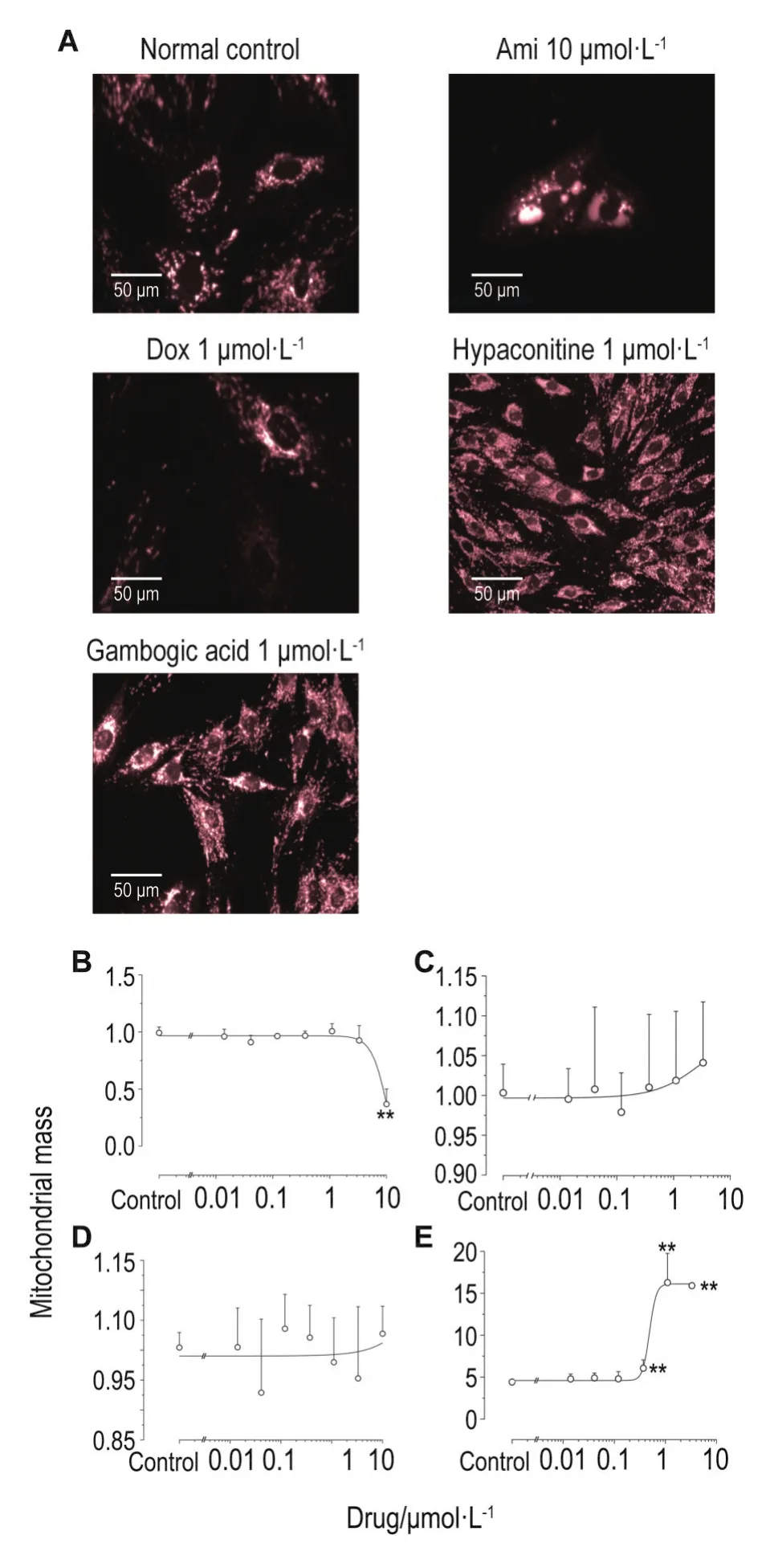
Fig.4 Effect of Ami(A),Dox(B),hypaconitine(C)and gambogic acid(D)on the mitochondria of H9c2 cell lines by high content analysis imaging system labeling with MitoTracker Deep Red(red).The cells were exposed to compunds at a concentration from 0.014 to 10 μmol·L-1for 24 h,respectively.n=3.**P<0.01,com⁃pared with control group.
2.3.2 次乌头碱和藤黄酸对线粒体面积的影响
为了更好的说明药物作用后线粒体的变化,增加检测了次乌头碱和藤黄酸作用心肌细胞后线粒体面积和线粒体纹理的变化。与正常组相比,藤黄酸不仅使线粒体质量减小且线粒体面积有增加趋势,其EC50值为0.44 μmol·L-1(图5 B)次乌头碱对细胞无任何作用(图5 A)。
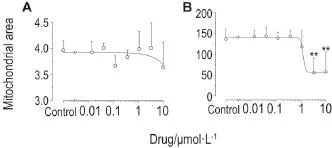
Fig.5 Effect of hypaconitine(A)and gambogic acid(B)on mitochondria area of H9c2 cell lines.H9c2 cells were exposed to compounds for 24 h at a concentration from 0.014 to 10 μmol·L-1.n=3.**P<0.01,compared with control group.
2.3.3 次乌头碱和藤黄酸对线粒体纹理分析的影响
线粒体SER ridge纹理分析结果表明,与正常对照组相比,次乌头碱作用后,SER Ridge降低(图6 A),但藤黄酸的作用后SER Ridge降低更显著(P<0.01),Z’值平均为0.5,P<0.05,假阳性率在可控范围内,评价方法可靠。这6种指标都证明了藤黄酸对心肌细胞H9c2有明显的损伤作用。

Fig.6 Effect of hypaconitine(A)and gambogic acid(B)on SER ridge of H9c2 cell lines.H9c2 cells were exposed to compounds for 24 h at a concentration from 0.014 to 10 μmol·L-1.,n=3.*P<0.05,**P<0.01,compared with control group.
3 讨论
Dox是使用最广泛的有效抗肿瘤药物之一,但通过介导Bax蛋白和依赖p38造成细胞内氧化应激,从而引起细胞凋亡[5]又促进细胞坏死[17],结果显示Dox降低细胞数。本研究EC50约在0.82 μmol·L-1,与文献参考值1 μmol·L-1[18]较接近。Ami属Ⅲ类抗心律失常药,已有研究指出Ami通过介导胱天蛋白酶2和胱天蛋白酶9的通路诱导大鼠心肌细胞系H9c2细胞凋亡[19]。最明显的特征是细胞收缩,核固缩,染色质凝结,细胞质致密,细胞器分布更紧凑[20]。Ami处理导致细胞核收缩,线粒体聚集更紧密,EC50值已达4.50 μmol·L-1[8]。乌头是公认的对心脏有强烈毒性的中药,其成分中包含3个主要生物碱,分别为乌头碱、中乌头碱和次乌头碱。有研究显示,这3种单体的毒性远不及乌头总毒性[21],而次乌头碱已被发现会造成QT间期延长[22]。本实验表明,与藤黄酸相比,次乌头碱的心脏毒性较弱,仅对线粒体的分布和形状有显著影响,但未发现对细胞的致死情况。
藤黄酸作为广谱抗癌药,对于小鼠肺癌细胞,药物浓度为10 mg·kg-1时即有轻度疗效,20 mg·kg-1已有较好抑制效果,30 mg·kg-1时可完全抑制肺癌细胞的生长[21]。有实验发现,300 nmol·L-1能有效抑制神经胶质瘤细胞的生长[23],抑制肝癌细胞SMMC7721生长的EC50值为1.2~3.2 μmol·L-1[24-25]。小鼠后腿肌内注射藤黄酸,电镜观察发现不同时间段药物对线粒体的损伤逐渐加重,24 h心肌细胞线粒体数量增多,48 h心肌细胞线粒体肿胀,基质变空,72 h可见畸形线粒体[26]。大鼠急性毒性试验和犬长期毒性试验结果表明,长期给药会造成其肝、肾器官的明显毒性以及心脏的部分损伤[27]。但是应用细胞水平的检测方法却不多。我们发现藤黄酸对正常H9c2心肌细胞有明显杀伤作用,降低细胞数EC50值相对较低(0.24μmol·L-1),对心肌细胞的毒性作用近似于Dox的结果。细胞核明显皱缩,细胞核面积有显著性减小,作用效果类似于胺碘酮藤黄酸1 μmol·L-1时,线粒体面积增大,其次线粒体呼吸能力有减弱倾向,>3.3 μmol·L-1时,线粒体质量降低。胞内钙离子浓度降低,说明藤黄酸作用心肌细胞,使细胞核、线粒体和胞内钙离子含量都产生了损伤。高内涵细胞水平评价心脏毒性不仅高通量、多参数,还可预测细胞机制。
综上,本研究建立了基于高内涵多指标心脏毒性安全性评价方法,并对藤黄酸的心脏毒性进行了综合评价及多指标的量化分析。藤黄酸不仅促进线粒体聚集,线粒体形状异常,线粒体质量下降,还导致胞内钙离子降低,稳态失衡,促使心肌细胞凋亡。多重影像学参数的同步评价对藤黄酸引起的心肌细胞核及线粒体的功能和形态进行较为全面的分析,并对其毒性作用机制做出初步的判断,可为用药安全性再评价及新药开发早期毒性预测提供新的技术支持。
[1]Brana I,Tabernero J.Cardiotoxicity[J].Ann Oncol,2010,21(Suppl 7):vii173-vii179.
[2]Rochette L,Guenancia C,Gudjoncik A,Hachet O,Zeller M,Cottin Y,et al.Anthracyclines/trastuzumab:new aspects of cardiotoxicity and molecular mech⁃anisms[J].Trends Pharmacol Sci,2015,36(6):326-348.
[3]Kerkelä R,Grazette L, Yacobi R, Iliescu C,Patten R,Beahm C,et al.Cardiotoxicity of the cancer therapeutic agent imatinib mesylate[J]. Nat Med,2006,12(8):908-916.
[4]Wen C,Huang L,Chen J,Lin M,Li W,Lu B,et al. Gambogic acid inhibits growth,induces apoptosis,and overcomes drug resistance in human colorectal cancer cells[J].Int J Oncol,2015,47(5):1663-1671.
[5]Shi J,Wei L.Rho Kinase in the regulation of cell death and survival[J].Arch Immunol Ther Exp(Warsz),2007,55(2):61-75.
[6]Guo Q,Qi Q,You Q,Gu H,Zhao L,Wu Z.Toxi⁃cological studies of gambogic acid and its potential targets in experimental animals[J].Basic Clin Pharmacol Toxicol,2006,99(2):178-184.
[7]Dolci A,Dominici R,Cardinale D,Sandri MT,Panteghini M.Biochemical markers for prediction of chemotherapy-induced cardiotoxicity:systematic review of the literature and recommendations for use[J].Am J Clin Pathol,2008,130(5):688-695.
[8]Kang YJ.Molecular and cellular mechanisms of cardiotoxicity[J].Environ Health Persp,2001,109(Suppl 1):27-34.
[9]GE.Automated functionalcellularanalyses of human iPS-derived cardiomyocytes,(2010-10-11)[2016-03-03].http://www.moleculardevices.com/ Documents/general-documents/scientific-posters/fliprposters/2011_WPC_Cardiomyocyte_FLIPR_Imaging.pdf.
[10]Mcpartland J,Dantzker HC,Portier CJ.Building a robust 21st Century chemical testing program at the U.S.Environmental Protection Agency:recom⁃mendations for strengthening scientific engagement[J].Environ Health Perspect,2015,123(1):1-5.
[11]Settivari RS,Ball N,Murphy L,Rasoulpour R,Boverhof DR,Carney EW.Predicting the future:opportunitiesand challengesforthe chemical industry to apply 21st-Century toxicity testing[J].J Am Assoc Lab Anim Sci,2015,54(2):214-223.
[12]Landrigan PJ,Goldman LR.Chemicalsafety,health care costs and the affordable care act[J]. Am J Ind Med,2014,57(1):1-3.
[13] Adeleye Y,Andersen M,Clewell R,Davies M,Dent M,Edwards S,et al.Implementing toxicity testing in the 21st Century(TT21C):making safety decisions using toxicity pathways,and progress in a prototype risk assessment[J].Toxicology,2015,332:102-111.
[14]Grimm FA,Iwata Y,Sirenko O,Bittner M,Rusyn I. High-content assay multiplexing for toxicity screening in induced pluripotent stem cell-derived cardiomyo⁃cytes and hepatocytes[J].Assay Drug Dev Technol,2015,13(9):529-546.
[15]Kim MJ,Lee SC,Pal S,Han E,Song JM.Highcontent screening of drug-induced cardiotoxicity using quantitative single cell imaging cytometry on microfluidic device[J].Lab Chip,2011,11(1):104-114.
[16]Zhang JH,Chung TD,Oldenburg KR.A simple statistical parameter for use in evaluation and validation of high throughput screening assays[J]. J Biomol Screen,1999,4(2):67-73.
[17]Dorn GW.Apoptotic and non-apoptotic programmed cardiomyocyte death in ventricular remodelling[J]. Cardiovasc Res,2009,81(3):465-473.
[18]Vogt A,Kalb EN,Lazo JS.A scalable high-content cytotoxicity assay insensitive to changes in mito⁃chondrial metabolic activity[J].Oncol Res,2004,14(6):305-314.
[19]FalikR,FloresBT, Shaw L,Gibson GA,Josephson ME,Marchlinski FE.Relationship of steady-state serum concentrations of amiodarone and desethylamiodarone to therapeutic efficacy and adverse effects[J].Am J Med,1987,82(6):1102-1108.
[20]Elmore S.Apoptosis:a review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
[21]Qin Y,Wang JB,Zhao YL,Shan LM,Li BC,Fang F,et al.Establishment of a bioassay for the toxicity evaluation and quality control of Aconitum herbs[J].J Hazard Mater,2012,199-200:350-357.
[22]Li D,Yang H,Li R,Wang Y,Wang W,Li D,et al. Antitumor activity of gambogic acid on NCI-H1993 xenografts via Met signaling pathway downregulation[J].Oncol Lett,2015,10(5):2802-2806.
[23]Thida M,Kim DW,Tran TT,Pham MQ,Lee H,Kim I,et al.Gambogic acid induces apoptotic cell death in T98G glioma cells[J].Bioorg Med Chem Lett,2016,26(3):1097-1101.
[24]Yang Y,Yang L,You QD,Nie FF,Gu HY,Zhao L,et al.Differential apoptotic induction of gambogic acid,a novel anticancer natural product,on hepatoma cells and normal hepatocytes[J]. Cancer Lett,2007,256(2):259-266.
[25]Guo QL,Lin SS,You QD,Gu HY,Yu J,Zhao L,et al.Inhibition of human telomerase reverse transcriptase gene expression by gambogic acid inhuman hepatoma SMMC-7721 cells[J].Life Sci,2006,78(11):1238-1245.
[26]Xiao BK, Xiao DG, Sun YG.Gambogic toxic poisoning pathology research[C]∥The Fifth National Forensic Academic Communication(第五次全国法医学术交流会).Beijing:Forensic Medicine Associa⁃tion of China,1996:149-152.
[27]Qi Q,You Q,Gu H,Zhao L,Liu W,Lu N,et al. Studies on the toxicity of gambogic acid in rats[J]. J Ethnopharmacol,2008,117(3):433-438.
Quantitative cardiotoxicity assessment of gambogic acid using multiple cellular phenotype analysis
ZHU Jie1,2,WANG Meng1,2,ZHU Yan1,2
(1.Tianjin Key Laboratory of Modern Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin International Joint Academy of Biomedicine, Tianjin 300457,China)
OBJECTIVETo evaluate the cardiotoxicity of a widen-spectrum antineoplastic drug, gambogic acid,through quantitative multiple cellular phenotypic characterization.METHODSH9c2 cell line was used as a model with doxorubicin(Dox)and amiodarone(Ami)as positive controls,hypaconi⁃tine as negative control and 0.1%DMSO as normal control.An optimized protocol was established to identify the morphology and function of cell nuclei.The effect of drugs on cell viability,nuclear area (Hoechst33342),mitochondria mass(MitoTracker Deep Red)and cytoplasmic calcium ion mobilization (Rhod2 AM)was studied.EC50and Z′values were calculated to evaluate the degree of toxicology and to estimate the precision and false-positive rate,respectively.RESULTSDose-response analysis indicated that EC50of Dox on cell viability,nuclear area,mitochondrial mass was 0.72,0.014 and 1.21 μmol·L-1, respectively.On the other hand,EC50of Ami on the parameters of cell viability,nuclear area and mitochon⁃drial mass was 14.83,6.72 and 4.54 μmol·L-1,respectively with Z′value above 0.5.Hypaconitine decreased the SER ridge of mitochondria.Gambogic acid caused significant mortality of H9c2 cells and induced nuclear shrinkage as Ami did.The EC50values of cell viability and nuclear area were 0.24 and 1.16 μmol·L-1.Meanwhile,gambogic acid disturbed the mitochondrial function as indicated by the increased mitochondrial area(EC50=0.44 μmol·L-1),abnormal SER Ridge(EC50=0.99 μmol·L-1)and decreased mitochondrial mass(EC50=1.21 μmol·L-1).Cellular calcium mobilization was lower than normal(EC50=0.41 μmol·L-1).CONCLUSIONThe EC50values of positive controls calculated from our assessment are similar those reported in literature.A multi-parameter and simultaneous evaluation enables a comprehensive analysis of the morphology of nuclei and mitochondria of cardiomyocytes and a preliminary assessment of the mechanisms of toxicity.
cardiac toxicity;gambogic acid;H9c2 cell line;high-content screening
ZHU Yan,E-mail:yanzhu.harvard@iCloud.com,Tel:15822700439
R285.1
:A
:1000-3002-(2017)01-0073-07
10.3867/j.issn.1000-3002.2017.01.009
2015-12-08接受日期:2016-06-15)
(本文编辑:沈海南乔 虹)
科技部国家国际合作专项(2013DFA31620);国家科技重大专项(2013ZX09201020);天津市高等学校创新团队(TD12-5031)
祝 婕,女,硕士研究生,主要从事中药药理研究;王 萌,女,博士,副研究员,主要从事中药制剂及药物安全性评价研究;朱 彦,博士,教授,主要从事中药药理研究。
朱 彦,E-mail:yanzhu.harvard@iCloud.com,Tel:15822700439
Foundation item:The project supported by International Cooperation Project of MOST of China(2013DFA31620);National Major New Drug Discovery(2013ZX 0920102);and Program for Tianjin Innovative Research Team in University(TD12-5031)

