菲污染土壤的微生物修复机制
韦 璇, 郝雅荞, 李 光, 牛世莉, 王升厚,4, 赵洪新
(1.沈阳师范大学 生命科学学院,辽宁 沈阳 110034;2.浙江理工大学生命科学学院 浙江省植物与次生代谢重点实验室,浙江 杭州 310018;3.河南大学 生命科学学院,河南 开封 450000;4.沈阳师范大学 教学实验中心,辽宁 沈阳 110034)
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一种分子结构中含有2个或2个以上苯环并以线性、角状、簇状排列的有机物。主要来源于化石燃料的不完全利用及木材、烟草、有机高分子等有机物不完全燃烧时产生的挥发性碳氢化合物,是危害严重的环境污染物之一[1]。菲是PAHs的模式化合物,由三个苯环以弯接方式排列组成,是PAHs污染物的主要成分之一。环境监测表明,由于化石燃料的长期大量使用,导致菲广泛分布在环境中,包括大气、土壤、河流、植物等,甚至在青藏高原的冰川中都有其存在[2]。而一旦菲进入动物、植物及人体后会使生物体内自由基和超氧化阴离子增加,改变动、植物的抗氧化防御体系,导致人体器官发生氧化作用,最终破坏DNA,引起机体癌变[3]。加之高沸点、低溶点、低生物利用性及难降解等特征,使菲在治理PAHs污染土壤中成为清除重点和难点。目前修复菲污染的方法主要有物理修复、化学修复及生物修复[4]。物理修复是通过电极或超声波,使菲在电极处富集或者从土壤表面解析出来,其优点是清洁环保,无二次污染,但工作时间长、效率低;化学修复是通过向土壤中施洒一些化学氧化剂,使菲发生一些氧化分解反应,变成低毒、无毒的小分子,但氧化剂
会在土壤表面残留,造成二次污染;植物、动物、微生物是生物修复的三大主体,它们可以单独或联合完成菲的降解过程。微生物单独修复是通过利用以菲为唯一无机碳源的专性降解菌,在细胞吸收菲后,通过胞内代谢,将菲转化或分解成二氧化碳和水;或是利用能够吸收环境中菲的根际微生物,与植物联合作用,以及土壤动物等的协同作用对菲污染土壤进行修复。相较于物理、化学手段,微生物修复具有低成本、高效率、无二次污染、能源消耗少、作用污染物底物广、绿色环保等特点,被认为是经济、有效、环保的修复技术[5]。 本文对微生物修复菲污染中降解菌的菌属、不同菌的降解机理、分子机制、影响降解的因素等方面进行总结归纳,为进一步开发高效菲降解微生物提供参考。
1 降解多环芳烃菲的微生物菌属
研究发现部分细菌、真菌、藻类可以利用菲作为碳源进行生长。菲分子通过微生物的代谢利用,最终转化降解成一些低毒的小分子或二氧化碳,特别是细菌在菲降解过程中发挥着主要作用[4]。
1.1 原核微生物
目前能降解菲的细菌约有19个属, 见表1。
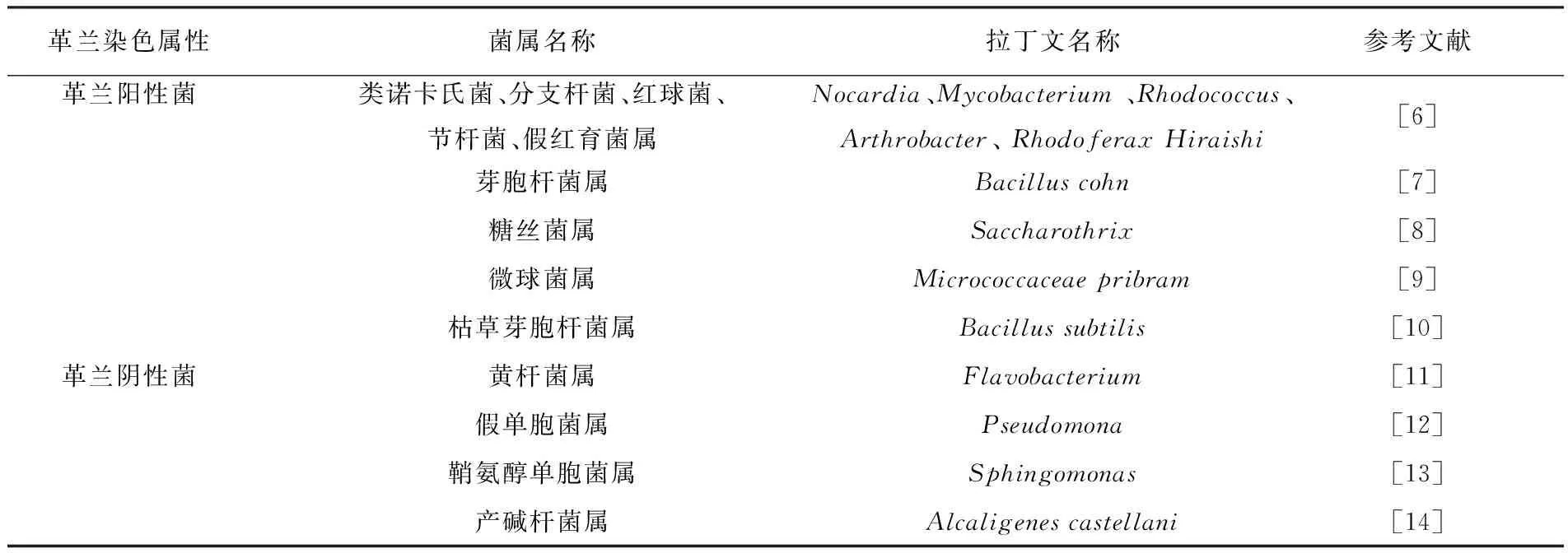
表1 降解菲的细菌属
其中罗雪梅等[5]用枯草芽胞杆菌(Bacillussubtilis)吸附湿地土壤中PAHs污染物,结果表明枯草芽胞杆菌对菲的去除率达到98%。杨智临等[15]利用生物共代谢法降解石油污染土壤中的萘、菲发现,红球菌属以菲为共代谢基质降解萘的最高去除率达到86%,而以萘为共代谢基质降解菲的最高去除率为42%。张帆[6]对华北亚粘土4种菲降解菌(假单胞菌、红球菌、马赛菌及假红育菌属)降解菲能力研究中发现,菲降解能力依次为假单胞菌>红球菌>马赛菌>假红育菌属。雷萍等[16]在研究焦化废水降解过程中发现,黄杆菌属菲降解能力较降解萘、吡啶、芘的能力最大,达到99%,而萘、吡啶、芘的降解率分别为93%、90%、72.5%。伯克氏菌属(Burkholderia)也是一种典型的菲降解菌,对高浓度菲具有很好的耐受性,而气单孢菌属(Aeromonas)、类诺卡氏菌属(Nocardia)、弧菌属(Vibrio)对菲的专一性较强[17]。
1.2 真核微生物
降解菲的真核生物相较原核生物的数量较少,能降解菲的菌属有黄胞原毛平革菌属(Phanerochaetechrysosporium)、曲霉属(Aspergillus)、红酵母属(Rhodotorula)、担子菌属(Basidiomycotina)和半知菌属(Imperfect)等。其中白腐担子菌具有高效的 PAHs 降解能力,降解底物范围广[18]。真菌不同于细菌,主要是通过和其他生物的协同作用对多环芳烃进行降解。研究表明,在PAHs 污染土壤中同时接种真菌和细菌的去污效果,要优于真菌或细菌单接种[19]。这是因为双接种情况下真菌对多环芳烃进行氧化,形成了便于细菌吸收和利用的氧化态物质,间接增加了降解效率,例如土壤中蒽经白腐真菌氧化后的产物其细菌矿化速率明显高于未经白腐真菌氧化蒽的矿化速率,反过来这些细菌产生的表面活性物质、生长因子等又可以促进真菌的生长[20]。除此之外,真菌还可以和某些植物产生协同作用,尤其是一些植物内生菌,能够促进植物吸收土壤中的多环芳烃,从而起到降解污染物的作用。有关真菌和其他生物的协同作用,在清除土壤污染物,降低环境中有害物质等方面已经成为较热的研究方向。
2 降解机理
有机污染物菲能够被降解,一是因为它自身能充当微生物生长所必须的碳源,微生物细胞表面的亲脂区或分泌的活性物质,都会使菲顺利进入细胞,通过一系列降解酶的催化被微生物利用;二是微生物将多环芳烃与其他有机质进行共代谢,污染土壤是一个多种污染物并存的复杂环境,共降解是实现部分有机污染物降解的重要途径,污染物被转化为容易降解的中间产物,继而得到最终的降解。
2.1 细菌降解机制
2.1.1 好氧降解 有氧条件下菲在菌体细胞内有两种降解途径:邻苯二甲酸途径和水杨酸途径。菲经两种途径转化为甲酸或水杨酸后进入三羧酸循环,最终实现完全降解。当菲进入细胞时,在双加氧酶的作用下,3、4位碳上会被引入2个氧原子,经过氧化生成顺-3,4-二氢二羟基菲后,再经过一系列酶的脱氢、氧化、再脱氢的作用,形成1-羟基-2-萘甲酸。1-羟基-2-萘甲酸是一个“分水岭”性的物质,对于只能利用菲不能利用萘的细菌,之后进入邻苯二甲酸途径,而对于同时能利用菲、萘的细菌,之后转向水杨酸途径(如图1、图2)。
以芽胞杆菌为例:菲转化为1-羟基-2-萘甲酸后,在1-羟基-2-萘甲酸双加氧酶作用下,生成反式2-羧基苯并丙酮酸,通过酸缩水合酶的作用生成2-羧基苯甲酸,2-羧基苯甲酸在脱氢酶作用下,生成邻苯二甲酸,再经过邻苯二甲酸加氧酶形成原儿茶酸,产物进入三羧酸循环,最终转化为二氧化碳和水[21-22]。
以假单胞菌属为例:1-羟基-2-萘甲酸经1-羟基-2-萘甲醛羟化酶转化为 1,2-二羟萘,1,2-二羟萘在1,2-二羟萘双加氧酶作用下生成 2-羟-2H-苯并吡喃-2-羧酸后,经过2-羟-2氢-苯并吡喃-2-羧基异构酶、顺-o-羟基苯脱萘丙酮酸水合-醛缩酶及水杨醛脱氢酶催化作用下生成水杨酸,水杨酸被水杨酸羟化酶、邻苯二酚-1,2-双加氧酶转化成琥珀酸和乙酰辅酶A最终进入三羧酸循环[23]。
2.1.2 厌氧降解 当氧气不足时,不同微生物选择进入不同厌氧还原体系完成菲的降解。根据终电子受体不同可将厌氧微生物降解 PAHs 的反应体系分为反硝化还原反应体系、硫酸盐还原反应体系、金属还原反应体系和产甲烷还原反应体系等。其中以硝酸盐或硫酸盐为电子受体的研究相对较多。 反硝化还原反应体系是指降解过程中反硝化细菌将大量自由电子传递给不同类型的硝酸盐受体,从而完成厌氧微生物对PAHs的降解。1988年Miheleic等[24]就观察到了萘在反硝化还原反应体系下的降解现象,随后越来越多具有降解PAHs功能性的反硝化菌株或菌群逐渐被分离。Rockne等[25]从海洋沉积物的流动床系统中分离得到萘降解菌株,在厌氧及硝酸盐供给充足的条件下萘的降解率实现最大化,同时菲的降解率最高达到96%。
硫酸盐还原反应体系是以硫酸盐为最终电子受体,有研究发现相对其他受体,硫酸盐为电子受体时微生物对多环芳烃的降解效果最为显著[26]。Hayes等[27]向含有PAHs的海洋沉积物中添加硫酸盐抑制剂,发现沉积物中PAHs不再被降解,从而证明硫酸盐是决定降解进程的关键因素。Tsai等[28]对1组硫酸盐还原菌群进行21 d的培养观察,发现88%的芴和65%的菲被生物转化利用。
降解过程是生物代谢的一种形式,其速率受两个方面的影响:一方面,腺苷三磷酸提供了微生物细胞完成降解作用所必须的能量,故其产生的“多少”和“快慢”直接影响菲的降解速率;另外一方面,电子受体的不同决定降解途径的不同,从而导致降解速率的差异。好氧降解直接以氧气为电子受体,对低环多环芳烃菲表现出较高的降解速率[17],而厌氧降解则以硝酸盐、硫酸盐、金属离子(Fe2+、Mn2+)和甲烷等为电子受体,能将多环芳烃菲彻底转化为CO2,但历时较长、对受体有最适范围,过高或者不足都会对降解产生抑制作用[29]。
2.2 真菌的降解机理
真菌降解多环芳烃菲也存在两种途径:一条途径是由木质素降解酶系引导的,另一条是通过单加氧酶系实现的。两条途经最大的区别是前者为胞外降解,后者则为胞内降解[30-31]。
真菌向胞外分泌木质素降解酶系(木质素过氧化物酶、锰过氧化物酶和漆酶),这些酶的底物专一性较弱,除了利用木质素、纤维素外还可以催化包括 PAHs 在内的许多有机污染物[32]。当污染物菲存在时,菲苯环的9、10碳位上被引入2个氧原子,经木质素降解酶系氧化变成醌,然后经过加氢、脱水等作用使苯环开环形成邻苯二甲酸,进一步形成二氧化碳。
细胞色素 P-450 单加氧酶是真菌参与降解反应的另一个关键酶。这种酶在菲苯环的9、10碳位上加1个氧原子形成环状有机物,然后经环氧化物水解酶催化水合形成反式二氢二羟基化中间体[33],再经过2次脱氢转化成醌,之后发生的反应与木质素降解酶参与的反应相同。
真菌可以通过以上机制直接矿化 PAHs。但是,很少能观察到真菌对 PAHs 独立进行矿化[34],大部分情况是真菌与其他生物以协同作用的方式,实现对 PAHs 的最终降解。总之,无论是细菌还是真菌对多环芳烃菲的降解都是使菲苯环加氧发生氧化开环,真菌大部分都是在9、10碳位上加氧(K区),而细菌是在菲的3、4号碳位上加氧,形成中间产物,进一步被消耗利用。
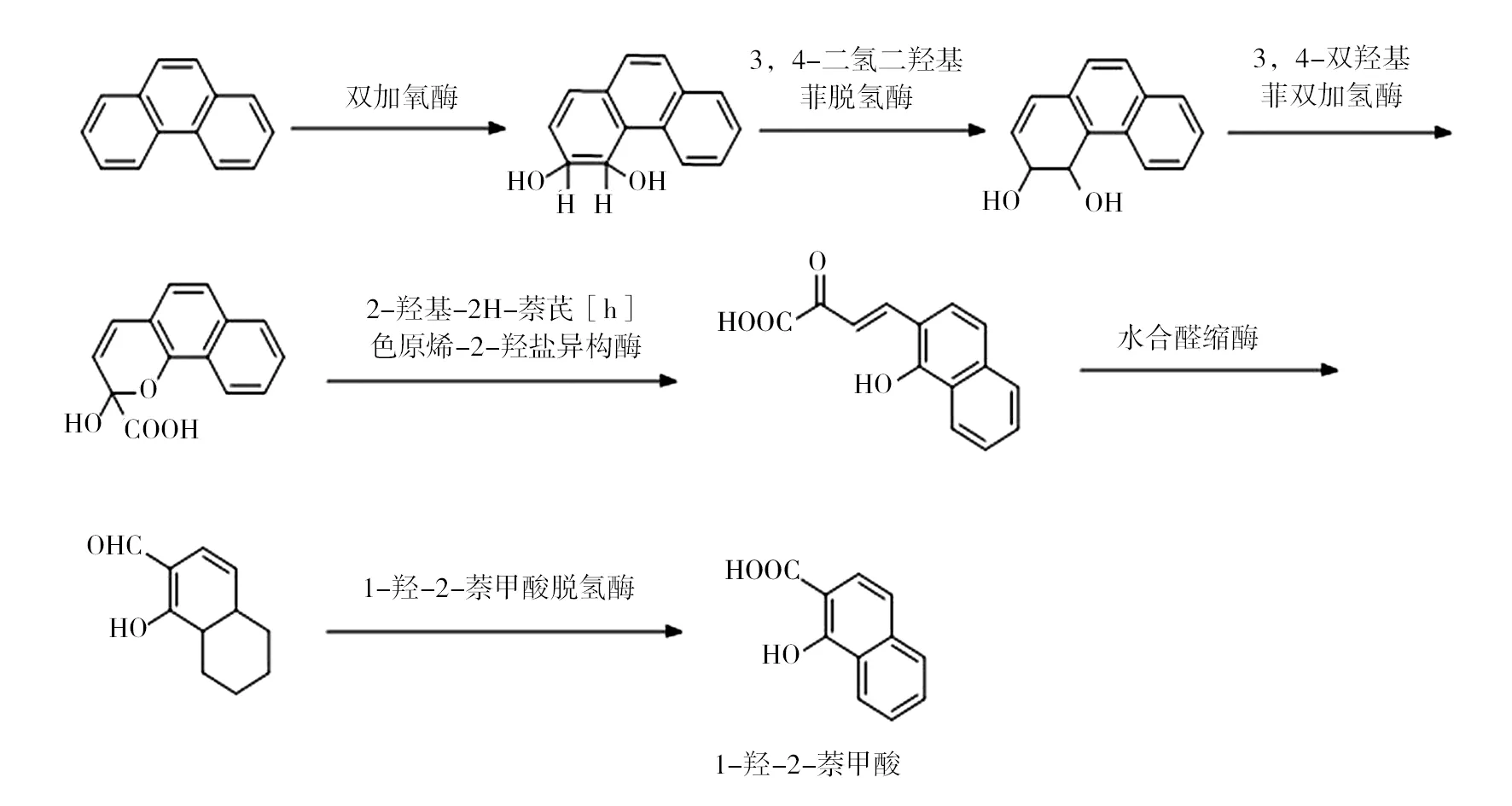
图1 好氧细菌菲转化形成1-羟-2-萘甲酸过程Fig.1 Phenanthrene transform into 1-hydroxy-2-naphthoic acid process in aerobic bacteria

图2 1-羟-2-萘甲酸分别通过2条途经进行代谢Fig.2 1-hydroxy-2-naphthoic acid is metabolized by two pathways
2.3 共代谢机制
共代谢又名共氧化或共降解,最早由Leadbetter和Foster提出[35]。1963年Jensen将其内涵扩展并正式提出了共代谢的概念:微生物在有其他生长基质存在的条件下,酶活性增强,降解非生长基质的效率提高。共代谢作为多环芳烃的另一种降解机制主要包括以下四个特征:①微生物能够同时利用两种基质,第一种基质容易利用并提供生长所必须的碳源和能源,第二种基质降解释放的能量不为微生物所用;②难降解的有机污染物通常充当第二种基质;③两种基质之间存在竞争现象;④共代谢反应存在几种关键酶,不同类型微生物关键酶功能都是相似的。
2.3.1 多环芳烃共代谢途径 研究表明PAHs的苯环数越高其生物降解性越差,故高环的PAHs主要以共代谢的方式被微生物利用[36]。代谢具体
过程为双加氧酶将氧气以原子的形式加在多环芳烃苯环的碳碳键上形成碳氧键,转化成中间产物顺-二醇,经过辅酶NADH脱氢酶的作用转化成邻苯二酚,最终使苯环断裂,而苯环数的减少加速了微生物对其的利用。
2.3.2 多环芳烃共代谢基质 可选用作多环芳烃的共代谢基质要满足三个条件:此种物质能用来维持多环芳烃降解菌生长,而不容易被其他降解菌消耗;与目标底物或中间代谢产物结构相似;相对毒性较低,价格便宜,能够明显提高降解率[37-38],如水杨酸﹑邻苯二甲酸﹑乙酸盐,其中邻苯二甲酸是细菌降解PAHs时常用的共代谢基质。除了添加化学共代谢基质外,作为植物-微生物协同修复系统,植物根系分泌物也可以为微生物提供碳源,作为PAHs的共代谢基质。

表2 多环芳烃共代谢基质
3 分子水平的研究
微生物降解作为去除土壤PAHs的主要方式,对其研究重点不再停留于单一寻找降解菌属,而是深入探究其遗传调控机制的同时构建高效工程菌。随着研究范围的不断扩大,对分子水平上的认识也在不断完善,如降解酶簇种类、编码基因及基因坐落位置和关键基因的克隆等方面。
3.1 降解酶簇种类
微生物降解菲是通过细胞内一些酶促反应实现的。细菌利用双加氧酶而真菌依赖单加氧酶[43]。这些降解酶都存在两个特性:一是降解酶的表达依赖降解物的诱导;二是降解酶的底物专一性差。如恶臭假单胞菌(PseudomonasputidaOUS82),同一种双加氧酶可以同时氧化菲、萘,而且此酶经过萘的诱导后又可以将多种芳香烃氧化成酚性物质如蒽、联苯、硫芴、苯并苊等[44]。以细菌为例,降解菲的过程主要涉及两种关键酶,分别是羟基化双加氧酶和邻苯二酚双加氧酶。
3.1.1 羟基化双加氧酶 羟基化双加氧酶 (ring-hydroxylating dioxygenase, RHO) 是细菌在降解菲代谢过程中的关键酶之一。由末端氧化酶 (terminal oxygenase) 和铁氧还蛋白(ferredoxin),以及铁氧还蛋白还原酶 (ferredoxin reductase) 三部分功能蛋白组成的依赖NAD(P)H的酶系统[45]。其中末端氧化酶是由ɑ亚基(含有铁硫中心和单核铁原子结构域)和β亚基构成的六聚体结构,具有催化和识别底物的作用[46],铁氧还蛋白和铁氧还蛋白还原酶负责加氧过程中电子的传递。 羟基化双加氧酶可以催化分子氧完成对芳香环的攻击形成羟基化产物。在加氧的过程中,末端氧化酶、铁氧还蛋白、铁氧还蛋白还原酶组成了一条电子传递链,铁氧还蛋白还原酶将来自NADH的两个电子传给铁氧还蛋白,由铁氧还蛋白传递给具有催化和识别功能的末端氧化酶来处理。
3.1.2 邻苯二酚双加氧酶 邻苯二酚双加氧酶可以催化羟基化的底物使菲彻底开环,是降解代谢途径另一个关键酶。包括邻苯二酚1,2-双加氧酶、邻苯二酚2,3-双加氧酶。前者属于内二元醇双加氧酶,可以催化邻苯二酚转化为顺,顺-粘糠酸,断裂发生在两个羟基之间;后者属于外二元醇双加氧酶,催化邻苯二酚转化为2-羟基己二烯半醛,断裂发生在某个羟基一侧并且需要Fe2+的协助,由于C23O的活性依赖Fe2+, 在反应过程中部分Fe2+会被氧化成Fe从而使C23O的活性受到了影响,因此C23O催化的开环反应是芳香化合物降解的限速步骤[47]。在假单胞菌属中C12O和C23O同时存在。
3.2 降解基因
3.2.1 降解基因的种类 目前能降解多环芳烃菲的基因家族包括phd、phn、nid、nag等。其中研究最多的是phd、phn基因家族。phd基因在从毛单胞菌中的基因序列为phdAbAaBAcA dDE,其中phdAb 基因编码铁氧化还原蛋白,phdAa基因编码铁氧化还原蛋白还原酶,phdB基因编码顺式-二羟基脱氢酶,phdAc和phdAd基因分别编码铁硫蛋白(ISP)的大(α)、小(β)亚基,phdD 基因编码异构酶,phdE 基因编码水合酶-醛缩酶。phn基因由9个开放阅读框(ORFs)组成,顺序为phnRSFECDAcAdB,其中phnR、S 是调控基因,phnF基因编码乙醛脱氢酶,phnE 基因编码水合酶-醛缩酶,phnC 基因编码外源型双加氧酶,phnD 基因编码异构酶,phnAc基因和phnAd基因分别编码起始双加氧酶铁硫蛋白(ISP)的大(α)、小(β)亚基,phnB基因编码二羟基脱氢酶[48]。
3.2.2 降解基因的位置phn、phd、nid和nag基因家族等存在位置的多样性,可能位于染色体上,或是存在于质粒中,也可能两者兼有。当功能基因底物越复杂、降解对象含有的芳香环数量越多,其所在的操纵元就会越大,这时一般小质粒不能承载,通常由染色体或两者共同负担。表3为不同降解基因编码的蛋白及存在的位置[49-51]。
3.3 功能基因的研究
有关菲降解基因的研究已取得长足的进步,很多实验室从不同菌种中克隆得到了部分降解菲的基因片段并进行了功能验证。Pinyakong等[52]在Sphingomonassp. P2的两个酶切片段上得到铁硫蛋白的大小亚基基因及编码铁氧还蛋白和铁氧还蛋白还原酶基因。Kiyohara等[53]在Pseudomonas82的染色体DNA上得到pahAa、b、c、d及pahB、C、D、E、F的基因片段。Saito等[54]在Pseudomonasputida中成功克隆了Nah基因。赵和平[55]从PseudomonasputidaNCIB9816-4中克隆了nahAa、nahAb 、nahAc、nahAd 四个基因,分别编码该双加氧酶的三个组分Nap还原酶、Nap铁氧还蛋白、铁硫蛋白大小亚基。

表3 不同降解基因编码的蛋白及存在的位置
4 影响微生物的修复因素
温度、pH、氧气、生物利用性及微生物本身活性,都是影响生物修复的关键因素。微生物修复菲污染的过程,实际是一系列化学酶促反应的过程,温度、pH都会影响酶的活性,从而直接影响整个降解过程。环境中氧气的浓度决定了参与反应的微生物类型及降解反应速率的快慢,一般好氧降解比厌氧降解速率更快[56]。因此菲的降解与微生物的性质及环境密切相关[57],见表4。
4.1 菲的生物利用性
土壤中的多环芳烃菲不是以游离态存在,而是易于与土壤中的有机质共价结合,呈现一种难解析的结合态。研究表明,只有溶于水的PAHs才能被胞内代谢所利用, 所以微生物很难利用结合状态的菲,而且随着时间的推移,菲与土壤有机质的共价结合更为紧密,使微生物对污染物的生物有效性降低,解析作用变得更为缓慢[58-59]。 因此,菲的生物利用性是影响微生物降解的重要因素之一,并且呈现一定的正相关性。研究者尝试投放表面活性剂如TW-80,来增加菲的生物利用性。结果表明,TW-80能提高 PAHs 的生物可利用性,提高其降解率[60]。Zhu 等也报道了生物表面活性剂可加快土壤中菲和芘的降解,但是化学表面活性剂很多具有一定的生物毒性,不仅影响土著微生物的种群结构,也会使部分微生物产生耐药性,还会造成二次污染,而且高浓度的表面活性剂,也会抑制细菌的降解作用[61-62]。另一方面,某些微生物自身就能产生表面活性物质、胞外多糖等,这些物质被分泌到细胞外后可提高环境中菲的水溶性,可提高自身在环境中摄取菲的总量和速率。Deziel发现微生物在降解 PAHs(萘、菲)过程中自身能产生以糖脂形式(鼠李糖脂混合物)存在的生物表面活性剂,促进 PAHs 的降解和微生物的生长[63]。
4.2 环境因素
4.2.1 温度 温度是影响微生物降解多环芳烃的重要因素之一。温度的影响主要表现为两方面:一是温度影响微生物细胞内降解酶的活性,从而影响多环芳烃的降解;二是温度能够改变菲在土壤中的溶解度,改变菲的生物利用性。降解反应和其他酶促反应一样都要求达到最适酶活温度,温度过高、过低都不利于多环芳烃的降解反应进行。比如:双加氧酶是多环芳烃降解过程中的关键酶,而这种酶活性的最适温度是 40 ℃,当外界温度较低时酶的活性受到抑制,温度过高又使酶的结构遭到破坏而失去活性,对菲的降解率势必会有影响[64]。徐成斌等[65]在耳炎假单胞菌降解多环芳烃菲的研究中发现,当外界温度达到30 ℃时,该菌对菲的降解率达到最大值,而低于或者超过30 ℃时降解率都会明显下降 。 另一方面,温度会影响土壤中的氧气含量,同样可改变菲的水溶性。Barbara早在1993年就发现,土壤中 PAHs 浓度会随着温度升高而减少[66]。
4.2.2 pH pH对微生物降解也有一定的影响。一方面微生物生长繁殖都有一个最适pH值,当达到最适pH时,微生物表现为生长迅速、繁殖旺盛,对菲的降解率也提高。祝儒刚等[67]研究发现pH对L2细菌的生长速度有明显影响,当pH为7.4时,菌体的湿重达到最大 。王莉等[68]在对菲降解菌株降解条件的研究发现,当pH为9时分枝杆菌、敏捷食酸菌的菲降解率及菌体生长密度比pH为5时提高了4倍左右。另一方面,土壤 pH 值的变化对微生物的多样性和种群结构有一定影响,当 pH 降低时,土壤微生物多样性下降,这对菲的降解十分不利。
4.2.3 氧气 土壤中氧气含量决定着微生物种群的结构,影响好氧微生物、兼性微生物及厌氧微生物的种类,从而影响菲进入不同的降解途径。菲既可以被好氧菌降解,也可以被一些反硝化细菌或者硫酸盐还原菌所利用。在有氧条件下,菲被还原充当电子供体,提供的电子由氧分子接受,而在无氧条件是由硝酸盐或硫酸盐等为电子受体。Boyd等[69]测定了淡水河口底泥中含氧量多少对生物降解PAHs的影响,当溶解氧的含量高于 70%,PAHs的矿化率呈指数型增长,而溶解氧低于 40%时,PAHs 的矿化受到抑制,因此环境中氧的含量与多环芳烃的好氧降解有着重要的联系。
4.3 微生物自身活性
不同微生物对菲降解的能力存在着一定的差别。同样是在最优化的条件下,不动杆菌的最大菲降解率为80%,而假单胞菌的最大菲降解率却为86%[70]。而且土壤中的有机污染物并不是单一存在的,往往是呈现多种污染物混合的状态,而在实验室中筛选出的降解菌株对底物专一性强,在实际应用中降解效果就会受到影响,因此微生物的群落数量和种类会直接影响降解效率[71]。

表4 影响微生物修复的因素及作用机理
5 微生物与植物联合修复
在土壤-植物-微生物组成的复合体系中,植物与微生物形成的互惠共生系统,共同降解有机污染物[72-73]。植物强大的根系为各种微生物的生长繁殖提供了理想的场所,而“寄居”在根际上的微生物通过不断降解周围环境中的有机污染物,为植物开拓了更多的生长空间。研究表明植物根际降解菌的多样性及数量比非根际区高,代谢活性也比土著微生物强[74]。植物通过根际,将酶及一些有机酸释放到土壤中,为根际微生物提供营养物质,促进微生物的生长代谢,同时根际的分泌物能将有机污染物,从土壤表面分离出来便于微生物更好地利用[75-76]。高彦征等[77]利用黑麦草对多环芳烃污染土壤中的菲和芘进行降解时发现,种植黑麦草后土壤中菲和芘的降解率明显增加,达到90.79%和89.21%,均显著高于无植物对照。田林双等[78]将一株植物内生菌拟茎点霉单独降解菲与水稻联合降解进行对比发现,前者菲降解率为52.54%而采用联合降解菲残留浓度仅为对照组的 8.40%。刘世亮等[79]研究了种植黑麦草对土壤中多环芳烃菲的动态降解作用,结果显示,当菲初浓度为200 mg/kg时,种植黑麦草土壤中菲的降解率为84.94%, 而不种植土壤中菲的降解率为67.60%,这可能因为种植黑麦草增强土壤中多种酶的活性(多酚氧化酶、脱氢酶和过氧化氢酶)同时增加了土壤中微生物生物量碳的含量,即提高了土壤中生物活性,从而加速了土壤中菲的降解 。
6 小 结
污染土壤中多环芳烃菲的去除,一直是研究的热点和难点。这主要与菲的化学性质及微生物降解能力有关。环境中的菲来源广泛、蒸汽压小、辛醇-水分配系数高,这些特征使其长期存在土壤中,不易被分解,通过食物链逐层传递及等级间不断的累积,将会对食物链顶端的人类造成巨大的致癌威胁。近年来越来越多的菲降解菌被分离纯化,相关的研究也有了很大的进展,但菌株之间的降解能力差别较大,对污染物降解的专一性强也是千差万别。当环境中的有机污染物以混合状态存在时,降解效果就有所下降,所以如何寻找和筛选高效、降解谱广泛,对环境适应性强的优良多环芳烃降解菌,一直是研究者关注的课题;其次实验室分离纯化培养降解菌的时间较长,如何通过结合物理、化学的手段增加工作效率也是值得思考和探讨的方向;尽管单一菌株进行生物修复的研究日益活跃,降解机理也日益深入,但除了微生物修复,动物与微生物、植物与动物的联合修复,也是一个很好的研究方向,对解决目前日益严重的多环芳烃污染问题,提供了新途径。
[1] Zasadowski A, Wysocki A. Some toxicological aspects of poly-cyclic aromatic hydrocarbons effects[J]. Rocz Panstw Zakl Hig, 2002, 53(1): 33-45.
[2] Li QL, Wang NL, Wu XB, et al. Sources and distribution of polycyclic aromatic hydrocarbons of different glaciers over the Ti-betan Plateau[J]. Science China Earth Sciences, 2011, 54(8): 1189-1198.
[3] Yin Y, Wang XR, Yang LY, et al. Bioaccumulation and ROS generation in Coontai Ceratophyllum demersumL.exposedtophenanthrene[J]. Ecotoxicology, 2010, 19: 1102-1110.
[4] 张灵利,徐宏英,葛晶丽.多环芳烃污染生物修复研究进展[J].微生物学杂志,2016,36(2):81-86.
[5] 罗雪梅, 何孟常, 刘昌明. 微生物对土壤与沉积物吸附多环芳烃的影响[J]. 环境科学, 2007, 28(2): 261-266.
[6] 张帆. 污染土壤中萘、菲降解菌的筛选鉴定及降解特性研究[D].北京:中国地质大学,2013.
[7] Yu Y, Liang YH, Brostromer E,et al A catalytic mechanism revealed by the crystal structures of the imidazolonepropionase fromBacillussubtilis[J]. Journal of Biological Chemistry,2006,281(48):36929-36936.
[8] 扈玉婷, 任凤华, 周培瑾,等. 一株分离自新疆天池寡营养环境的糖丝菌(Saccharothrixsp. PYX-6)降解芘的特性[J].科学通报, 2003,48(16) :1796-1800
[9] 温洪宇, 廖银章, 李旭东.微生物降解多环芳烃研究进展[J]. 微生物学杂志,2005,25(6):73-75.
[10]李丽, 钟鸣, 周启星.枯草芽孢杆菌对多环芳烃的降解能力研究[J].河南农业科学,2007(4):62-64.
[11]聂麦茜, 张志杰, 孙先锋.特效黄杆菌对蒽菲芘的降解性能研究[J].微生物学通报, 2001,28(5):32-36.
[12]Kazunga, Aitken MD.Products from the incomplete metabolism of pyrene by polycyclic aromatic hydrocarbon-degrading bacteria[J]. Applied & Environmental Microbiology,2000,66 (5):1917-1922.
[13]Ai FF, Qu YY, Zhou JT,et al.Isolation and characterization of a phenanthrene-degrading bacterial strain[J]. Environmental Science, 2008,29 (4):1066-1071.
[14]张卫,林匡飞,张巍,等.菲在土壤中的微生物降解研究[J]. 生态环境学报, 2010, 19(2): 330-333.
[15]杨智临, 陈海, 白智勇. 生物共代谢法降解石油污染土壤中的萘、菲[J]. 油气田地面工程, 2014, 11(1):48-49.
[16]雷萍, 聂麦茜, 张志杰,等. 一株多环芳烃降解菌在焦化废水降解中的应用研究[J]. 西安交通大学学报, 2001,(10):1055-1058.
[17] 姜岩, 杨颖, 张贤明. 典型多环芳烃生物降解及转化机制的研究进展[J]. 石油学报, 2014, 30(6): 1138-1149.
[18]吴宇澄, 林先贵. 多环芳烃污染土壤真菌修复进展[J]. 土壤学报, 2013, 50(6): 1191-1198.
[19]Wang SZ, Nomura N, Nakajima T, et al. Case study of the rela-tionship between fungi and bacteria associated with high-molecular-weight polycyclic aromatic hydrocarbon degradation[J]. Journal of Bioscience and Bioengineering , 2012, 113(5): 624-630.
[20]陈金媛, 沈洋洋,李烜桢. 白腐真菌GanodermaSinense对镉和蒽的去除能力[J]. 环境工程学报, 2016, 10(2): 787-791.
[21]马静. 多环芳烃降解菌的筛选、降解机理及降解性能研究[D]. 大连:大连理工大学, 2013.
[22]Takizawa N, Kaidan N, Torigoe S, et al. Identification and characterization of genes encoding polycyclic aromatic hydrocarbon dioxygenase an polycyclic aromatic hydrocarbon dihydrodiol dehydrogenase inPseudomonasputidaOUS82[J]. Journal of bacteriology, 1994, 176(8): 2444-2449.
[23] 王涛, 蓝慧, 田云, 等. 多环芳烃的微生物降解机制研究进展[J]. 化学与生物工程, 2016, 33(2): 8-14.
[24]Mihelcic JR, Luthy RG. Microbial degradation of acenaphthalene and naphthalene under denitriy cationconditions in soil-water systems[J]. Applied Environmental Microbiology, 1988, 54: 1188-1198.
[25]Rockne KJ, Sanford JCC, Sanford RA, et al. Anaerobic naphthalene degradation by microbial pure cultures under nitrate-reducing conditions[J]. Applied and Environmental Microbiology, 2000, 66(4): 1595-1561.
[26] 侯晓鹏, 李春华, 叶春,等.不同电子受体作用下微生物降解多环芳烃研究进展[J]. 环境技术工程学报, 2016, 6(1): 78-84.
[27] Hayes LA, Nevin KP, Lovely DR. Role of priorexposure on anaerobic degradation of naphthalene and phenanthrene in marine harbor sediments[J]. Organic Geochemistry, 1999, 30: 937-945.
[28] Tsai JC, Kumar M, Lin JG. Anaerobic biotransformation of fluorene and phenanthrene by sulfate-reducing bacteria and identification of biotransformation pathway[J]. Journal of Hazardous Materials, 2009, 164: 847-855.
[29]孙明明, 滕应, 骆永明. 厌氧微生物降解多环芳烃研究进展[J]. 微生物学报, 2012, 52(8): 931-939.
[30]Hammel KE, Gai WZ, Green B, et al. Oxidative degradation of phenanthrene by the ligninolytic fungus Phanerochaete chrysosporium[J]. Applied and Environmental Microbiology, 1992, 58(6): 1832-1838.
[31] Bezalel L, Hadar Y, Cerniglia CE. Enzymatic mechanisms involved in phenanthrene degrade ation by the white rot fungus pleurotus ostreatus[J]. Applied and Environmental Microbiology, 1997, 63(7): 2495-2501.
[32] Tuor U, Winterhalter K, Fiechter A. Enzymes of white-rot fungi involved in lignin degradation and ecological determinants for wood decay[J]. Journal of Biotechnology, 1995, 41(1): 1-17.
[33]侯梅芳, 潘栋宇, 黄赛花. 微生物修复土壤多环芳烃污染的研究进展[J]. 生态环境学报, 2014, 23(7): 1233-1238.
[34]李烜桢, 林先贵.白腐真菌修复多环芳烃污染土壤及其降解机理的研究进展[J]. 安全与环境学报,2009,9(6):71-76.
[35] Leadbetter ER, Foster JW. Oxidation products for med from gaseous alkane by the bacterium pseudomonas metharica[J]. Archives of Biochemistry and Biophysic, 1959,(82): 491-492.
[36] 滕菲, 杨雪莲, 李凤梅, 等. 微生物对环境中难降解有机污染物共代谢作[J]. 微生物学杂志, 2016, 36(3): 81-85.
[37] 吕雪峰, 王坚. 污染土壤生物修复的共代谢机制研究进展[J]. 科技创新导报, 2013, 3: 49-52.
[38] 巩宗强, 李培军, 王新, 等. 真菌对土壤中苯并[a]芘的共代谢降解[J]. 环境科学研究, 2001, 14(6): 36-39.
[39] Ambrosoli, Petruzzelli L, LuisAnaerobic MJ,et al. PAH degradation in soil by a mixed bacterial consortium under denitrifying conditions[J]. Chemosphere, 2005,60(9):1231-1236.
[40] Bogan BW,Sullivan WR.Physicochemical soil parameters affecting sequestration and mycobacterial biodegradation of polycyclic aromatic hydrocarbons in soil[J].Chemosphere, 2003,52 (10):1717-1726.
[41] Khan AA, Wang RF, CaoWW.et al.Reclassification of a Polycyclic Aromatic Hydrocarbon-Metabolizing Bacterium, Beijerinckia sp. Strain B1, as Sphingomonas yanoikuyae by Fatty Acid Analysis[J]. International Journal of Systematic Bacteriology, 1996, 46(2):466-469.
[42]Hegde RS, Fletcher JS. Influence of plant growth stage and season on the release of root phenolics by mulberry as related to development of phytoremediation technology[J]. Chemosphere, 1996,32(12):2471-2479.
[43] 丁克强, 骆永明. 多环芳烃污染土壤的生物修复[J]. 土壤, 2001, (4): 169-178.
[44]Kiyohara H. Cloning and characterization of a chromosomal gene cluster, pah, that encodes the upper pathway for phenanthrene and naphthalene utilization byPseudomonasputidaOUS82[J]. Journal of Bacteriology, 1994, 176(8): 2439-2443.
[45] 曹晓星, 田蕴, 胡忠, 等. PAHs降解基因及降解酶研究进展[J]. 生态学杂志, 2007, 26(6): 917-924.
[46] 杨杨, 杨江科, 熊炜, 等.Aeromonassp. XJ-6双加氧酶基因的克隆、表达及对酪氨酸的降解[J]. 中国生物工程杂志, 2016, 36(5):59-67.
[47] 周鑫淼, 陈洁君, 耿立召, 等. 邻苯二酚2,3-双加氧酶结构和功能的研究进展[J]. 生物技术通报, 2007, (4): 51-54.
[48] 张丹, 李兆格, 包新光, 等. 细菌降解萘、菲的代谢途径及相关基因的研究进展[J]. 生物工程学报, 2010, 26(6): 726-734.
[49] Stingley RL,Khan AA,Cemiglia CE,et al.Molecular eharaeterization of a Phenanthrene Degradation Pathway inMycobacteriumvanbaaleniiPYR-l[J].Biochemical and Biophysical Research Communications,2004,322:133-146.
[50] Habe H,Omori T.Rhizoremediation of dioxin-like compounds by a recombinant Rhizobium tropici strain expressing carbazolel 1,9a-dioxygenaseconstitutively[J].Bioscience Biotechnology and Biochemistry,2003,67(2):225-243.
[51] 崔玉霞, 金洪钧. 微生物降解PAHs有机污染物分子遗传学研究进展[J]. 环境污染治理技术与设备, 2001, 2(6): 6-23.
[52] Pinyakong O, Habe H, Yoshidaa T, et al. Identification of three novel salicylate-hydroxylases involved in the phenanthrene degradation ofSphingobiumsp. strain P2[J]. Biochemical and Biophysical Research Communication, 2003, 30: 350-357.
[53] Kiyohara H, Torigoe S, Kaida N, et al. Cloning and charaeterization of achromosoma gene cluster, Pah, that eneodes the upper path way for phenanthrene and naphthalene utilization by Pseudomon as PutidaOUS82[J]. Journal of Bacteriology, 1994, 76(8):2439-2443.
[54] Saito A, Iwabuehi T, Harama S. A novel Phenanthrene dioxygenase fromNocardioidessp.Strain KP7: expression inEscherichiacoli[J]. Journal of Bacteriology, 2000, 182(8): 2134-2141.
[55] 赵和平. 菲降解菌分离鉴定、降解基因克隆与表达及菲跨膜作用研究[D]. 上海:同济大学, 2007.
[56] 杨峰, 钟鸣, 白鹏, 等. 土壤中微生物对多环芳烃的降解及其生物修复的研究进展[J]. 辽宁农业科学, 2011,(4): 53-57.
[57] 郭伟, 何孟常, 杨志峰. 土壤沉积物中石油烃微生物降解研究综述[J]. 矿物岩石地球化学通报, 2007, 26(3):276-283.
[58] Zhang X, Young LY. Carboxylation as an initial reaction in the anaerobic metabolism of naphthalene and phenanthrene sulfidogenic consortia[J]. Applied Environmental Microbiology, 1997, 63(12): 4759-4764.
[59] 林纪旺. 土壤中多环芳烃生物有效性研究进展[J]. 安徽农学通报, 2011, 17(08): 34-37.
[60] 孙萍, 高永超, 张强. 多环芳烃污染土壤微生物修复技术[J]. 安徽农业科学, 2014, 42(19): 6220-6223.
[61] Zhu LZ, Zhang M. Effect of rhamnolipids on the uptake of PAHs by ryegrass[J]. Environment Polllution, 2008, 156(1): 46-52.
[62] Pantsyrnaya T, Delaunay S, Goergen JL, et al. Biodegradation of phenanthrene by Pseputida and a bacterial consortium in the presence and in the absence of asurfactant[J] . Indian Journal Microbiology, 2012, 52(3): 420-426.
[63] Zhou Y, Wei JS, Jiang T. Characterisation of a thermostable catechol-2,3-dioxygenase from phenanthrene-degradingPseudomonassp. strain ZJF08[J]. Annals of Microbiology, 2007, 57(4): 503-508.
[64] 陶雪琴, 党志, 卢桂宁. 污染土壤中多环芳烃的微生物降解及其机理研究进展[J]. 矿物岩石地球化学通报, 2003, 22(4): 356-360.
[65] 徐成斌, 王闻烨, 李鲜珠. 一株菲降解菌的鉴定及降解特性[J]. 环境科学学报, 2015, 35(3): 684-691.
[66] Barbara MK. The effect of temperature on the rate of disappearance of polycyclic aromatic hydrocarbons from soils[J]. Environmental Pollution, 1993, 79(1): 15-20.
[67] 祝儒刚, 李玉双. 菲降解细菌L2的培养条件研究及菲降解率测定[J]. 安徽农业科学, 2006, 34(3): 407-408.
[68] 王莉, 史鹏, 丁文利, 等. 菲降解菌株的分离、鉴定及其降解条件的研究[J]. 湖北农业科学, 2014, 53(10):2264-2267.
[69] Boyd TJ, Montgomery MT, Steele JK, et al. Dissolved oxygen saturation controls PAHs biodegradation in freshwater estuary sediments[J]. Microbial Ecology, 2005, 49(2): 226-235.
[70] Stapleton RD, Savage DC, Sayler GS, et al. Biodegradation of aromatic hydrocarbons in an extremely acidic environment[J]. Applied and Environmental Microbiology, 1998, 64(11): 4180-4184.
[71] 时莹, 张丹, 孙玮. 菲降解菌株的筛选及特性研究[J]. 西北大学学报, 2009, 39(6): 1009-1013.
[72] 钱翌, 谢晓梅. 污染环境中萘的修复技术研究进展[J]. 化学与生物工程, 2015, (2):1-7.
[73] 张慧, 党志, 易筱筠, 等. 玉米修复芘污染土壤的初步研究[J]. 环境化学, 2010, 29(1): 29-34.
[74] 倪妮, 宋洋, 王芳,等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 3:30-35.
[75] 孙倩. 多环芳烃污染土壤的生物修复现状及发展趋势[J]. 安徽农学通报, 2010, 16(13): 66-67.
[76] 杨辉, 王海霞, 李晓军, 等. 多环芳烃污染土壤的生物修复技术研究进展[J]. 安徽农业科学, 2011, 39(3): 1427-1429.
[77] 高彦征, 凌婉婷, 朱利中, 等. 黑麦草对多环芳烃污染土壤的修复作用及机制[J]. 农业环境科学学报, 2005, 24(3): 498-502.
[78] 田林双, 戴传超, 赵玉婷, 等. 一株内生真菌单独及与水稻联合降解菲的研究[J]. 中国环境科学, 2007, 27(6): 757-762.
[79] 刘世亮, 骆永明, 吴龙华, 等. 菲在黑麦草种植土壤中的降解及其对土壤酶的影响[J]. 土壤学报, 2009, 46(3): 419-425.

