基于建构主义的化学教学设计
盘继德
摘 要:根据建构主义理论,教师在进行化学教学设计时,要努力创设真实、复杂的问题情境,同时要为学生创设合作学习的环境,强调合作中的表现、交流、沟通、讨论等群体互动对知识建构的内在意义和价值,在评价时,设计多种不同的评价方式,以反映学生真实的水平。
关键词:建构主义;教学设计;离子反应
一、建构主义对化学教学设计的指导
1.建构主义的知识观和学习观
建构主义认为知识的本质是内在的、动态的,知识不能通过传递的方式获得,而只能由每个学习者以原有的知识和经验为基础,主动建构而成。建构主义的知识观决定了建构主义的学习是一个积极内化、主动生成的过程。建构主义学习理论认为,学习过程是以已有的经验为基础,通过外界的相互作用来建构新的理解。学习是一种建构的过程,学生已有经验在学习过程中是一个不容忽视的因素。
2.建构主义的评价观
根据建构主义的观点,评价的对象不仅包括学生的学习结果,还包括学习的过程;评价的主体不仅是教师,还有学生。学生通过自我评价,才能对自己的学习进行反思。所以,建构主义的评价是基于动态的、持续的、不断呈现的学习过程以及学习者的进步,教师所采用的教学策略和所创设的学习环境。其目标在于如何根据需要和实际情况修改教学策略,使学生不断取得进步。
3.建构主义的四个要素
建构主义的四个要素:情境、协作、会话和意义建构。联系和思考是意义建构的关键,所以进行课堂教学设计首先就要创设一定的教学情境,引导学生联系和思考,启动学生的意义建构。
4.建构主义学习环境下教学设计的内容和步骤
建构主义理论指导下的教学設计包括以下几个内容:教学目标分析、情境创设、信息资源设计、自主学习设计、协作学习环境设计、学习效果评价设计、强化练习设计。在化学教学设计过程中需要结合化学学科的特点,按照这几个步骤进行化学教学设计。
化学教学目标设计,明确地提出教学目标,有利于明确教学工作方向,选择最优的教学策略。
教学情境创设要求通过创设学习情境使学生产生学习的兴趣和动机,调动学生的学习积极性和主动性,改变以教师为中心、课本为中心的机械性接受学习方式。
信息资源设计要求教师与学生共同确定学习某一主题所需信息资源,同时引导自主收集和处理,充分利用相关信息,并获知相关信息在该主题中的地位和作用。
自主学习设计需要根据所选择的教学进行相应的教学设计。
协作学习环境的设计是基于个人的基础上通过设置对会、讨论等活动,使学生、教师、环境之间共同作用而获得理解的设计。
学习效果评价设计主要围绕三个方面:自主学习能力;协作学习过程中做出的贡献;是否达到意义建构的要求。应设计出与学生实际相符的,能反映学生实际的评价方式。
课堂练习是课堂教学内容的一个重要环节。不仅可以帮助学生复习和巩固所学的知识与技能,同时,也可以检查教师的教学效果,为教师提供教学反馈。化学练习的设计应遵循几个原则:目的性和整体性原则,全面性和典型性原则,启发性和趣味性原则。
二、“离子反应”教学设计
根据建构主义的教学设计理论,对“离子反应”第一节课进行相应的教学设计。
1.教学目标
知识技能:了解电解质、强电解质、弱电解质的含义;如何区别电解质和非电解质、强电解质和弱电解质。
过程与方法:通过实验观察与分析,提高学生用科学方法分析问题的能力。
情感态度价值观:渗透透过现象看本质的辩证唯物主义方法;通过强弱电解质判断的实验,激发学生学习化学的兴趣。
2.教学过程(包括情境创设、信息资源设计、自主学习设计、协作学习环境设计)
从生活常识引入——情境创设
[思考]在一间屋子里,由于线路老化,引起火灾,为了灭火,小明找来水管,用水灭火,请问他的做法是否正确,为什么?
[讲述]复习初中学习过酸、碱、盐在水溶液中的导电实验,说明溶液可以导电。
[思考、分析]这些溶液为什么会导电呢?以NaCl固体为例分析,通过观看NaCl溶液及熔融状态下导电的动画视频,分析得出电解质和非电解质的定义。
[板书]电解质和非电解质
巩固知识,加深理解——练习设计。
[练习]请同学们判断下列物质中哪些是电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、NaCl溶液、H2O、酒精。
[总结归纳]电解质的特点:(1)化合物,对于不是化合物的物质既不是电解质也不是非电解质(如单质、混合物);
(2)条件:是在水溶液或者是熔融状态,两个条件只需满足其中之一;
(3)能够导电;
(4)电解质应是在一定条件下本身电离而导电的化合物,溶于水不是指和水反应;
(5)某些难溶于水的化合物,但其溶解部分是完全电离的,所以也是电解质。
观察、分析实验现象——信息资源、协作学习设计。
[实验]在五个相同的烧杯中,分别倒入相同条件下(溶液体积、浓度和离子所带的电荷数)的盐酸、醋酸溶液、氢氧化钠溶液、氯化钠溶液和氨水,接通电源后,观察实验现象。
[思考]在相同条件下,影响物质导电能力强弱的原因是什么?(引导学生从电解质为什么能够导电,其导电性与什么的有关思考)
[收集资料得出结论]电解质溶液导电能力的大小决定于溶液中自由移动离子的浓度和离子所带电荷数。
[板书]溶液导电性的影响因素:离子浓度、离子所带电荷
[讲述]通过实验观察、讲述对比分析以上五种溶液得出在同等条件下,不同电解质的电离程度是不同的。据此,我们将电解质分为强电解质和弱电解质。
[板书]强电解质和弱电解质
像NaCl等在水溶液中全部电离成离子的电解质我们称为强电解质,而像NH3·H2O、H3COOH等,在水溶液中只一部分电离成离子的电解质弱电解质。
[讨论]BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质?CH3COOH易溶,是否属强电解质?
[归纳小结]BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们为强电解质H3COOH易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解性无必然联系,本质区别在于它们在水溶液中的电离程度。
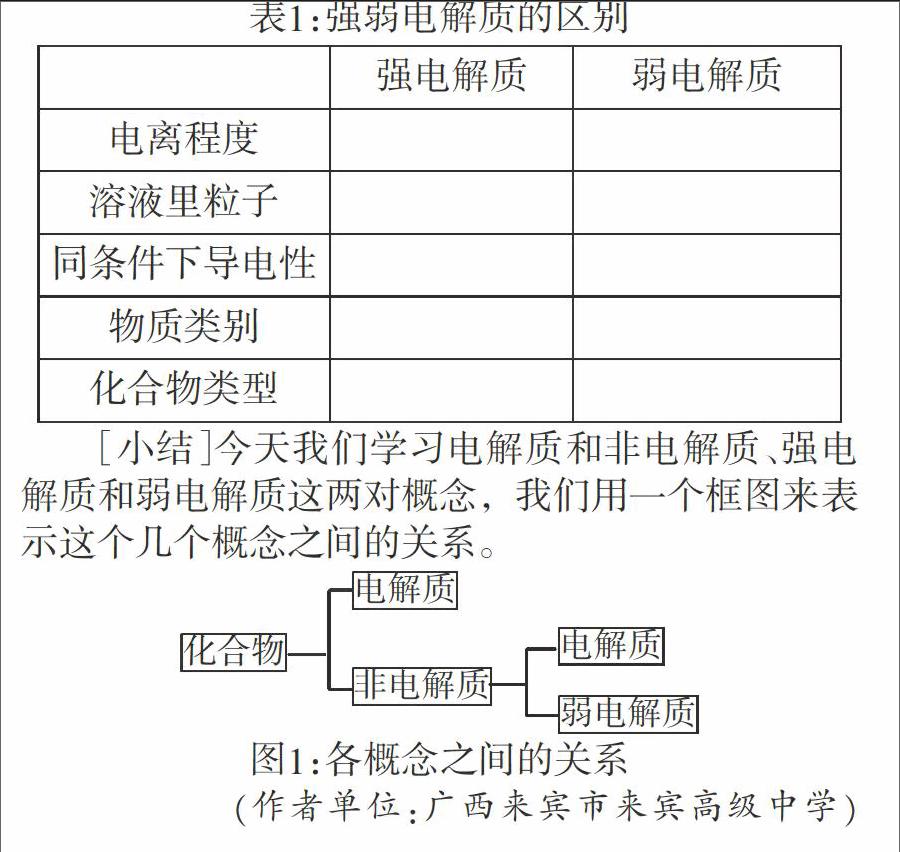
[思考练习]强弱电解质的区别(填表)
[小结]今天我们学习电解质和非电解质、强电解质和弱电解质这两对概念,我们用一个框图来表示这个几个概念之间的关系。
(作者单位:广西来宾市来宾高级中学)endprint

