雌激素对子宫内膜异位症患者在位子宫内膜间质细胞合成NGF及COX-2的影响及传导通路研究
刘 鑫,王化丽,王悦阳,姜 盟
(1.辽宁省鞍山市妇儿医院,辽宁 鞍山 114000;2.辽宁省大连市妇幼保健院,辽宁 大连 116000)
雌激素对子宫内膜异位症患者在位子宫内膜间质细胞合成NGF及COX-2的影响及传导通路研究
刘 鑫1,王化丽2,王悦阳2,姜 盟2
(1.辽宁省鞍山市妇儿医院,辽宁 鞍山 114000;2.辽宁省大连市妇幼保健院,辽宁 大连 116000)
目的 观察雌激素(E2)对子宫内膜异位症(EMs)患者在位子宫内膜间质细胞(ESC)合成神经生长因子(NGF)及环氧化酶-2(COX-2)的影响,以及阻断核因子-κB(NF-κB)信号通路后ESC合成NGF及COX-2的变化,探讨雌激素导致EMs患者疼痛的可能信号传导通路。方法 体外分离培养42例EMs患者在位ESC,用10-8mol/L E2(E2组)、25μmol/L NF-κB抑制剂 (PDTC)+10-8mol/L E2(E2+PDTC组)处理细胞24h后,采用Western blot及逆转录聚合酶链反应(RT-PCR)技术分别检测ESC合成NGF、COX-2蛋白及mRNA水平的变化。结果 E2组NGF、COX-2的蛋白及mRNA均高于对照组,差异均有统计学意义(t值分别为4.745、6.317、3.465、5.443,均P<0.05)。E2+PDTC组 NGF、COX-2的蛋白及mRNA均低于E2组,差异均有统计学意义(t值分别为3.675、5.319、7.132、8.514,均P<0.05),但仍高于对照组,差异均有统计学意义(t值分别为3.526、4.733、4.261、5.513,均P<0.05)。结论 在体外,雌激素可促进EMs患者在位ESC中NGF、COX-2表达,PDTC可部分抑制这种作用,说明NF-κB通路参与了雌激素调节EMs在位ESC中NGF、COX-2表达调控,阻断和调控NF-κB信号通路的活性可能为治疗EMs提供新策略。
子宫内膜异位症;17β-雌二醇;神经生长因子;环氧化酶-2;NF-κB信号通路
子宫内膜异位症(endometriosis,EMs)是一种雌激素依赖性疾病,雌激素可以直接刺激异位内膜细胞增殖、促进新生的血管内皮细胞增生迁移及刺激多种细胞因子产生,共同参与EMs的发病过程。疼痛是EMs患者的主要临床表现,神经支配、炎症反应是EMs患者疼痛的可能机制[1]。EMs子宫内膜神经生长因子(nerve growth factor,NGF)及环氧化酶-2(cyclooxygenase-2,COX-2)的表达与神经纤维分布和疼痛的严重程度相关[2-3]。为进一步了解雌激素对EMs疼痛产生的作用,本研究通过体外实验的方法,观察雌激素对EMs患者在位子宫内膜间质细胞(endometrial stromal cells,ESC)合成NGF、COX-2的影响,以及阻断核因子-κB(nuclear factor-κB,NF-κB)信号通路后ESC合成NGF、COX-2的变化,探讨雌激素作用导致EMs疼痛的可能信号传导通路,为EMs疼痛的治疗提供新思路、新方法。
1材料与方法
1.1材料
1.1.1细胞来源
选取42例于2012年7月至2013年2月就诊于大连市妇幼保健院因EMs行全子宫切除术患者为研究对象。该研究经伦理委员会通过,患者亦知情同意。患者平均年龄为33.20±3.61岁。所有患者均于子宫内膜增殖期(月经7~14天)入院行开腹或腹腔镜手术,排除子宫腺肌症、盆腔炎、子宫肌瘤,术前3个月内未服用过激素类药物。术中子宫离体后,立即留取部分子宫在位内膜组织,进行细胞培养,各例内膜细胞分别行分离培养。另取内膜组织送病理学检查,排除内膜病变。收集4代以内的在位内膜间质细胞。
1.1.2主要试剂
17β-雌二醇、兔抗人NGF单克隆抗体和鼠抗人COX-2单克隆抗体(Abcam,英国),NF-κB抑制剂(Ammonium pyrrolidinedithiocarbamate,PDTC)(Sigma,美国),培养基RPMI-1640、胎牛血清、Ⅰ型胶原酶和胰蛋白酶(Gibco,美国);人B-波形蛋白单克隆抗体(person B vimentin monoclonal antibodies,DAKO,丹麦);辣根过氧化物酶标记的羊抗鼠、兔抗体(福建迈新公司);BCA蛋白浓度测定试剂盒和ECL发光试剂盒(pierce chemieal,美国);NGF、COX-2、GAPDH引物和RT-PCR技术检测试剂盒(大连宝生物公司)。
1.2方法
1.2.1子宫内膜间质细胞的分离与纯化
参照Osteen等和Mylonas等方法加以改良:去除血凝块,将内膜剪碎至0.5~1mm3大小,D-Hanks液反复冲洗以去除红细胞。加入0.1%Ⅱ型胶原酶,于37℃水浴箱中振摇15min,10%胎牛血清的培养液终止消化,分别经200目及400目的细胞筛网依次过滤,以1 000r/min离心5min,D-Hanks液冲洗2次,1 000r/min离心5min,加入含10%胎牛血清的培养液,制成间质细胞悬液,接种于培养瓶,置于37℃、5%CO2的培养箱中培养,隔日换液。
1.2.2子宫内膜间质细胞纯度鉴定
分离、纯化的子宫内膜间质细胞培养24h后,弃培养液,PBS洗涤;4%多聚甲醛固定15min,PBS洗涤;加入封闭液,37℃ 20 min,加入鼠抗人波形蛋白抗体,37℃孵育2h;PBS洗涤;S-P法染色,用PBS代替第一抗体作阴性对照。
1.2.3子宫内膜间质细胞的传代培养
待细胞铺满培养瓶80%以上倒掉培养液,PBS清洗,加入0.1%Ⅱ型胶原酶,于37℃温箱中消化,待基质细胞收缩变圆时,加入含10%胎牛血清的培养液终止消化,1 000r/min离心5min,弃上清,以含10%胎牛血清的培养液悬浮,按1:2或1:3的比例传代。
1.2.4子宫内膜间质细胞体外处理
ESC培养体系建立后收集4代以内的细胞以5×105/mL的细胞密度接种于12孔培养板行体外药物处理。生长状态良好的细胞,将培养液更换为无血清的培养液,培养24h后,以减少血清对实验的干扰,分组后进行药物处理。对照组:无血清培养液;E2组:10-8mol/L E2+培养液;E2+PDTC组:细胞首先进行1h的25μmol/L PDTC预培养,然后再加入终浓度为10-8mol/L的E2。培养24h后收集细胞。每组设10个平行孔。
1.2.5 Western blot检测
用PBS清洗培养的ESC后刮取收集的细胞,离心后,沉淀加入100μL 4℃预冷的细胞裂解液(10% 10×PBS、1% Triton X-100、5g/L脱氧胆酸钠、1g/L SDS、0.5g/L aprotinin、1mmol/L苯磺酰氟、1mmol/L EDTA),将细胞裂解 13 000r/min离心20min。取上清液由蛋白浓度检测法(bicinchoninic acid,BCA)检测蛋白浓度。取50μg蛋白样品进行电泳、转膜、封闭,加入兔抗人NGF(浓度1:100)和兔抗人COX-2(浓度1:100)单克隆抗体4℃过夜,洗涤后加入辣根过氧化物酶标记的羊抗兔二抗,37℃孵育1 h,显色,计算机扫描,应用图像分析软件检测各条带吸光度值。
1.2.6 RT-PCR检测
Trizol试剂盒一步法提取ESC的总RNA,逆转录扩增cDNA。NGF上游引物:5′- CTTCAGCATTCCCTTGACACT - 3′,下游引物:5′-GCTCCTGTGAGTCCTGTTGAA- 3′,扩增片段240bp。COX- 2上游引物:5′- ACTCACTCAGTTTGT ̄TGAGTCATTC-3′,下游引物:5′-TTTGATTAGTACTGT ̄AGGGTTAATG -3′,扩增片段583bp。内参GAPDH上游引物:5′- AGAAGGCTGGGGCTCATTTG- 3′,下游引物5′-AGGG ̄GCCATCCACAGTCTTC- 3′,扩增片段258bp。引物反应体系:RNase Free dH2O 28.75μL,5×PCR Buffer10μL。TaKaRa Ex Taq HS 0.25μL,上游引物0.5μL,下游引物0.5μL。反应条件:94℃,预变性2min,94℃变性30s,57℃,退火30s,72℃,延伸30s,循环35次,72 ℃,最终延伸2min。扩增产物在琼脂糖凝胶中电泳20~30min,用凝胶图像分析仪摄片,并进行吸光度定量分析。
1.3统计学方法
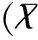
2结果
2.1子宫内膜间质细胞培养及鉴定结果
倒置显微镜下观察,新分离的ESC多成圆形,接种24h后大部分可贴壁,细胞呈多边形或梭形,外形轮廓清楚,折光性强,细胞质薄,细胞核不明显,细胞之间平行排列或放射状排列,细胞之间较独立。原代培养的ESC特异性标记分子骨架蛋白波形蛋白染色阳性,计数细胞波形蛋白染色阳性细胞数,细胞纯度均可达90%~95%,见图1。
图1 ESC波形蛋白免疫组化法鉴定(×100)
Fig.1 ESC vimentin identified by immunohistochemistry (×100)
2.2各组子宫内膜间质细胞中NGF和COX-2 mRNA的表达
ESC在无血清培养的基础状态下,有NGF mRNA和COX-2 mRNA的表达;E2组ESC中NGF mRNA和COX-2mRNA的表达较对照组显著增加(t值分别为3.465、5.443,均P<0.05);加入NF-κB的抑制剂PDTC后,NGFmRNA和COX-2mRNA的表达较E2组明显减少(t值分别为7.132、8.514,均P<0.05),但仍高于对照组(t值分别为4.261、5.513,均P<0.05),见表1和图2。



组别 NGF COX⁃2 mRNA蛋白mRNA蛋白对照组1.01±0.112.01±0.121.64±0.250.98±0.13E2组2.36±0.306.41±0.363.98±0.123.80±0.21E2+PDTC组1.68±0.255.18±0.202.73±0.192.76±0.25t3.465∗4.745∗5.443∗6.317∗P0.006 0.005 0.005 0.003 t7.132∗∗3.675∗∗8.514∗∗5.319∗∗P0.001 0.002 0.004 0.002
注:*E2组与对照组比较;**E2+PDTC组与E2组比较。

M 1 2 3 4

M 1 2 3 4
图2 RT-PCR测定ESC中NGF和COX-2mRNA的表达情况
Fig.2 Expressions of NGF and COX-2mRNA in ESC determined by RT-PCR
2.3各组子宫内膜间质细胞中NGF和COX-2蛋白的表达
ESC在无血清培养的基础状态下,有NGF和COX-2蛋白的表达;E2组ESC中NGF和COX-2蛋白的表达较对照组显著增加(t值分别为4.745、6.317,均P<0.05);加入NF-κB的抑制剂PDTC后,NGF和COX-2蛋白的表达较E2组明显减少(t值分别为3.675、5.319,均P<0.05),但仍高于对照组(t值分别为3.526、4.733,均P<0.05),见表1和图3。

图3 Western blot测定ESC中NGF和COX-2蛋白的表达情况
Fig.3 Expressions of NGF and COX-2 in ESC determined by Western blot
3讨论
3.1子宫内膜异位症的概述
EMs是育龄期妇女常见的雌激素依赖性的慢性炎症性疾病,疼痛是主要表现之一,严重影响患者的生活和工作质量。EMs患者和非EMs患者在位子宫内膜的分子及生物学特性存在差异,EMs发病取决于患者在位子宫内膜的特性,经血逆流只是实现这一由潜在到发病的桥梁,据此提出“在位内膜决定论”的新观点。故本研究选择EMs患者的在位子宫内膜为研究对象。
疼痛是伤害性刺激作用于机体引起的一种复杂的心理和生理过程,伤害性刺激、神经纤维末梢和神经介质是疼痛产生的必备条件。EMs的疼痛涉及神经系统、免疫细胞、炎症反应及激素作用,是一种包含神经源性疼痛、炎症性疼痛、内脏-内脏痛觉过敏的混杂性疼痛,并且受激素水平的调节。
3.2神经生长因子与子宫内膜异位症
NGF是一种具有神经元营养和促神经突起生长双重生物学功能的神经细胞生长调节因子,对中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用。有研究证实EMs患者在位子宫内膜存在NGF和神经纤维的异常高表达,且与疼痛的严重程度有关[2]。本研究证明,体外培养EMs患者在位子宫内膜间质细胞有NGFmRNA及其蛋白的表达。NGF可以使异位病灶周围正常组织的神经纤维向异位病灶内生长,诱导P物质(SP)、降钙素基因相关肽(CGRP)、神经肽等致痛物质的生成,刺激末梢神经纤维,产生疼痛。本研究也表明,雌激素能够刺激EMs患者ESC的 NGFmRNA及其蛋白的分泌。EMs患者在位子宫内膜的神经纤维的产生受性激素特别是雌激素的调控,雌激素可刺激NGF及其受体的表达,改变NGF及TrkA的分布格局[3],进而诱导神经纤维的萌生,导致持续性疼痛的产生。应用拮抗雌激素的口服避孕药治疗EMs后,子宫内膜及肌层的NGF表达均明显下降,神经纤维也显著减少,从而缓解了痛经症状,说明雌激素可通过调节NGF的表达介导疼痛的产生。
3.3环氧化酶-2与子宫内膜异位症
COX-2是花生四烯酸(AA)代谢过程中调节前列腺素(PGs)合成的一种重要的限速酶,主要参与炎症反应、疼痛信号的传递及肿瘤的发生发展。EMs患者子宫内膜COX-2的表达与疼痛相关[4]。本研究证明,体外培养EMs患者子宫内膜间质细胞有COX-2 mRNA和蛋白的表达,并且雌激素能够促进COX-2的分泌。COX-2水平的升高促进前列腺素E2(prostaglandin E2,PGE2)的产生增加,而PGE2既是重要的炎症介质又是重要的致痛因子,它能增强血管通透性,增加血流,能激活神经元增加神经末梢的痛觉敏感性,它还是芳香化酶的重要激活蛋白,这便形成了一个持续产生E2和COX-2-PGE2的正反馈循环,从而引起EMs疼痛[5]。而特异性的COX-2抑制剂可明显减轻EMs的疼痛[6]。
3.4 阻断核因子-κB与子宫内膜异位症
NF-κB作为信号转导途径中的枢纽,在机体的免疫反应和炎症反应,以及细胞的生长调控等方面调节基因的转录。在细胞静息状态时,NF-κB与它的抑制因子I-κB结合,以无活性形式存在于细胞质中,当受到外界刺激时I-κB解离,NF-κB活化进入细胞核内,启动靶基因的表达。PDTC可以抑制NF-κB的活化和向细胞内转移,阻断NF-κB传导途径的信号传导。
NF-κB可通过调节多种靶基因的表达,参与免疫和炎症反应、增殖和抗凋亡反应、黏附和侵袭反应等,从而促进EMs的发生、发展[7]。有研究表明,在健康妇女的子宫内膜组织中,NF-κB处于低激活状态,而在EMs病灶中,NF-κB的活性明显增加,阻断NF-κB信号通路可以有效地抑制EMs的发展,一些抑制NF-κB通路的药物已被证明可以有效地减少EMs相关的症状[7]。本研究表明,应用PDTC可以使雌激素诱导的NGF、COX-2 mRNA和蛋白生成减少,说明雌激素通过NF-κB途径诱导NGF和COX-2的生成,NGF和COX-2基因启动子上存在NF-κB结合位点,活化的NF-κB入核后启动相应基因的转录和翻译,刺激神经纤维和炎症反应,导致EMs疼痛。但抑制NF-κB信号通路后,并没有完全阻断雌激素的促进作用,表明除了NF-κB信号通路外可能还有其他的信号通路参与此过程。
EMs是症状依赖性疾病,其治疗应以减轻症状为主,在药物及手术治疗均不理想的今天,采取新的治疗方法显得格外重要。对EMs相关疼痛的产生机制及其治疗方法仍需不断进行研究。需要注意的是,完全、持续阻断NF-κB信号通路又将导致免疫缺陷和健康细胞的凋亡[1]。尽管如此,抑制NF-κB信号通路的激活在治疗EMs中仍有着其良好的应用前景,可能成为EMs疼痛治疗的新策略。
[1]González-Ramos R,Van Langendonckt A,Defrère S,etal.Involvement of the nuclear factor-κB pathway in the pathogenesis of endometriosis[J].Fertil Steri1,2010,94(6):1985-1994.
[2]刘莉娜,姜盟,王广兰,等.子宫内膜异位症在位内膜神经纤维分布与疼痛关系的研究[J].实用妇产科杂志,2012,28(8):654-657.
[3]Li B,Sheng X,Song M,etal.Expression of nerve growth factor and its receptors TrkA and p75 in the uterus of wild female ground squirrel(Citellus dauricus Brandt)[J].Gen Comp Endocrinol,2012,176(1):62-69.
[4]王化丽,姜盟,刘莉娜.环氧合酶-2与子宫内膜异位症疼痛的相关性研究[J].中国妇产科临床杂志,2013,14(3):260-262.
[5]童婧,汪希鹏.子宫内膜异位症引起慢性盆腔痛的机制及治疗新进展[J].现代妇产科进展,2011,20(2):139-143.
[6]Agachan Cakmakoglu B,Attar R,Kahraman O T,etal.Cyclooxygenase-2 gene and epithelial ovarian carcinoma risk[J].Mol Biol Rep,2011,38(5):3481-3486.
[7]Zhang H,Li M,Wang F,etal. Endometriotic epithelial cells induce MMPs expression in endometrial stromal cells via an NFkappaB-dependent pathway[J].Gynecol Endocrinol,2010,26(6):456-467.
[专业责任编辑:吕淑兰]
Effect of estrogen on the synthesis of NGF and COX-2 and corresponding signal transduction pathway in eutopic endometrial stromal cells of patients with endometriosis
LIU Xin1, WANG Hua-li2, WANG Yue-yang2, JIANG Meng2
(1.WomanandChildren’sHospitalofAnshanCity,LiaoningAnshan114000,China;2.DalianMaternalandChildHealthCareHospital,LiaoningDalian116000,China)
Objective To observe the effect of estrogen (E2) on synthesis of nerve growth factor (NGF) and cycloxygenase-2 (COX-2) in eutopic endometrial stromal cells (ESC) of patients with endometriosis (EMs) and the variation of NGF and COX-2 synthesis in ESC after blocking NF-κB signaling pathway and to investigate the possible signal transduction pathway of estrogen in EMs patients. Methods The eutopic ESC of EMs patients were separated and cultured in vitro. After processed with 10-8mol/L E2(E2group) or 25μmol/L PDTC+10-8mol/L E2(E2+PDTC group) for 24 hours, the synthesis of NGF and COX-2 protein as well as mRNA levels variation in eutopic ESC were detected by Western blot and reverse transcriptase polymerase chain reaction (RT-PCR) technology.Results The expression of NGF, COX-2 protein and mRNA in E2group were higher than those in the control group, and the differences were statistically significant (tvalue was 4.745, 6.317, 3.465 and 5.443, respectively, allP<0.05). The expression of NGF, COX-2 protein and mRNA in E2+PDTC group were lower than those in E2group, and the differences were statistically significant (tvalue was 3.675, 5.319, 7.132 and 8.514, respectively, allP<0.05), but they were higher than those in the control group with statistical significance (tvalue was 3.526, 4.733, 4.261 and 5.513, respectively, allP<0.05). Conclusion In vitro, E2can promote the expressions of NGF and COX-2 protein in eutopic ESC of EMs patients. PDTC can partially inhibit this effect. It indicates that NF-κB signal transduction pathway is involved in regulation of E2on NGF and COX-2 in eutopic ESC of EMs patients. Blocking and regulating the activity of NF-κB signal transduction pathway may provide new strategies for the treatment of EMs.
endometriosis (EMs); 17β-estradiol (E2); nerve growth factor (NGF); cyclooxygenase-2 (COX-2); NF-κB signal transduction pathway
2015-07-06
大连市科技计划资助项目(编号:20110659)
刘 鑫(1986-),女,医师,硕士,主要从事妇科临床工作。
王化丽,主任医师。
10.3969/j.issn.1673-5293.2017.01.018
R711.7
A
1673-5293(2017)01-0051-03

