应用响应面分析法优化Thalassospira sp.Fjfst-332产κ-卡拉胶酶的发酵条件
郭娟娟,卢 旭,曾绍校,张龙涛,李庆旺,郭玉丹,郑宝东
(福建农林大学食品科学学院,福州福建350002)
应用响应面分析法优化Thalassospira sp.Fjfst-332产κ-卡拉胶酶的发酵条件
郭娟娟,卢 旭,曾绍校,张龙涛,李庆旺,郭玉丹,郑宝东
(福建农林大学食品科学学院,福州福建350002)
为提高海旋菌Thalassospira sp.Fjfst-332产κ-卡拉胶酶的能力,采用单因素试验法和响应面分析法对其发酵条件进行优化.在基础产酶培养基的条件下,考察发酵培养基的初始pH、装液量、接种量、温度和转速对κ-卡拉胶酶合成的影响,再选取温度、pH和接种量3个因素进行响应面优化.结果表明,κ-卡拉胶酶在培养基初始pH 7、接种量3 mL、装液量30 mL、转速150 r·min-1、温度25℃的条件下,其酶活力最佳,为106 U·mL-1.
海旋菌Thalassospira sp.Fjfst-332;κ-卡拉胶酶;响应面分析法
卡拉胶是一种硫酸线性多糖,其来源丰富,存在于沙菜、杉藻、麒麟菜和角叉菜等多种红藻中[1].卡拉胶低聚糖及其衍生物在抗肿瘤、抗凝血、抗病毒、抗溃疡、抗氧化及免疫调节等方面有独特的作用.降解卡拉胶获得卡拉胶低聚糖的方法主要有物理法、化学法和生物法3种.物理法效率低且产物不容易控制;而化学法的副产物多,反应条件不易控制,且容易污染环境;生物法是利用各种酶,或者借助产酶微生物的发酵作用,从而降解卡拉胶或降解富含卡拉胶的海藻,具有专一性强、作用条件温和、环境污染少和产物得率高等诸多优点,已成为卡拉胶海藻低聚糖的研究重点[2].
卡拉胶酶是一类多糖水解酶,按酶解底物专一性的不同划分,卡拉胶酶分为λ-卡拉胶酶、κ-卡拉胶酶和ι-卡拉胶酶等.κ-卡拉胶酶属于16族糖苷水解酶(GH16),λ-卡拉胶酶则为新族糖苷水解酶,ι-卡拉胶酶归属于82族糖苷水解酶(GH82)[3].目前,能够有效降解卡拉胶的大多数是海洋细菌,如弧菌属Vibrio[4]、交替单胞菌属Alteromonas[5]、假单胞菌属Pseduomonas[6]和噬纤维菌属Cytophaga[7]等.牟海津[8]于2003年在海洋环境中筛选到一株具有较高活性的卡拉胶降解菌,并对其进行复合诱变选育,成功培育出一株酶活力明显提高的突变株M2-4-4.Khambhaty et al[9]于2007年采集了印度Gujarat西海岸腐烂的海藻,通过对其沉积物样品进行分离,成功得到了一株κ-卡拉胶酶产生菌,并通过16S rDNA鉴定为Pseudomonas elongate.目前,产卡拉胶酶细菌研究最广泛的为假交替单胞菌属,海洋微生物资源继续开发的空间仍非常宽广.
本实验室从角叉菜表面分离获得一株可有效降解κ-卡拉胶多糖的海旋菌Thalassospirasp.Fjfst-332,其降解κ-卡拉胶的功能在国内外文献中尚未见报道.本试验通过单因子筛选和响应面优化,有效提高了该菌κ-卡拉胶酶的酶活力,旨在为进一步开发κ-卡拉胶低聚糖及研究其功能活性提供参考.
1 材料与方法
1.1 材料
1.1.1 菌株 海旋菌Thalassospirasp.Fjfst-332由本实验室分离鉴定,保存于中国典型培养物保藏中心.
1.1.2 试剂与仪器 试剂有κ-卡拉胶,BR级,为北京Solarbio公司产品.仪器有紫外可见分光光度计(北京谱析通用仪器有限责任公司)、DKY-Ⅱ恒温调速回转式摇床(上海杜科自动化设备有限公司)、PB-10 pH计(北京赛多利斯科学仪器有限公司)、HC014-11-01灭菌锅(上海东亚压力容器制造有限公司)和H-1850R离心机(长沙湘仪离心机仪器有限公司).
1.1.3 培养基 传代培养基[8,10](改良2216E培养基):5 g·L-1蛋白胨、15 g·L-1κ-卡拉胶、1 g·L-1酵母膏、200 mL蒸馏水、800 mL人工海水,pH=7.5.
复筛/产酶培养基[8,11]:15 g·L-1NaCl、1 g·L-1酵母膏、2 g·L-1κ-卡拉胶、100 mL无机盐母液,pH 7.5.其中,无机盐母液含20 g·L-1NaNO3、5 g·L-1MgSO4·7H2O、10 g·L-1K2HPO4、1 g·L-1CaCl2,pH=7.5.
1.2 菌种的活化
将保存的菌株Fjfst-332接种于斜面传代培养基中,于28℃恒温培养24 h.使用规格为250 mL的锥形瓶,将斜面上生长良好的菌株接种到30 mL复筛培养基中,于30℃、150 r·min-1摇床培养24 h,再取1 mL发酵液接种于产酶培养基中,于30℃、150 r·min-1摇床培养24 h,制成种子液.
1.3 发酵条件的优化
1.3.1 培养基初始pH的确定 在培养基中加入磷酸盐缓冲液,并控制培养基的初始pH分别为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5,在30℃、150 r·min-1的摇床中发酵培养48 h,检测菌体的生长量及上清液的酶活力,确定最适的培养基初始pH.
1.3.2 装液量的确定 用规格为250 mL的锥形瓶,装液量分别为10、20、30、40、50和60 mL,在30℃、150 r·min-1的摇床中发酵培养48 h,检测菌体的生长量及上清液的酶活力,确定最适的装液量.
1.3.3 接种量的确定 根据确定的最适装液量设定接种量分别为1、2、3、4、5和6 mL,在30℃、150 r· min-1的摇床中发酵培养48 h,检测菌体的生长量及上清液的酶活力,确定最适的接种量.
1.3.4 培养温度的确定 在上述试验确定的最佳发酵产酶条件的基础上进行试验,将接种后的菌株分别放在20、25、30、35和40℃,转速为150 r·min-1的摇床中发酵培养48 h,检测菌体的生长量及上清液的酶活力,确定最适的发酵培养温度.
1.3.5 转速的确定 在上述试验确定的最佳发酵产酶条件的基础上进行试验,将接种后的菌株分别放在100、125、150、175、200和225 r·min-1,25℃的摇床中发酵培养48 h,检测菌体的生长量及上清液的酶活力,确定最适的发酵培养转速.
1.4 响应面优化设计
在单因素试验的基础上,以κ-卡拉胶酶活力为响应值,A(温度)、B(pH)和C(接种量)为自变量,根据Box-Behnken中心组合试验设计,设置三因素三水平响应面试验,试验共设17个试验点.其中,12个为分析因子,5个为零点,零点试验进行5次,以估计误差.试验以随机次序进行,重复3次,取平均值[12].
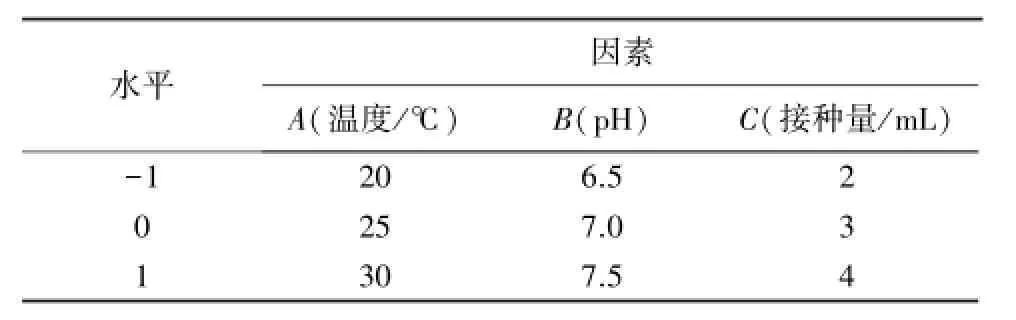
表1 响应面优化设计的因素水平Table 1 Factors and levels of response surface analysis
1.5 指标测定
1.5.1 酶活力的测定 以反应液中还原糖的增加量作为检测κ-卡拉胶酶活力的指标.取1 mL发酵液加入到5 mL 0.2%κ-卡拉胶底物中,于30℃水浴反应1 h,对照组用1 mL灭活酶液和5 mL底物溶液混合.还原糖的产生量采用3,5-二硝基水杨酸(DNS)法测定.取1 mL反应液与1 mL 3,5-二硝基水杨酸混合,沸水浴反应5 min后,冷却,定容至10 mL,以灭活反应液为对照,于540 nm波长下测定光密度(D).以半乳糖标准品做标准曲线,根据反应组和对照组D的差值计算还原糖的产生量[8].1个酶活力单位(U)定义为:在30℃下,1 min产生1 μg还原糖(以半乳糖计)所需要的酶量.
式中,640.5、13.99:还原糖计算公式系数;V:酶添加量+底物的体积(mL);n:稀释倍数;v:酶添加量(mL);T:降解时间(min).
1.5.2 细菌生长量的测定 采用比浊法测定细菌的生长量.比浊法的原理:在一定范围内,悬液中的细菌浓度与混浊度成反比,与D成正比,菌越多,D越大.采用分光光度计测定600 nm波长下细菌悬液的D,以D表示菌量.
1.6 数据分析
试验数据采用DPS软件进行差异显著性分析,采用Design Expert V8.0.6软件进行响应面分析.
2 结果与分析
2.1 培养基初始pH对产酶能力的影响
卡拉胶在水溶液中会先形成胶粒状态,而胶粒周围会进一步形成胶膜,使其很难均匀地分散在水中.适当调节溶剂的pH,能促进卡拉胶更好地溶解,其中,κ-卡拉胶在弱碱性和中性介质中具有较好的分散性[13].培养基的初始pH也强烈影响营养物质的跨膜运输和菌体代谢酶的活性.本试验将培养基的初始pH分别调整为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5,考察pH对菌株生长和产酶能力的影响.结果(图1)表明,pH对于κ-卡拉胶酶活力的影响较大,当培养基的初始pH为7.0时,酶活力最高,同时菌体的生长也达到最佳状态.
2.2 装液量对产酶能力的影响
装样量不仅会影响发酵过程中的通气量,同时也会影响到菌体与营养物之间的接触程度[14-15].本试验在250 mL锥形瓶中分别加入10、20、30、40、50和60 mL培养基,培养一段时间后观察不同的装液量对菌株生长和产酶能力的影响.结果(图2)表明,装液量为30 mL时,菌株降解κ-卡拉胶的能力最强,装液量过少或过多的效果均较不理想,此结果与菌株Pseudoalteromonassp.AJ5发酵培养时,装液量对酶活力的影响[14]较为相似.因为在摇瓶培养的过程中,若装液量太少,会导致培养基剪切力增大,从而减缓菌株的生长速度,进而限制产酶[11],而装液量过多,则会降低培养基的通气量.
2.3 接种量对产酶能力的影响
一般来说,随着接种量的增大,菌体生长的延滞期会相应缩短.为了缩短生产周期,发酵工业上一般会选用较大的接种量[6].本试验将接种量分别设置为1、2、3、4、5和6 mL,考察接种量对菌株生长和产酶能力的影响.结果(图3)表明,当接种量为3 mL时,菌株产酶能力最强,接种量过少或过多均不利于菌株产酶.接种量过多会使菌体繁殖过快,从而加速衰老,因此不利于产酶[12].当接种量为4 mL时,菌体生长量达到最大值,但此时酶活力下降,可能由于菌株利用专一底物产酶时产生了底物竞争,抑制了酶活力.
2.4 转速对产酶能力的影响
摇瓶转速会影响发酵液中的通气量和内溶氧量[1,8].本试验将转速分别设置为100、125、150、175、200和225 r·min-1,考察转速对菌株生长和产酶能力的影响.结果(图4)表明,转速为150 r·min-1时,菌株产酶能力最强.适当地增加转速,有利于提高发酵瓶的通气量和内溶氧量,并加快菌体利用培养基的速度,从而提高产酶能力;而转速过低会降低发酵液中的通气量,形成不利菌体生长的环境,菌体产酶能力受到影响.转速过高酶活力略有下降,可能是由于摇瓶内培养基的剪切力过大[14].
2.5 培养温度对产酶能力的影响
温度对菌株生长和产酶能力的影响很大.本试验考察不同温度(20、25、30、35、40℃)对菌株生长和产酶能力的影响.结果(图5)表明,当温度达到25℃时,产酶能力最强,为菌株的最适生长温度,与PseudoalteromonasWZUC10的最适发酵温度[11]相似.当温度较低时,κ-卡拉胶溶解性差,菌株的生长活动受到抑制,进而影响其产酶能力;当温度过高时,容易使菌株蛋白质核酸变性,菌株大量死亡,影响其产酶能力.
2.6 菌株Fjfst-332发酵条件的响应面优化
2.6.1 响应面分析结果与方差分析 响应面试验结果如表2所示.采用Design Expert V8.0.6软件对κ-卡拉胶酶活力的回归模型进行显著性分析.结果显示,模型的P<0.000 1,表明回归模型显著,且该模型的R2=94.87,R2Adj=97.26%,说明模型具有较好的拟合度.建立的二次响应面回归方程为:
酶活力=105.60-2.29A+4.43B-2.04C+2.01AB+0.99AC+1.72BC-5.41A2-6.50B2-8.58C2
该方程一阶主项A、B、C(P<0.01)均为极显著项,这与之前的单因素分析结论相吻合;二阶项的A2、B2、C2(P<0.01)为显著项且均为负值,说明方程的抛物线函数开口向下,具有极大值点可进行优化分析.方差分析(表3)表明,AB和BC对κ-卡拉胶酶活力的影响显著(P<0.05),说明试验有意义,失拟项值为0.095 2,不显著,方程可以接受.采用Design Expert V8.0.6软件对模型进行优化,得出在温度24.18℃、pH 7.15、接种量2.90 mL的条件下,酶活力最高,为106.556 U·mL-1.考虑到实际操作的方便性,并结合单因素优化条件,取温度25℃、pH 7、接种量3 mL(重复5次),得到的酶活力为106.333 U·mL-1,与估计值相比,相对误差为0.21%,说明拟合模型优化出的条件较为准确.
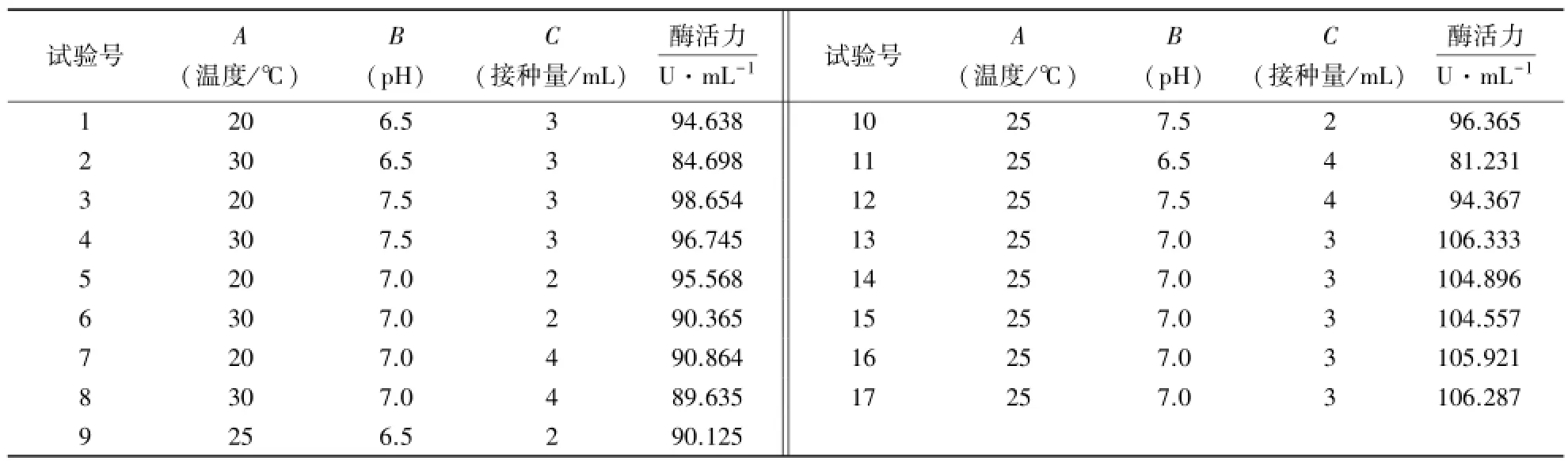
表2 响应面试验设计及结果Table 2 Experiment design and result of response surface analysis
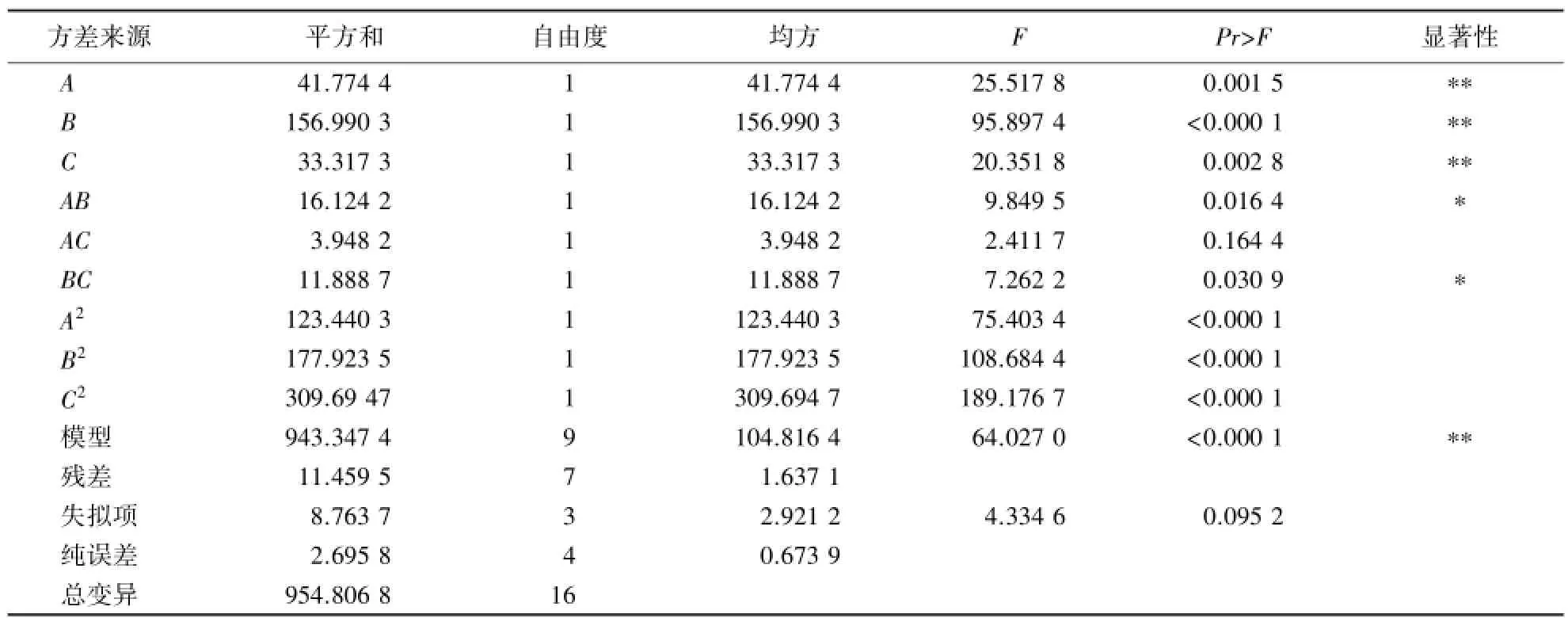
表3 回归方程的方差分析1)Table 3 Analysis of variance for quadric regression model
2.6.2 单因素的交互作用 由图6~8可知,在不同的发酵培养条件下,菌株Fjfst-332降解κ-卡拉胶的能力不同,其酶活力与单因素结果具有较好的一致性.各因素之间有一定的交互作用,其中,发酵温度与pH (P=0.016 4)、发酵pH与接种量(P=0.030 9)之间的交互作用达到显著水平.
图6显示:pH<6.5时,曲线较为平缓,可能由于菌株不耐酸性环境,其降解κ-卡拉胶的能力没有随着温度的提高而增加;pH>7时,菌株降解κ-卡拉胶的能力随着温度的提高,上升幅度较大.图7显示,温度与接种量的交互作用较低(P>0.05),温度较低或者较高时,接种量对菌株降解κ-卡拉胶能力的变化趋势是一致的.图8显示,随着接种量的增加,菌株降解κ-卡拉胶能力的极大值点位置沿着pH>7的方向移动,其数值缓慢增大到极大值后开始有下降的趋势.说明随着接种量的增加,降解能力提高,酶活力达到最佳状态的pH接近于中性[12].
2.6.3 验证试验结果 进一步验证响应面分析法及预测的可靠性,利用优化的条件进行3次发酵试验,测得发酵液的酶活力为107.012 U·mL-1,菌株生长量(D600nm)为2.311,与模型的预测值十分接近,菌体浓度较优化前有所提高,优化后菌株Fjfst-332降解κ-卡拉胶的能力提高了1.98倍,说明响应面分析法对菌株发酵条件优化是准确可靠的.
3 结论
采用单因素试验法和响应面分析法,对海旋菌Thalassospirasp.Fjfst-332的发酵条件进行了优化.在单因素试验的基础上,采用响应面分析法得到最佳的发酵条件为:温度25℃、pH 7、接种量3 mL、装液量30 mL、转速150 r·min-1,此时酶活力最高,为106.333 U·mL-1.对发酵培养条件进行验证的结果表明,采用响应面分析法优化海旋菌Thalassospirasp.Fjfst-332的发酵条件是可行的.106.333 U·mL-1的酶活力与施氏假单胞菌(Pseudomonas stutzeri)的26.5 U·mL-1[16]、假交替单胞菌(Pseudoalteromonas)的6.788 U· mL-1[17]、黄杆菌属(Flavobacterium)的149.8 U·mL-1[18]相比,具有较好的开发优势.本实验室将进一步通过优化培养基配方、建立发酵动力学模型及κ-卡拉胶酶的分离纯化,以期提高菌株产酶能力及κ-卡拉胶酶单位比活力.
[1]DYRSET N,LYSTAD K Q,LEVINE D W.Development of a fermentation process for production of a κ-carrageenase fromPseudomonas carrageenovora[J].Enzyme&Microbial Technology,1997,20(6):418-423.
[2]GUIBET M,COLIN S,BARBEYRON T.Degradation of λ-carrageenan byPseudoalteromonas carrageenovoraλ-carrageenase:a new family of glycoside hydrolases unrelated to κ-and ι-carrageenases[J].Biochemical Journal,2007,404(1):105-114.
[3]LEMOINE M,NYVALL COLLEN P,HELBERT W.Physical state of kappa-carrageenan modulates the mode of action of kappa-carrageenase fromPseudoalteromonas carrageenovora[J].Biochem J,2009,419(3):545-553.
[4]TAYCO C C,TABLIZO F A,REGALIA R S,et al.Characterization of a κ-carrageenase-producing marine bacterium,isolate ALAB-001[J].Philippine Journal of Science,2013,142(1):45-54.
[5]MICHEL G,FLAMENT D,BARBEYRON T.Expression,purification,crystallization and preliminary X-ray analysis of the ιcarrageenase fromAlteromonas fortis[J].Acta Crystallographica,2000,56(6):766-768.
[6]STGAARD K,WANGEN B F,KNUTSEN S H.Large-scale production and purification of κ-carrageenase fromPseudomonas carrageenovorafor applications in seaweed biotechnology[J].Enzyme&Microbial Technology,1993,15(4):326-333.
[7]SUN Y,LIU Y,JIANG K.Electrospray ionization mass spectrometric analysis of kappa-carrageenan oligosaccharides obtained by degradation with kappa-carrageenase from Pedobacter hainanensis[J].J Agric Food Chem,2014,62(11):2 398-2 405.
[8]牟海津.酶法制备κ-新卡拉四、六糖的化学及生物学研究[D].山东:中国海洋大学,2003.
[9]KHAMBHATY Y,MODY K,JHA B.Statistical optimization of medium components for κ-carrageenase production byPseudomonaselongata[J].Enzyme and Microbial Technology,2007,40(4):813-822.
[10]YAO Z,WANG F,GAO Z.Characterization of a kappa-carrageenase from marineCellulophaga lyticastrain N5-2 and analysis of its degradation products[J].Int J Mol Sci,2013,14(12):24 592-24 602.
[11]ZHOU M H,MA J S,LI J.A κ-carrageenase from a newly isolatedPseudoalteromonas-like bacterium,WZUC10[J].Biotechnology and Bioprocess Engineering,2008,13(5):545-551.
[12]古铮.海洋卡拉胶降解菌Cellulophagasp.KL-A的筛选优化及卡拉胶酶研究[D].厦门:厦门大学,2014.
[13]KNUTSEN S H,SLETMOEN M,KRISTENSEN T.19 A rapid method for the separation and analysis of carrageenan oligosaccharides released by iota-and kappa-carrageenase[J].Carbohydr Res,2001,331(1):101-106.
[14]YUEXIN M A,DONG S L,LIU S L,et al.Optimization of κ-carrageenase production byPseudoalteromonassp.AJ5[J]. Breast Cancer Research&Treatment,2010,124(1):63-77.
[15]马素.海洋细菌Cellulophagasp.QY3 ι-卡拉胶酶的研究[D].山东:中国海洋大学,2013.
[16]JOUANNEAU D,BOULENGUER P,MAZOYER J.Enzymatic degradation of hybrid ι-/ν-carrageenan byAlteromonas fortisιcarrageenase[J].Carbohydr Res,2010,345(7):934-940.
[17]WANG L,LI S,ZHANG S.A new κ-carrageenase CgkS from marine bacteriumShewanellasp.Kz7[J].Journal of Ocean U-niversity of China,2015,14(4):759-763.
[18]唐志红,吕家森,张振.产卡拉胶酶海洋菌株的筛选和酶学性质的初步研究[J].食品科技,2011,36(6):18-21.
(责任编辑:施晓棠)
Optimization of fermentation conditions of Thalassospira sp.Fjfst-332 for κ-carrageenase by response surface methodology
GUO Juanjuan,LU Xu,ZENG Shaoxiao,ZHANG Longtao,LI Qingwang,GUO Yudan,ZHENG Baodong
(College of Food Science,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
To increase the production of extracellular κ-carrageenase from marine bacteria Thalassospira sp.Fjfst-332,effects of initial pH,liquid volume,inoculation amount,temperature and shaking speed on enzyme activities were investigated on foundation culture medium based on single factor test.Then interations between temperature,pH and inoculation amount on enzyme activities were determined by response surface analysis to optimize fermentation condition.Results showed that the medium with 3 mL inoculums,30 mL liquid,initial pH of 7 and shaken at 150 r·min-1under 25℃,was attributed to optimal enzyme activity of κ-carrageenase at 106 U·mL-1.
Thalassospira sp.Fjfst-332;κ-carrageenase;response surface analysis
Q939.9
:A
:1671-5470(2016)06-0706-07
10.13323/j.cnki.j.fafu(nat.sci.).2016.06.016
2016-01-04
:2016-03-04
福建省科技计划重点项目(2014I0008);福建省科技重大专项(2015NZ0001-1);国家海洋公益性行业科研专项(201505033).
郭娟娟(1989-),女,博士研究生.研究方向:食品科学与工程.Email:gjjfst15@163.com.通讯作者郑宝东(1967-),男,教授.研究方向:食品科学.Email:zbdfst@163.com.

