角蒿咖啡酸酯对小鼠耳肿胀的抑制作用
黎 丽,李玉珍,丁利平,黄 钟
1) 深圳大学医学部,广东深圳 518060; 2) 中山大学第八附属医院药学部,广东深圳518033
【生物工程 / Bioengineering】

角蒿咖啡酸酯对小鼠耳肿胀的抑制作用
黎 丽1,2,李玉珍2,丁利平1,黄 钟1
1) 深圳大学医学部,广东深圳 518060; 2) 中山大学第八附属医院药学部,广东深圳518033
研究了角蒿咖啡酸酯((+)-2-(1-hydroxyl-4-oxocyclohexyl) ethyl caffeate, JH2)对花生四烯酸(arachidonic acid, AA)致小鼠耳肿胀的抑制作用,探讨其作用机制,采用花生四烯酸诱导的小鼠急性耳肿胀模型评价JH2的体内药效,通过酶联免疫吸附测定实验检测JH2对AA通路中5-脂氧合酶(5-lipoxygenase, 5-LOX)活性的影响.实验结果显示,在AA诱导的小鼠耳肿胀模型中,JH2能显著抑制AA所致的小鼠耳肿胀程度和组织蛋白渗出量,并降低小鼠发炎耳组织中白三烯B4(leukotrienes B4, LTB4) 的生成量.体外活性研究显示,JH2对5-LOX有较强的抑制活性,半抑制浓度IC50值为12.16 μmol/L.说明JH2对AA诱导的小鼠耳肿胀急性炎症具有抑制作用,其作用机制可能与JH2抑制AA通路中5-LOX的活性从而降低炎症介质LTB4的产生有关.
药理学;耳肿胀;角蒿咖啡酸酯;花生四烯酸;5-脂氧酶;白三烯B4
紫葳科(Bignoniaceae)角蒿属(Incarvillea Juss)植物大花鸡肉参Incarvillea mairei var.granditlora (Wehrhahn) Grierson的干燥全草,在中国华南和西南地区被作为一种传统的民间药材应用,具有抗炎镇痛、清热解毒和祛风除湿等功效[1-2].目前,有关大花鸡肉参药材或原植物的植物化学、药理学、化学生物学或生药学方面的详细报道还很少见.为研究大花鸡肉参的中医功效和生物活性的物质基础,本文利用该种植物资源开发高疗效、低毒副作用的新一类抗炎天然药物,从该植物中分离得到的化合物(+)-2-(1-羟基-4-环己酮)乙基咖啡酸酯[3]((+)-2-(1-Hydroxyl-4-oxocyclohexyl) ethyl caffeate,JH2), 深入研究JH2对花生四烯酸(arachidonic acid, AA)诱导的小鼠耳肿胀的抑制作用,初步探讨其作用机制,以对JH2的临床研究提供科学依据.
1 材料与方法
1.1 主要试剂与仪器
5-脂氧酶(5-lipoxygenase, 5-LOX)、脂氧化酶抑制剂筛选试剂盒和白三烯B4(leukotrienes B4, LTB4) 酶联免疫吸附测定实验(enzyme linked immunosorbent assay, ELISA) 试剂盒均购自美国Cayman 公司;伊文思蓝染料、丙酮、甲酰胺溶液、体积分数为10%的福尔马林溶液、苏木精-伊红( hematoxylin-eosin staining, H&E) 染料、0.22 μm滤膜、直径6 mm打孔器和游标卡尺均购自深圳博兴生物科技有限公司;Hettich 32R 离心机(美国Thermo Fisher Scientific公司);ELx800通用酶标仪(美国BioTek公司).
1.2 实验动物
雄性ICR小鼠体质量为18~20 g,购自南方医科大学实验动物中心.动物室温控制在 25 ℃左右,可任意进食饮水.遵循国际公认的实验动物使用规范,科学、合理地进行动物实验.
1.3 小鼠耳肿胀模型造模
根据文献[4-6]的方法,用磷酸缓冲盐溶液(phosphate buffer saline, PBS)配制体积分数为0.5%的依文斯蓝溶液,用0.20 μm滤膜过滤除菌.雄性ICR小鼠24只随机分为4组,每组6只,分别为模型组,给药高、中、低剂量组.造模前,为了测定蛋白渗出量,先将所有的实验小鼠尾静脉注射0.20 mL依文斯蓝溶液.依据分组,将所有实验小鼠右耳耳廓正反两面涂抹20.0 μL质量浓度分别为62.50、125.00和250.00 mg/mL的JH2,即实验小鼠分组Ⅰ为模型组,Ⅱ为JH2低剂量组(1.25 mg/耳),Ⅲ为JH2中剂量组(2.50 mg/耳),Ⅳ为JH2高剂量组(5.00 mg/耳).30 min后,将所有小鼠右耳耳廓正反面涂20.00 μL AA(ρ(AA)=100 mg/mL溶于丙酮)造模,1 h后,擦除实验小鼠耳朵残留物,检测小鼠的耳肿胀各项指标.
1.4 耳肿胀度的测量
AA刺激1 h后,小鼠颈椎脱臼处死,剪下双侧耳朵,用直径6 mm打孔器双侧同样位置打孔,立即用电子天平称量耳片质量,且用游标卡尺测量耳片厚度.小鼠耳肿胀程度用每只小鼠同位置同面积耳片的质量差(mR-mL)和厚度差(dR-dL)来评价.其中, mR和dR为发炎右耳片的质量及厚度; mL和dL为未发炎左耳片的质量及厚度.
1.5 蛋白渗出量的检测
AA刺激1 h后,小鼠颈椎脱臼处死,剪下双侧耳朵,用直径 6 mm打孔器双侧同样位置打孔,耳片放在对应的EP管中,加入1 mL酰胺,置于55 ℃水浴中充分震荡24 h后,在酶标仪610 nm波长处测量光密度值(optical density, OD),记作D(610). 耳组织染料渗出液的变化为D(610)R-D(610)L.
1.6 JH2对小鼠肿胀耳片中LTB4含量测定
将耳片放在EP管中,液氮研碎,加入500 μL乙醇震荡混匀后12 000 r/min离心取上清,用LTB4ELISA试剂盒检测LTB4的含量.
1.7 组织病理学分析
先将小鼠耳片完整剪下,用体积分数为10%的福尔马林溶液固定.耳片脱水后石蜡包埋,切片机接近耳根部位切片,进行H&E染色.50×光学显微镜下拍片,观察小鼠耳肿胀程度和炎症细胞浸润聚集情况.
1.8 JH2对5-LOX活性的影响
通过ELISA方法和脂氧化酶抑制剂筛选试剂盒,测定JH2对5-LOX的酶活性的抑制作用强弱[7].在96 孔板内,空白对照组加入50.00 μL反应缓冲液,100%纯酶活性组加入49.50 μL 5-LOX纯酶稀释液和 0.50 μL二甲基亚砜(dimethyl sulfoxide, DMSO),给药组加入49.50 μL 5-LOX纯酶稀释液和0.50 μL溶于DMSO的JH2的溶液,使JH2的终浓度依次为100.00、50.00、25.00、12.50、6.25和3.12 μmol/L;阳性药5-LOX齐留通JH2的终浓度为100.00、50.00、25.00、12.50、6.25和3.12 μmol/L;然后,每孔加入5 μL底物亚麻酸,25 ℃震荡孵育 5 min后,加入显色剂色原酮50.00 μL/孔,25 ℃震荡孵育 5 min后终止反应,在酶标仪上检测D(490)值,计算抑制率为
(1)
1.9 统计学分析
2 结果及分析
2.1 JH2对 AA致小鼠耳肿胀度的影响
以耳朵局部涂抹给药方式评价JH2 对小鼠耳肿胀的作用,结果表明,局部涂AA能引起耳朵发红、肿胀.与模型组相比, JH2可以明显减少小鼠耳质量差(表 1)及厚度差(表 2),并呈一定量效关系,说明JH2 对耳肿胀程度有明显抑制作用.


组别mL/mgmR/mg(mR-mL)/mg抑制率/%Ⅰ10.90±0.5022.80±2.1011.80±1.600.00Ⅱ11.40±1.0020.50±1.509.00±1.3023.72Ⅲ10.60±0.6016.60±3.201)5.90±0.801)49.58Ⅳ11.10±0.9014.70±2.402)3.60±0.802)69.49
1)表示与模型组比较P<0. 05;2)表示与模型组比较P<0. 01

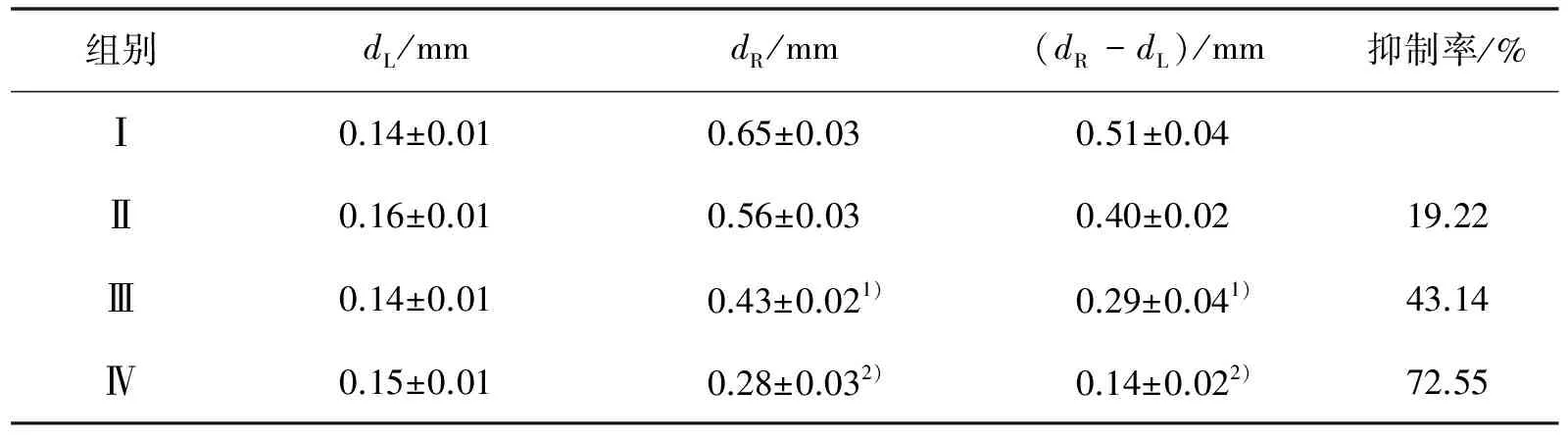
组别dL/mmdR/mm(dR-dL)/mm抑制率/%Ⅰ0.14±0.010.65±0.030.51±0.04Ⅱ0.16±0.010.56±0.030.40±0.0219.22Ⅲ0.14±0.010.43±0.021)0.29±0.041)43.14Ⅳ0.15±0.010.28±0.032)0.14±0.022)72.55
1)表示与模型组比较P<0.05;2)表示与模型组比较P<0.01
2.2 JH2对 AA致小鼠蛋白渗出量的影响
蛋白渗出量以伊文思蓝染料渗出量表示.实验结果表明,JH2能显著抑制小鼠肿胀耳朵的染料渗出,处理时1.25、2.50和5.00 mg/耳的抑制率分别为22.13%、41.50%和60.66%,见图1.
2.3 JH2对耳肿胀小鼠耳中LTB4生成量影响
实验结果表明,局部涂AA能引起LTB4生成量显著升高.JH2能显著抑制LTB4生成量,1.25、2.50和5.00 mg/耳处理后的抑制率分别为65.63%、81.25%和87.50%,见图2.
2.4 组织病理学检查结果
在50×光学显微镜下观察,耳组织病理切片结果如图3.由图3可见,模型组AA刺激的耳朵出现水肿现象,胶原纤维间隙增大,但炎性细胞浸润现象不明显.JH2处理组耳朵厚度较对照组明显有所减小,水肿程度降低.
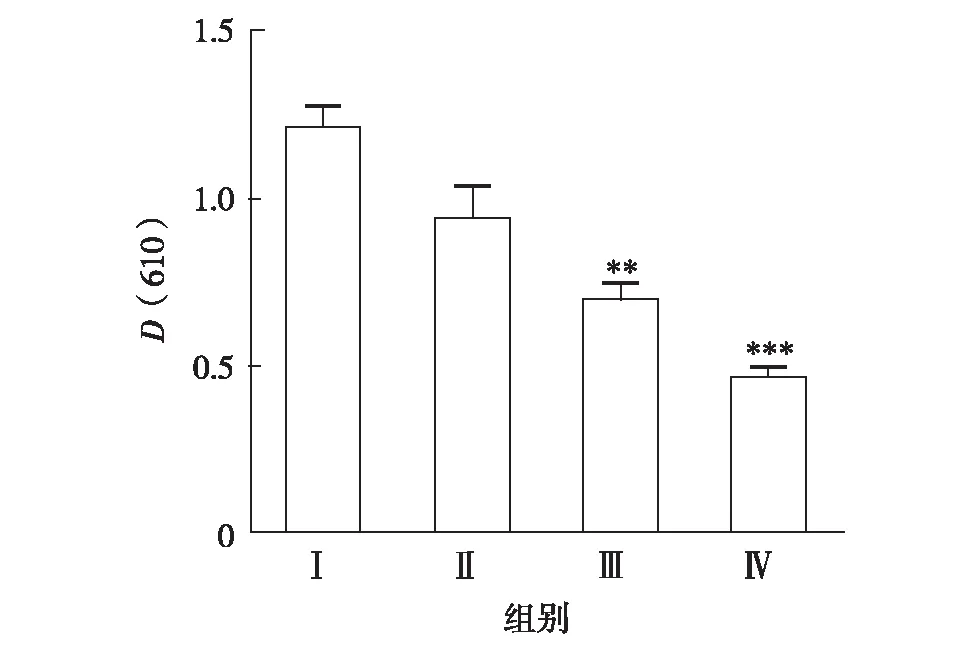
**表示与模型组比较P< 0. 01;***表示与模型组比较P<0. 001图1 JH2对 AA致小鼠蛋白渗出量的影响Fig.1 Effects of JH2 on exudation of proteins
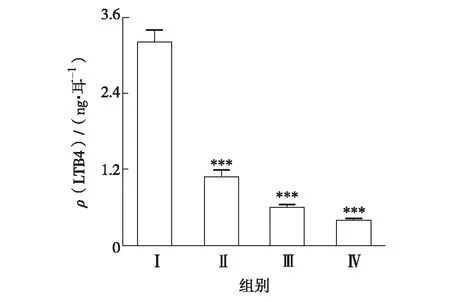
***表示与模型组比较P<0. 001图2 JH2对 LTB4生成量的影响Fig.2 Effects of JH2 on LTB4 generation
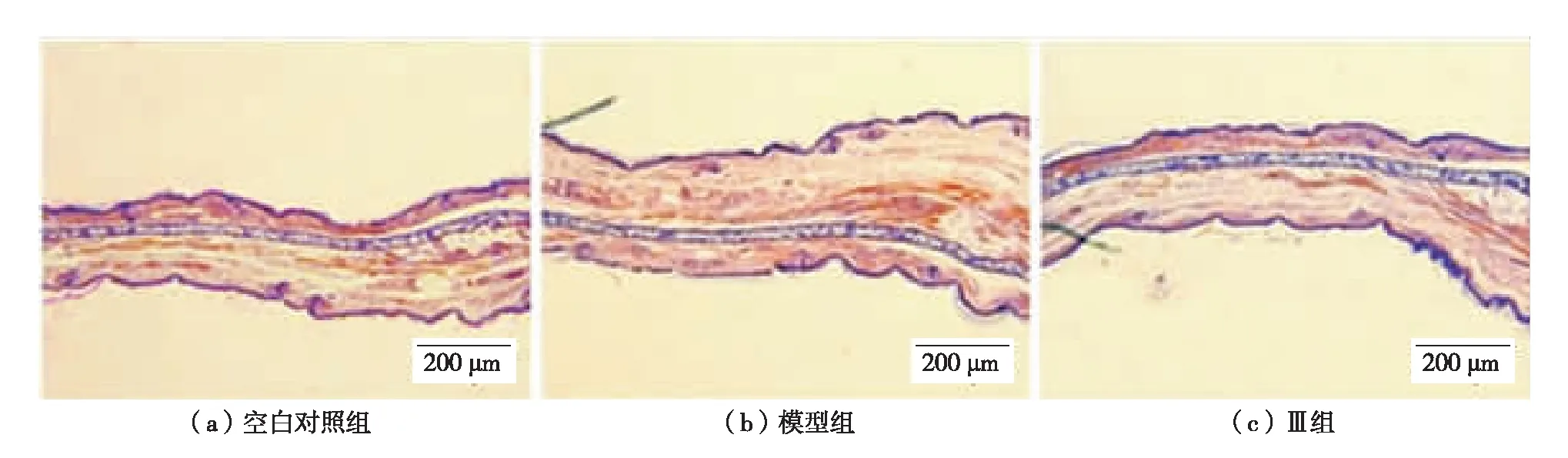
图3 组织病理学检查结果(H&E染色)Fig.3 (Color online) Representative H&E-stained sections of ear biopsies
2.5 JH2对花生AA代谢通路关键酶5-LOX的影响
为研究JH2对5-LOX的作用机制,本实验就JH2对AA通路中关键酶5-LOX以及COX-2的活性影响进行了检测.结果显示,JH2对5-LOX的酶活性有明显的抑制作用,且呈现剂量依赖性,其半数抑制浓度IC50值为12.16 μmol/L,与阳性药Zuleution活性接近(IC50=10.51 μmol/L),见图4.JH2对COX-2无明显抑制作用.

图4 JH2及Zileution对5-LOX酶活性的影响Fig.4 Effect of JH2 and Zileution on 5-LOX activity
3 讨 论
炎症是机体对外界刺激作出反应、对局部组织或器官的损伤进行修复的生理过程,是多种疾病中最常见而又最复杂的病理过程[9].很多炎症介质在机体内主要由AA代谢产生,其中,5-LOX是AA代谢通路中强效致炎因子LTB4合成途径的关键限速酶.AA在PLA2和5-LOX等酶的催化作用下转化为LTA4,LTA4后者被LTA4H水解为LTB4.LTB4是目前发现的最强效的炎症趋化介质之一,也是一种炎症性疼痛的介质.所以LTA4H可以作为很重要的抗炎靶点.化合物对LTA4H的影响可以通过对产物 LTB4的测定来判断药物对纯化酶的抑制作用强弱[10-12].因此研究开发5-LOX及其代谢产物LTB4的小分子抑制剂,对多种急慢性炎症的治疗具有重要意义.
本研究首先采用AA诱导的小鼠耳肿胀模型,对JH2的整体抗炎药效进行评价,发现JH2能够通过显著抑制AA所致的小鼠耳肿胀厚度、蛋白渗出量,并降低小鼠发炎耳组织中LTB4的产生量,从而改善AA诱导的耳肿胀炎症.研究初步探讨了其作用机制,进一步证明了JH2能够抑制AA代谢通路中的关键酶5-LOX的活性.因而说明JH2对AA诱导的小鼠耳肿胀急性炎症具有抑制作用,其机制可能是通过抑制AA代谢通路中的关键酶5-LOX的活性,从而减少炎症介质LTB4的生成而发挥抗炎作用.本研究证明了JH2是一种具有良好抗炎药效的天然小分子化合物,可作为开发5-LOX抑制剂抗炎药物的先导化合物,具有深入研究开发的价值.
/ References:
[1] 邹琼宇,陈德力,黄园园,等. 角蒿属植物化学成分及药理活性研究进展[J]. 中草药, 2016. 47(3): 499-511. Zou Qiongyu, Chen Deli, Huang Yuanyuan, et al. Research progress in study on chemical constituents in plants of Incarvillea Juss.and their pharmacological activities[J]. Chinese Traditional and Herbal Drugs, 2016, 47(3):499-511.(in Chinese)
[2] Su Yongqing, Shen Yunheng , Zhang Weidong. Neuroprotection of (+)-2-(1-hydroxyl-4-oxocyclohexyl) ethyl caffeate against hydrogen peroxide and lipopolysaccharide induced injury via modulating arachidonic acid network and p38-MAPK signaling[J]. Current Alzheimer Research, 2015, 12(9):892-902.
[3] Su Yongqing, Zhang Weidong, Zhang Chuan, et al. A new caffeic ester from Incarvillea mairei var. granditlora (Wehrhahn) Grierson[J].Chinese Chemical Letters, 2008, 19(7):829-831.
[4] Young J M, Spires D A, Bedord C J, et al. The mouse ear inflammatory response to topical arachidonic acid[J]. Journal of Investigative Dermatology, 1984, 82(4): 367-371.
[5] Inoue H, Mori T, Shibata S, et al. Inhibitory effect of glycyrrhetinic acid derivatives on arachidonic acid-induced mouse ear oedema[J]. Journal of Pharmacy and Pharmacology, 1988, 40(4): 272-277.
[6] Merlos M, Gómez L A, Giral M, et al. Effects of PAF-antagonists in mouse ear oedema induced by several inflammatory agents[J]. British Journal of Pharmacology, 1991, 104(4): 990-994.
[7] Zeng Huawu, Dou Shengshan, Zhao Jing, et al. The inhibitory activities of the components of Huang-Lian-Jie-Du-Tang (HLJDT) on eicosanoid generation via lipoxygenase pathway[J]. Journal of Ethnopharmacology, 2011, 135(2):561-568.
[8] Popoff T, Theander O. Two glycosides of a new dilignol from Pinus silvestris[J]. Phytochemistry, 1975, 14(9):2065-2066.
[9] Goldstein B I, Kemp D E, Soczynska J K, et al. Inflammation and the phenomenology, pathophysiology, comorbidity, and treatment of bipolar disorder: a systematic review of the literature[J]. The Journal of Clinical Psychiatry, 2009, 70(8): 1078-1090.
[10] Needleman P, Truk J, Jakschik B A, et al. Arachidonic acid metabolism[J]. Annual Review of Biochemistry, 1986, 16(55):69-102.
[11] Chen Xinseheng, Shelter J R, Johnson E N, et al. Role of leukotrienes revealed by targeted disruption of the 5-lipoxygenase gene[J]. Nature, 1994, 372(6502):179-182.
[12] Byrum R S, Goulet J L, Snouwaert J N, et al. Determination of the contribution of cysteinyl leukotrienes and leukotriene B4 in acute inflammatory responses using 5-lipoxygenase-and leukotriene A4 hydrolase-deficient mice[J]. The Journal of Immunology, 1999, 163(12):6810-6819.
【中文责编:晨 兮;英文责编:艾 琳】
Effect ofIncarvilleacaffeate on mouse ear edema
Li Li1, 2, Li Yuzhen2†, Ding Liping1†, and Huang Zhong1
1) School of Medicine, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 2) Department of Pharmacy, The Eighth Affiliated Hospital, Sun Yat-sen University, Shenzhen 518033, Guangdong Province, P.R.China
We investigated the effect of Incarvillea caffeate ((+)-2-(1-hydroxyl-4-oxocyclohexyl) ethyl caffeate, JH2) on arachidonic acid (AA) and its possible mechanism. We used AA-induced mouse acute ear edema model to determine the effect of JH2 on in vivo. We also studied the effect of JH2 on the enzyme activities of 5-lipoxygenase (5-LOX) by ELISA. The results showed that topical treatment with JH2 markedly inhibits the extent of oedema and protein permeability. Importantly, leukotrienes B4(LTB4) production in ear mouse is also drastically suppressed by JH2 and reaches a maximum inhibition rate of 87.50%. Activity assay in vitro showed that JH2 inhibits 5-LOX activity with half maximal inhibitory concentration (IC50) of 12.16 μmol/L. JH2 presents anti-inflammatory effect on AA-induced mouse acute ear edema model through controlling the excessive production of LTB4by inhibiting the activity of 5-LOX.
pharmacology; ear edema; Incarvillea caffeate; arachidonic acid (AA); 5-lipoxygenase (5-LOX); leukotrienes B4(LTB4)
Received:2016-07-07;Accepted:2016-07-12
Foundation:Postdoctoral Science Foundation of China (2015M572370)
† Corresponding author:Chief physician Li Yuzhen. E-mail: 695768596@qq.com; Postdoctoral Ding Liping. E-mail: 13552432187@163.com
:Li Li, Li Yuzhen, Ding Liping, et al. Effect of Incarvillea caffeate on mouse ear edema[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(1): 46-50.(in Chinese)
R 392
A
10.3724/SP.J.1249.2017.01046
中国博士后科学基金资助项目(2015M572370)
黎 丽 (1986—),女,深圳大学博士后研究人员. 研究方向:天然产物机制研究.E-mail: wlili19860318123@163.com
引 文:黎 丽,李玉珍,丁利平,等. 角蒿咖啡酸酯对小鼠耳肿胀的抑制作用[J]. 深圳大学学报理工版,2017,34(1):46-50.

