PVA-TACE治疗肝癌并肝动-静脉分流的疗效及生存预后
刘秋松梅雀林
·肿瘤介入·
PVA-TACE治疗肝癌并肝动-静脉分流的疗效及生存预后
刘秋松1梅雀林2
目的:探讨聚乙烯醇微粒肝动脉化疗栓塞(PVA-TACE)治疗肝细胞癌(HCC)并肝动-静脉分流(HAVS)的疗效预测及生存预后影响因素分析。方法:回顾性分析113例HCC并HAVS,依据分流速度不同采用不同规格PVA化疗栓塞。依据疗效分为肿瘤控制组(A组,63例)与肿瘤进展组(B组,50例),随访并分析生存期,采用Kaplan-Meier法计算累积生存率,疗效预测因素采用多因素logistic回归分析,生存预后因素采用Cox模型分析。结果:113例患者的中位生存期(OS)为11.0个月。A、B组中位OS分别为14.5个月、9.2个月,两组患者的生存期差异有统计学意义(χ2=15.215,P<0.001)。多因素logistic回归分析显示:肿瘤分布于单叶(OR=0.222,P=0.003)及无癌栓形成(OR=0.126,P=0.024)患者的疗效较好。多因素Cox回归分析显示:年龄≤50岁(HR=0.616,P=0.049)、多次栓塞治疗(HR=0.550,P=0.039)及肿瘤控制(HR=0.443,P=0.002)为预后的独立保护因素,而肿瘤负荷>50%(HR=3.156,P<0.001)及分流栓塞程度较低(HR=2.011,P=0.002)为预后的独立危险因素。结论:PVA-TACE治疗HCC并HAVS是安全、有效的。肿瘤单叶分布及无血管癌栓侵犯肿瘤控制较好。肿瘤负荷较大及分流栓塞程度较低患者预后较差,年轻、多次栓塞治疗及肿瘤控制的患者预后较好。
癌,肝细胞;动-静脉分流;生存预后;聚乙烯醇;肝动脉化疗栓塞术
中晚期肝癌常见肝动-静脉分流(hepatic arteriov enous shunts,HAVS),发生率约为28.8%~63.2%,以肝动脉-门静脉分流为主[1-2]。肝癌合并HAVS的危险因素不仅限于肿瘤本身,同时HAVS可能导致的消化道大出血、顽固性腹水、肿瘤肝内播散及肺转移等亦可严重影响生存预后[3]。聚乙烯醇(polyvinyl alcohol,PVA)微粒具有不可吸收性、低再通率及操控性较好等优点,可达到末梢性栓塞HAVS的目的[4-5]。本研究回顾性分析113例HCC合并HAVS患者的资料,探讨应用PVA肝动脉化疗栓塞(PVA-TACE)治疗HCC合并HAVS的临床疗效及生存预后的影响因素。
对象与方法
一、研究对象
收集2013年1月—2015年8月在广州南方医院应用PVA-TACE治疗的113例HCC合并HAVS患者,男100例,女13例,年龄25~77岁,中位年龄51岁;其中34例为快速型分流,42例为中速型分流,37例为慢速型分流。排除标准:终末期肝癌、门静脉主干被癌栓完全阻塞且侧支血管形成少、严重心肺功能障碍等。均获得患者及家属的知情同意。
二、PVA-TACE方法
常规行腹腔干和(或)肠系膜上动脉造影,评估肝脏血管解剖、肿瘤供血、分流速度及门静脉、肝静脉显影情况,然后进一步超选择插管至分流供血动脉及肿瘤供血动脉进行化疗栓塞。慢速型、中速型及快速型HAVS分别应用300~500 μm、500~710 μm及710~1000 μm PVA微粒栓塞[6]。慢速型及中速型HAVS可先用碘油化疗乳剂(碘油5~15 ml、吡柔比星10~20 mg、奥沙利铂50~100 mg、丝裂霉素10 mg及适量对比剂混合制成碘油化疗药物乳剂)栓塞,再用适量PVA栓塞。如注入少量乳剂沉积不良时可将PVA混入乳剂一同注入。快速型HAVS采用单纯化疗药物溶于对比剂后与PVA混合一同注入[5]。透视下观察到靶血管血流明显减少或者停滞为治疗终点。
三、随访及疗效评价指标
随访以电话随访为主,门诊随访为辅。本研究疗效评估指标:(1)生存期(overall survival,OS);(2)疾病进展生存期(time to progression,TTP);(3)肿瘤反应;(4)分流栓塞程度;(5)术后主要并发症。OS计算方法为患者首次接受分流栓塞治疗至末次随访或死亡,研究终止时间为2015年12月。本研究肿瘤反应采用改良的实体瘤疗效评价标准(mRECIST)[7],包括完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD), CR+PR+SD为疾病控制。分流栓塞程度是依据栓塞后即刻造影复查,将栓塞程度分为3级:完全栓塞、次全栓塞及不完全栓塞[5]。
四、统计学方法
采用SPSS 22.0软件统计分析。对患者计数资料组间比较采用χ2检验。累积生存率采用Kaplan-Meier法、Log-rank检验计算。先行单因素logistic回归分析,单因素分析中P<0.1为列入标准,自变量筛选采用基于偏最大似然估计的后退法(Backward:LR)进行多因素logistic回归分析。采用Cox比例风险模型进行预后影响因素的多因素回归分析,单因素分析中P<0.1为列入标准,自变量筛选采用基于偏最大似然估计的前进法(Forward:LR)进行多因素分析。以P<0.05为差异有统计学意义。
结 果
一、两组一般资料比较
113例肝癌合并肝动-静脉分流患者依据肿瘤控制情况分为肿瘤控制组(A组,63例)与肿瘤进展组(B组,50例),A组的肿瘤分布在单叶的比例高于B组,差异有统计学意义,两组其他指标差异无统计学意义,见表1。
二、疗效
1.生存期:113例患者共行274例次栓塞治疗,1~11次/例,中位栓塞次数2次;113例患者的中位OS为11.0个月,6、12、18个月的生存率分别为77.5%、43.2%、17.7%。A、B组的中位OS分别为14.5个月、9.2个月,6、12、18个月生存率分别为87.9%、56.2%、30.8%,64.9%、29.9%、2.7%(图1);两组患者的生存期差异有统计学意义(χ2=15.215,P<0.001)。
2.疾病进展生存期:65例可评价患者的中位TTP为2.3个月,3、6、9、12个月疾病进展生存率分别为38.5%、4.6%、1.5%、0%;A组(15例)、B组(50例)的中位TTP分别为3.8个月、1.9个月,A、B组的3、6个月疾病进展生存率为分别为60.0%、13.3%,30.0%、4.0%;两组患者的TTP差异有统计学意义(χ2=4.725,P=0.030)。

表1 肿瘤控制组和肿瘤进展组患者的基线情况

图1 肿瘤控制组和肿瘤进展组的累积生存曲线图
3.肿瘤反应:CR为3例(图2)、PR为22例(图3)、SD为38例、PD为50例,疾病控制率(disease control rate,DCR)为55.8%(63/113)。
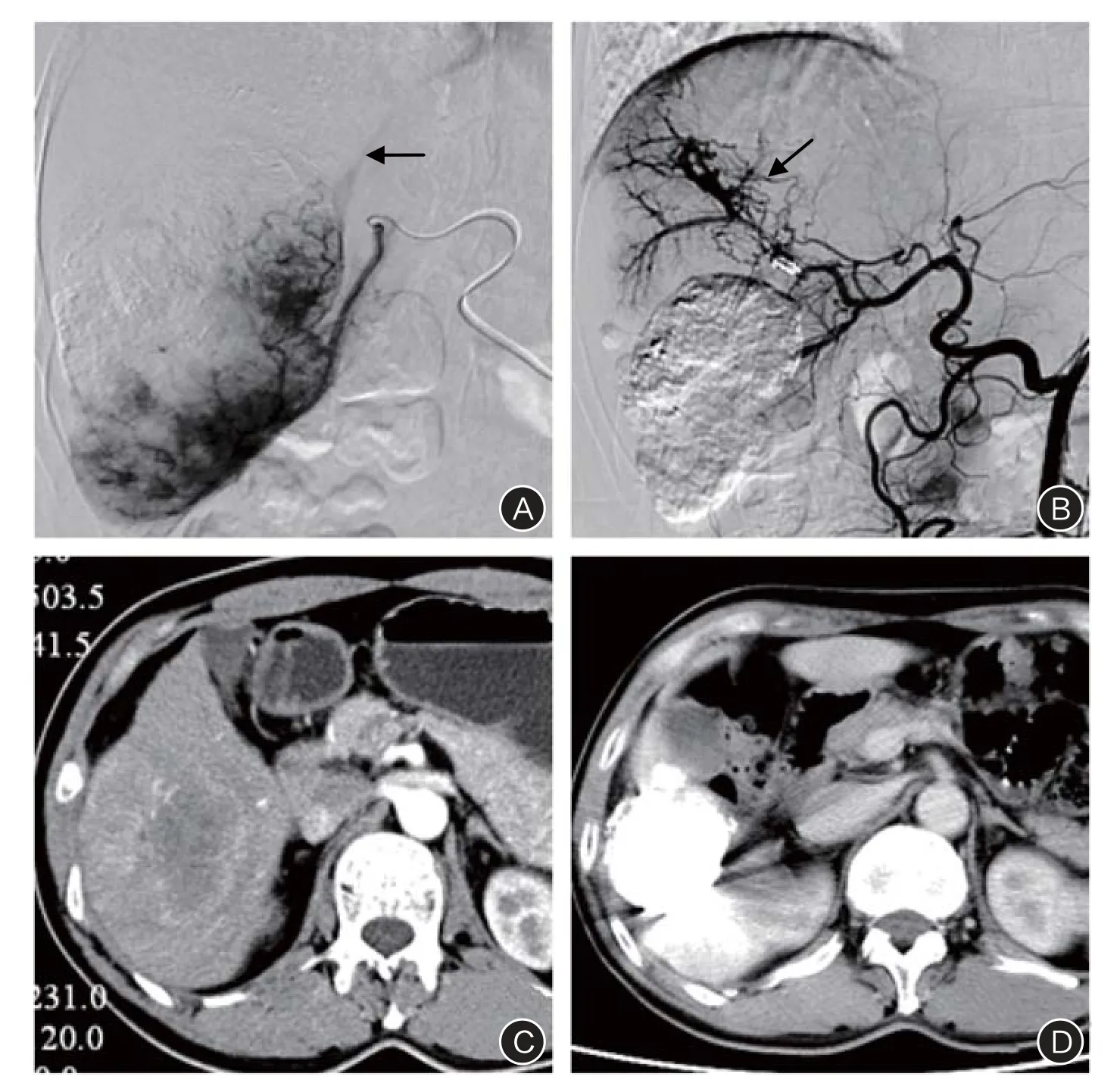
图2 患者男,52岁,原发性肝癌(块状型),中速型肝动脉-门静脉分流及肝动脉-肝静脉分流
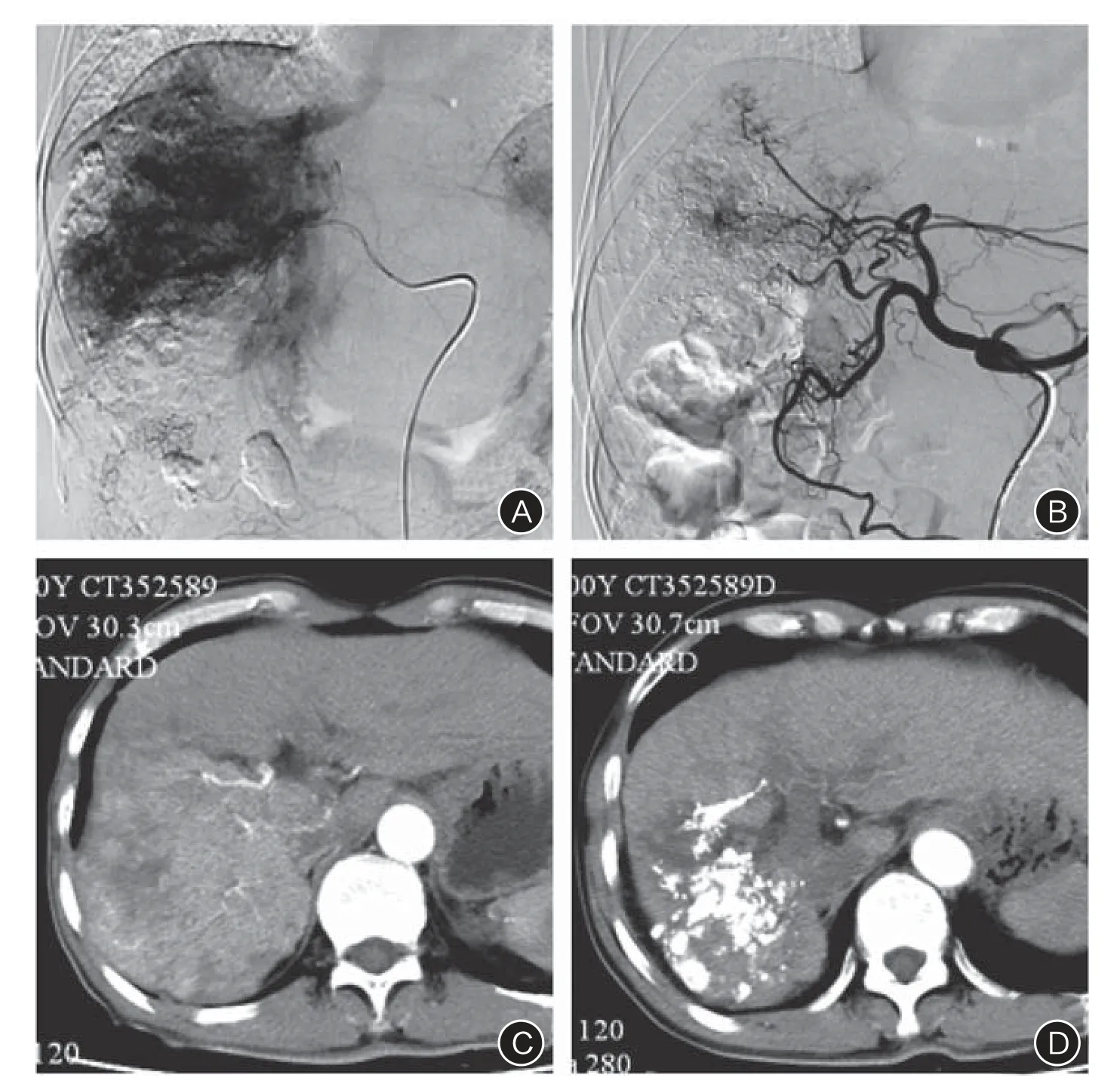
图3 患者男,69岁,原发性肝癌(巨块型)合并门静脉右支、肝右静脉癌栓形成,中速型肝动脉-肝静脉分流
4.分流栓塞程度:A组中51例为完全栓塞,9例为次全栓塞,3例为不完全栓塞;B组中43例为完全栓塞,4例为次全栓塞,3例为不完全栓塞。两组分流栓塞程度差异无统计学意义(χ2=0.061,P=0.805)。
三、疗效的多因素分析结果 以术前BCLC分期、AFP水平、肿瘤边界、肿瘤分布、癌栓形成为自变量,以肿瘤反应为因变量(A组=0,B组=1),进行logistic回归分析显示:肿瘤分布于单叶(OR=0.222,P=0.003)及无癌栓形成(OR=0.126,P=0.024)的患者疗效较好,见表2。
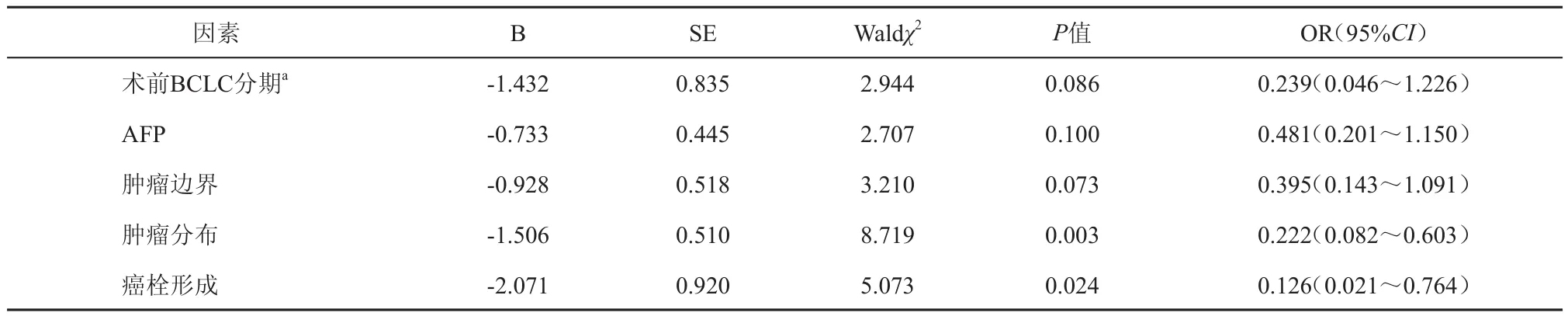
表2 PVA-TACE治疗HCC合并HAVS的疗效的影响因素分析
四、生存预后的单、多因素分析结果 单因素分析结果显示:不同肿瘤负荷、栓塞次数、奥沙利铂总量及肿瘤控制情况患者的生存期有显著性差异(均P<0.05)。多因素分析结果显示:年龄≤50岁(HR=0.616,P=0.049)、多次栓塞治疗(HR=0.550,P=0.039)及肿瘤控制(HR=0.443,P=0.002)为预后的独立保护因素,而肿瘤负荷>50%(HR=3.156,P<0.001)及分流栓塞程度较低(HR=2.011,P=0.002)为预后的独立危险因素,见表3。

表3 影响HCC合并HAVS患者生存期的单、多因素分析
五、术后主要并发症 所有患者栓塞术后均出现不同程度的栓塞后综合征,经对症支持处理后症状缓解。1例术后出现食管胃底曲张静脉破裂出血(0.9%),无急性肝功能衰竭及术后30 d内死亡病例。
讨 论
中晚期HCC常合并HAVS,肿瘤侵犯、脉管癌栓是HAVS形成的基础[1,8-9],癌栓与HAVS是HCC预后的不良因素[4,10-13]。HAVS不仅导致顽固性腹水、食管胃底静脉曲张破裂出血、继发性布加综合征、难治性心衰等严重并发症,亦是肿瘤肝内播散、肺部转移的重要因素,从而严重影响患者的生活质量及生存期,预后不良[1,3,13-16]。HAVS得到有效栓塞,一方面可缓解门静脉高压、减少食管胃底静脉曲张破裂出血风险,另一方面可改善盗血性肝功能损害,从而改善患者生存状况[17]。Kim等[4]报道应用PVA联合碘油栓塞治疗治疗HCC合并HAVS,中位生存期为162 d。Shi等[18]报道应用氰基丙烯酸异丁酯(NBCA)栓塞伴有重度肝动脉-门静脉分流的肝癌12例,中位OS为275 d,6个月、1年、2年的生存率分别为67%、33%、8%。Zhou等[19]报道应用无水乙醇浸泡明胶海绵颗粒栓塞61例肝癌并肝动脉-门静脉分流,中位OS为382 d,6个月、1年、2年的生存率分别为79%、50%、12%。本研究113例患者的中位OS为11.0个月,6、12、18个月的生存率分别为77.5%、43.2%、17.7%。除A组1例术后出现食管胃底曲张静脉破裂出血,其余病例术后均无严重并发症,提示该治疗方法相对安全、耐受性良好。
血管癌栓侵犯易诱发形成HAVS,导致碘油化疗药乳剂通过分流道异位栓塞正常组织,无法沉积肿瘤病灶内,严重影响化疗栓塞疗效[16,20]。本研究logistic回归分析显示肿瘤单叶分布及无血管癌栓形成的患者经PVA-TACE治疗后效果较好。既往文献多因素分析亦显示肿瘤直径、肿瘤个数、肿瘤血供情况及门静脉癌栓均为肿瘤是否缓解的预测因素[20]。本研究Cox多因素生存预后分析显示:年龄≤50岁、多次栓塞治疗及肿瘤控制的患者预后较好,而肿瘤负荷>50%及分流栓塞程度较低患者预后较差。既往文献多因素生存预后分析显示患者年龄>65岁、肿瘤直径>4 cm、肿瘤双叶分布、门静脉癌栓形成、肝动-门脉分流为预后不良的影响因素[12,16,19]。
综上所述,PVA-TACE治疗HCC合并HAVS是安全、有效的。肿瘤单叶分布及无血管癌栓侵犯预测肿瘤控制较好。肿瘤负荷较大、分流栓塞程度较低患者预后较差,年轻患者、多次栓塞治疗及肿瘤控制的患者预后较好。
1 Ngan H, Peh WC. Arteriovenous shunting in hepatocellular carcinoma: its prevalence and clinical signif cance [J]. Clin Radiol, 1997, 52(1): 36-40.
2 Oh D, Shin SW, Park HC, et al. Changes in arterioportal shunts in hepatocellular carcinoma patients with portal vein thrombosis who were treated with chemoembolization followed by radiotherapy [J]. Cancer Res Treat, 2015 ,47(2):251-258. doi: 10.4143/crt.2014.011.
3 孙磊, 施海彬, 刘圣, 等. 肝细胞癌肝动脉门静脉分流形成的相关因素分析 [J]. 介入放射学杂志, 2012, 21(3): 206-210. doi:10.3969/ j.issn.1008-794X.2012.03.008.
4 Kim YJ, Lee HG, Park JM, et al. Polyvinyl alcohol embolization adjuvant to oily chemoembolization in advanced hepatocellular carcinoma with arterioportal shunts [J]. Korean J Radiol, 2007, 8(4): 311-319.
5 刘秋松, 梅雀林, 李彦豪, 等. 聚乙烯醇微粒末梢性化疗栓塞肝细胞癌合并肝动静脉分流的疗效与安全性 [J]. 中华放射学杂志, 2015, 49(10): 763-768. doi:10.3760/cma.j.issn.1005-1201.2015.10.010.
6 Mei Q, Li Y. Transcatheter arterial embolization of hepatic arteriovenous shunts in patients with hepatocellular carcinoma [J]. Semin Intervent Radiol, 2012 ,29(3):237-240. doi: 10.1055/s-0032-1326935.
7 Lencioni R, Llovet JM. Modif ed RECIST (mRECIST) assessment for hepatocellular carcinoma [J]. Semin Liver Dis, 2010,30(1):52-60. doi: 10.1055/s-0030-1247132.
8 欧阳墉, 欧阳雪晖. 肝内肝动脉-门静脉分流的研究进展[J]. 医学影像学杂志, 2005, 15(12): 1019-1023. doi:10.3969/ j.issn.1006-9011.2005.12.001.
9 张凯, 王茂强, 李彩霞, 等. α-氰丙烯酸正丁酯治疗肝癌高流量动脉-门静分流的临床研究 [J]. 中国医学影像学杂志, 2010, 18(6): 543-546.
10 Takizawa D, Kakizaki S, Sohara N, et al. Hepatocellular carcinoma with portal vein tumor thrombosis: clinical characteristics, prognosis, and patient survival analysis [J]. Dig Dis Sci, 2007, 52(11): 3290-3295.
11 Luo J, Guo RP, Lai EC, et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma with portal vein tumorthrombosis: a prospective comparative study [J]. Ann Surg Oncol, 2011,8(2):413-420. doi: 10.1245/s10434-010-1321-8.
12 Jia L, Kiryu S, Watadani T, et al. Prognosis of hepatocellular carcinoma with portal vein tumor thrombus:assessment based on clinical and computer tomography characteristics [J]. Acta Med Okayama, 2012, 66(2): 131-141.
13 周卫忠, 刘圣, 杨正强, 等. 氰基丙烯酸酯胶栓塞原发性肝细胞癌合并重度肝动脉门静脉瘘12例疗效分析 [J]. 介入放射学杂志, 2013, 22(8): 641-645. doi:10.3969/j.issn.1008-794X.2013.08.007.
14 Murata S, Tajima H, Nakazawa K, et al. Initial experience of transcatheter arterial chemoembolization during portal vein occlusion for unresectable hepatocellular carcinoma with marked arterioportal shunts [J]. Eur Radiol, 2009, 19(8): 2016-2023. doi: 10.1007/s00330-009-1349-y.
15 Chung SM, Yoon CJ, Lee SS, et al. Treatment outcomes of transcatheter arterial chemoembolization for hepatocellular carcinoma that invades hepatic vein or inferior vena cava [J]. Cardiovasc Intervent Radiol, 2014,37(6):1507-1515. doi: 10.1007/s00270-014-0841-1.
16 刘秋松,张恭良,梅雀林,等.PVA-TACE治疗肝细胞癌并肝肺分流的临床疗效预后分析[J].中华介入放射学电子杂志,2016,4(2):71-76. doi:10.3877/cma. j. issn.2095-5782.2016.02.004.
17 Vogl TJ, Nour-Eldin NE, Emad-Eldin S, et al. Portal vein thrombosis and arterioportal shunts: effects on tumor response after chemoembolization of hepatocellular carcinoma [J]. World J Gastroenterol, 2011,17(10):1267-1275. doi: 10.3748/wjg.v17. i10.1267.
18 Shi HB, Yang ZQ, Liu S, et al. Transarterial embolization with cyanoacrylate for severe arterioportal shunt complicated by hepatocellular carcinoma [J]. Cardiovasc Intervent Radiol, 2013,36(2):412-421. doi: 10.1007/s00270-012-0410-4.
19 Zhou WZ, Shi HB, Liu S, et al. Arterioportal shunts in patients with hepatocellular carcinoma treated using ethanol-soaked gelatin sponge: therapeutic effects and prognostic factors [J]. J Vasc Interv Radiol, 2015,26(2):223-230. doi: 10.1016/j.jvir.2014.11.002.
20 Hu HT, Kim JH, Lee LS, et al. Chemoembolization for hepatocellular carcinoma: ultivariate analysis of predicting factors for tumor response and survival in a 362-patient cohort [J]. J Vasc Interv Radiol, 2011,22(7):917-923. doi: 10.1016/j.jvir.2011.03.005.
Evaluation of polyvinyl alcohol transcatheter arterial chemoembolization in treating hepatocellular carcinoma with hepatic arteriovenous shunts and its prognosis
Liu Qiusong1, Mei Quelin2.
1Department of Interventional Radiology, Aff liated Zhongshan Hospital, Xiamen University, Xiamen 361004, China;2Department of Interventional Radiology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
Mei Quelin, Email: meique_lin@163.com
Objective:To evaluate the efficacy of polyvinyl alcohol transcatheter arterial chemoembolization (PVA-TACE) in the treatment of hepatocellular carcinoma (HCC) with hepatic arteriovenous shunts (HAVS) and its prognosis among these patients.Methods:113 patients with HCC and HAVS were collected who were divided into two groups according to their responding to the therapeutics-group A (tumor control,n=63) and group B (tumor progress,n=50). Based on HAVS types, different sizes of PVA were used to embolize the shunts accordingly. The overall survival (OS) was analyzed in the follow-up study. Factors associated with eff cacy were evaluated using multivariate logistic regression analysis. The survival prognostic factors were assessed by multivariate Cox analysis.Results:The median OS of 113 patients was 11.0 months. The median OS of the group A and group B patients were 14.5 months and 9.2 months, respectively. The survival curves of the two groups were estimated by the Kaplan-Meier method and compared by a Log-rank test, which revealed a signif cant difference between two groups (χ2=15.215,P<0.001). On multivariate logistic analysis, tumor location (OR=0.222,P=0.003) and tumor thrombosis (OR=0.126,P=0.024) were significant factors for efficacy. Independent prognostic factors for a longer survival included: patient age ≤50 years (HR=0.616,P=0.049), multiple embolization (HR=0.550,P=0.039) and tumor control (HR=0.443,P=0.002). While tumor burden >50% (HR=3.156,P<0.001) and lower level of shunts occlusion were considered independent risk factors. Conclusions: PVA-TACE is a safe and effective strategy for HCC with HAVS , especially for single-lobe tumor and without tumor thrombosis. Younger age, multiple embolization and tumor controlshow a better survival prognosis. Patients with tumor burden>50% and lower level of shunts occlusion show a poor survival prognosis.
carcinoma, hepatocellular; arteriovenous shunts; prognosis; polyvinyl alcohol
2016-04-20)
(本文编辑:黄强)
10.3877/cma.j.issn.2095-5782.2016.03.003
361004 福建厦门,厦门大学附属中山医院肿瘤与血管介入科1;510515 广东广州,南方医科大学南方医院介入科2
梅雀林, Email:meique_lin@163.com
刘秋松,梅雀林. PVA-TACE治疗肝癌并肝动-静脉分流的疗效及生存预后[J/CD].中华介入放射学电子杂志,2016,4(3):136-141.

