非小细胞肺癌脑预防照射研究进展
张矛 陈忠民 崔洪霞 孙涛
·综述·
非小细胞肺癌脑预防照射研究进展
张矛1陈忠民2崔洪霞3孙涛1
肺肿瘤; 非小细胞肺癌; 脑预防照射
随着多学科综合诊治技术的不断提高,非小细胞肺癌(non-small cell lung cancer, NSCLC)患者生存期得以延长,随之带来的是脑转移发生率的增加,脑转移是影响患者预后和生活质量的重要因素。因此,预测及预防NSCLC脑转移的发生已经成为临床关注的热点,而有选择地实施预防性脑照射(prophylactic cranial irradiation, PCI)也是目前NSCLC的研究方向之一,现就NSCLC脑转移的高危因素、NSCLC PCI的研究现状、未来的研究热点以及毒性反应等做一综述。
一、NSCLC脑转移的高危因素
NSCLC脑转移后中位生存期约7个月左右,1年生存率仅为20%[1],成为治疗失败主要的模式之一。研究表明,NSCLC脑转移的发生与病理类型、临床分期、淋巴结转移、生存期长短、性别、年龄、综合治疗获益情况等多种因素相关。
1. 病理类型:临床研究表明肺腺癌及大细胞癌患者更易发生脑转移, 但是大细胞癌发病率仅占肺癌的5.0%以下,所以肺腺癌患者成为主要的群体,其脑转移发生率为43%,而鳞癌只有13%[2]。Alsan等[3]对局部晚期NSCLC的研究发现腺癌脑转移危险明显高于鳞癌患者(39.6%vs. 15.7%,P<0.0001)。可能的原因是肺腺癌以浸润性生长为主, 容易发生血行转移,两者在肿瘤生物和临床反应性的差异可能与肿瘤生发的不同细胞谱系有关[4]。
2. 临床分期、性别及年龄:Hubbs 等[5]进行了一项早期肺癌脑转移风险因素的大样本研究,他们回顾性分析了1995~2005年975例Ⅰ、Ⅱ期 NSCLC术后的患者,结果显示5年累积脑转移发生率为10%。另外一项纳入455例NSCLC患者的回顾性研究发现,根治性放疗后6个月内出现脑转移的患者中,Ⅰ、Ⅱ、Ⅲ期 NSCLC患者分别为1.0%、2.8%、和5.7%[6]。Hsiao等[7]观察了596例NSCLC(ⅢB/Ⅳ期482例)脑转移发生情况,总的脑转移率为14%~59%,其中36%患者在疾病某一阶段出现脑转移,亚组分析显示女性、小于60岁患者脑转移发生率明显高于高龄患者。而针对ⅢA和ⅢB患者脑转移多变量因素的分析表明,小于60岁的患者脑转移发生率为32.9%,60岁以上患者则为15.3%(P=0.003);小于60岁腺癌患者的脑转移风险明显高于其他患者[3](53.3%vs. 18%,P<0.0001)。这些数据提示女性、年龄小于60岁以及肿瘤分期晚的患者,更容易发生脑转移。
3. 纵膈淋巴结转移:纵膈淋巴结转移以及转移的数目、区域是脑转移发生的另外一个相关因素。伴有纵膈淋巴结转移的NSCLC(ⅢA-N2)患者, 5年累积脑转移率为57.3%[8]。叶雄等[9]对Ⅲ期NSCLC术后患者所做的系统性分析详细阐明了淋巴结转移以及病理类型与脑转移发生的关系。研究显示纵膈单区域淋巴结转移1、2、3年脑转移的发生率分别为6.8%、12.8%和16.6%。多个区域淋巴转移则高达31.1%、55.5%和61.1%(P=0.000),而且淋巴结转移数目的多少与脑转移发生率呈正相关。作者认为:纵隔多区域、多个淋巴结转移为局部晚期NSCLC术后脑转移高危因素。
4. 综合治疗的因素: Ceresoli等[10]在评估局部晚期NSCLC接受多学科治疗后发生脑转移的风险中报道,在其纳入的112例患者治疗后脑转移作为首发失败模式的占22%,29%的患者2年内出现脑转移。而局部晚期NSCLC接受术前新辅助治疗获益明显的患者脑转移机率也会增加,达到pCR的患者脑转移数量被发现为最初的失败模式的为43%,55%的患者在其治疗过程中出现了脑转移[11]。TKI治疗与脑转移瘤发生关系的研究提示,TKI治疗临床获益的患者脑转移率明显高于无效患者[12](26%vs. 4%,P<001)。近年来多项关于肺上沟癌的临床研究中均发现治疗失败的因素以脑转移为主。回顾性分析显示,接受了同步放化疗(顺铂/依托泊苷和胸部放疗46Gy)后手术切除的肺上沟癌患者,所有的远处转移中脑转移为65.2%[13-16]。上述多项研究显示,综合治疗获益明显的NSCLC患者其生存期延长脑转移的发生也随之增加。
二、NSCLC PCI的研究
鉴于PCI在局限期SCLC应用的成功经验,国内外的许多学者尝试将其用于NSCLC,主要针对的是局部晚期NSCLC患者。早期多个相关研究显示PCI降低了NSCLC脑转移发生率,但是不能延长总生存率,见表1。
上述临床试验由于NSCLC存在异质性、选择病例的临床情况、治疗方法以及疗效评价等方面不尽相同,其预后差异是明显的。基于以上分析,2011年RTOG(0214)发表在JCO上旨在评估局部晚期NSCLC PCI是否提高总生存率的Ⅲ期临床研究已引起极大的关注和期待。这主要是源于其在新的治疗手段和理念以及临床实践经验积累的基础上重新评估了PCI在NSCLC中的价值。该试验入组标准为ⅢA或ⅢB期NSCLC根治性治疗(手术或放疗±化疗)后CR、PR及SD的患者,其中163例给予PCI 30 Gy /15 F,177例列为观察组。研究结果表明PCI显著降低1年脑转移发生的风险(18%vs. 7.7%,P=0.004),但未能改善1年 DFS (56.4%vs. 51.2%,P=0.11) 和OS(75.6%vs. 76.9%,P=0.86)。随后国外有多个较大宗病例的回顾性研究进一步探索了NSCLC PCI的意义。2014年报道的一项纳入6个随机对照试验评估NSCLC PCI价值的Meta分析和另外一项455例NSCLC患者根治性放疗后PCI作用的回顾性研究,结果均显示接受PCI的患者仅降低了脑转移的发生,同样未见PCI与观察组之间的总生存率方面存在差异[6,22]。PCI在具有高危脑转移风险的亚群是否有OS获益尚不明确,一项局部晚期NSCLC患者PCI的回顾性研究评价了PCI对具有脑转移高危因素患者(年龄小于60岁、腺癌、ⅢB期等)生存的影响[23]。他们收集了SEER数据库中17 852例NSCLC患者,其中326例接受PCI。结果表明,PCI未能改善OS,甚至会增加部分患者脑转移的风险。同样汇集12个临床试验涉及1 718例NSCLC PCI患者的一项荟萃分析也发现,与未行PCI相比PCI虽然降低了脑转移风险,但是总生存风险比(HR)更青睐未行PCI的患者(HR=1.19,95%[CI]:1.06~1.33,P=0.004)[24]。
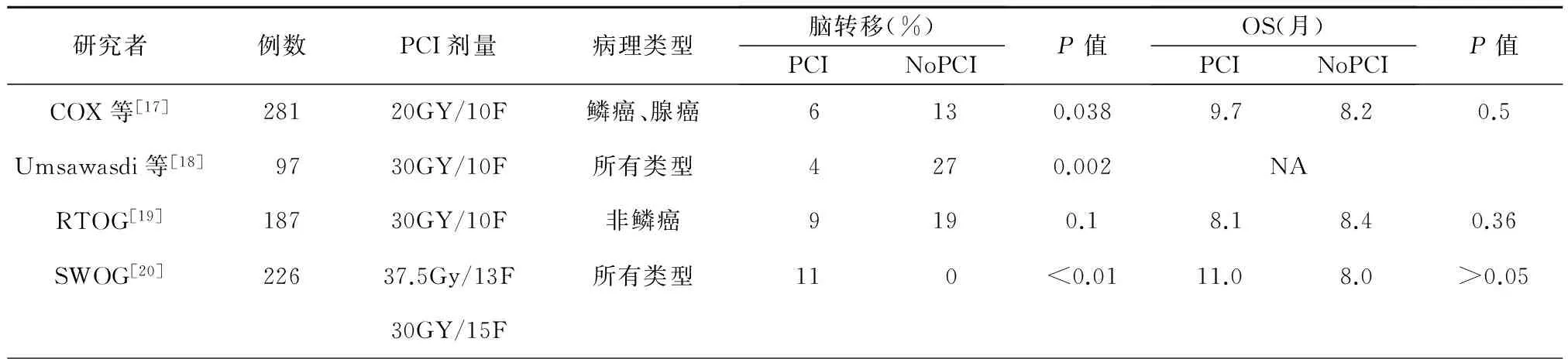
表1 PCI早期随机研究报道
上述随机对照试验、Meta分析以及系统性回顾研究的结果,进一步证实PCI降低了脑转移风险,但未能改善OS。人们推测,这是否依然是遴选人群的差异所造成的,或许可能我们还没有寻找到其中具备某些特点的患者,也许正是这部分人群恰恰蕴含了独特的事件。王思愚等将脑转移的相关因素形成多元回归,构建出脑转移的高危数学模型, 作为预测和筛选局部晚期NSCLC术后脑转移高危患者的依据,并成功应用于其开展的一项前瞻性Ⅲ期随机对照临床研究中[25]。该研究重点分析了完整切除的ⅢA N2期患者,至少接受2个周期的含铂辅助化疗后PCI是否延长DFS。作者观察到PCI组和对照组3、5年脑转移发生率分别为13.7%、20.3%和 44.2%、49.9%(P<0.001),DFS为28.5月vs. 21.2月(P=0.037),PCI组显著延长DFS,OS延长但没有统计学差异。由此得出PCI可以延长病变完整切除及辅助化疗后,具有高危脑转移风险的ⅢA N2期NSCLC患者DFS的结论。该研究结论的得出,究其原因是高度选择了入组患者,经过严格筛选的亚组患者为全部接受外科完整切除术的病例,局部控制好;术后接受辅助化疗,预防了颅外其他部位转移;通过建立数学模型预测脑转移的危险因素筛选高危人群等。不足的是该研究提前结束病人入组,如果进一步扩大样本量,证据水平会更高。但是仍为NSCLC PCI研究带来了新的启示,预示对部分高选择的患者进行PCI具有潜在的生存获益,未来应给与更多的关注,当然还需要更多的前瞻性研究来支持这个观点。
由于肺上沟癌有较高的脑转移发生率,一些学者尝试将PCI应用于其整体治疗中, MD Anderson中心开展了肺上沟癌手术后化放疗的前瞻性Ⅱ期临床研究[26]。该项研究从1994年到2010年纳入的32例肺上沟癌患者,术后给予同步放化疗,其中的11例患者接受PCI,其结果显示,未行PCI的患者脑转移发生率为23.8%,PCI患者无脑转移发生。虽然这一临床试验样本量较小,却提示对肺上沟癌这部分特殊的群体应考虑将其加入到PCI中进行研究。
总之,局部晚期NSCLC PCI能够降低约50%脑转移的发生率,但是多数研究结论未能证实提高OS,而且出于对PCI所致远期神经毒性的担心,NSCLC患者是否需要接受PCI尚存争议。PCI在部分脑转移高风险的特殊群体显示出良好的疗效,提示我们值得继续开展大型的Ⅲ期研究探索PCI在高选择人群中潜在的生存价值。目前正在开展的多项临床试验如NCT01290809、NCT01282437、NCT00955695等,有望进一步阐明PCI在NSCLC中的疗效及价值,其结果值得期待[27-29]。
三、NSCLC PCI未来的研究热点
分子生物学的发展为选择PCI合适的人群提供了新的工具。随着介导肺癌脑转移相关新分子及新通路的发现以及人们对预测和识别分子的探索,筛选预测脑转移分子标记物,建立脑转移的预测模型是寻找脑转移高危人群新的研究热点。一项研究利用外周血检测基因16个位点的SNP状态,旨在探索PI3K-PTEN-AKT-mTOR信号传导途径的SNP状态与脑转移发生风险相关性,发现AKT1的GT或GG基因型:rs2498804,AKT1的CT和TT基因型:rs2494732 ,PIK3CA的Ag/AA基因型:rs2699887有较高的脑转移风险,提示mTOR信号传导途径SNP与脑转移的发生相关[30]。而原发病灶的EGFR突变情况分析显示,脑转移的患者EGFR突变率为64.3%[31],或许突变型肺癌有更高的脑转移机率。目前与脑转移发生相关的预测和潜在机制包括:mirna-328和mirna-378表达、癌基因elmo3去甲基化和基因表达、腺苷酸环化酶相关蛋白1的过度表达、CMET扩增和过表达、表皮生长因子受体基因突变、趋化因子受体CXCR4的表达等[32-37]。利用某些基因突变和临床风险因子建立NSCLC脑转移的预测模型,并在临床实践中验证和据此分层进行预防脑转移的研究,可为揭示NSCLC脑转移发生的分子机制提供更多的线索,并为找到PCI的合适人群提供理论依据。
四、PCI的毒性反应
对于PCI的毒性反应,大家更关注的是对引起记忆力、注意力下降,智力障碍甚至痴呆等神经认知功能(neurocognitive function, NCF)的远期损伤。相关研究多数来源于在SCLC的使用报道。稍早前Slotman等[38]通过健康相关生命质量(health related quality of life, HRQOL)对广泛期SCLC患者长期生存的生活质量随访发现,是否给与PCI两组最大的差别是乏力和脱发,其他如躯体功能、情绪功能等影响无明显差异。与以往多数回顾性研究不同的是近些年开展的多数前瞻性研究均记录了治疗前的基线NCF状态,因为肿瘤代谢产物、化疗药物的毒副作用以及由其引起的肿瘤细胞破坏机体自身免疫反应等,均可以损害患者的NCF。一项采用非参数Wilcoxon test法比较了SCLC PCI(25Gy/10F)治疗前后患者的HRQOL评分研究认为,头痛、脱发、嗜睡以及情绪功能在治疗后6周、6个月均明显加重,但6个月后好转,该研究提示PCI并没有带来明显严重的神经毒性[39]。Le Pechoux等[40]开展的Ⅲ期随机临床试验,旨在比较局限期SCLC患者两种不同PCI照射剂量(25Gy和36Gy)涉及神经毒性和生活质量(quality of life, QOL)的影响。该研究共选择17个评估项目,观察中期及长期NCF和QOL。在3年的研究中发现,两组间的各项指标差异均无统计学意义。但是随着时间延长,两组患者的语言交流能力,下肢无力和记忆等都有轻度的下降,高剂量组(36Gy)下降更明显(所有P<0.005),并且发现年龄大于60岁是发生慢性中枢神经系统毒性的危险因素。
2013年Gondi等[41]发表了评估RTOG 0212和0214两个PCI对NCF影响的临床试验研究。他们从RTOG 0212、0214中筛选出符合入组条件的SCLC和NSCLC患者,其中410例接受了PCI和173例列为观察组。完成基线评估后,在治疗前、治疗后6个月和12个月,利用HVLT或EORTC QLQ-C30测试分析短期回忆、延迟回忆和自我认知功能。结果显示,PCI后6个月和12个月时,两组患者的上述NCF等均较PCI前明显下降(P<0.0001和P=0.002)。而纳入50例NSCLC患者治疗后接受PCI(30Gy/15F)的一项Ⅱ期随机临床试验,则发现仅有6例患者出现了焦虑,下肢无力,听力下降和嗅觉过敏等远期副反应,显示出PCI很好的耐受性和较低的毒性反应[42]。近年来对PCI不良反应的研究发现,学习、记忆等NCF损伤的主要原因源于海马沟回损伤。RTOG(0933)研究报道113例脑转移瘤接受海马保护全脑调强放疗,通过评价患者的霍普金斯语言学习能力,认为保护海马沟回的全脑放疗可以减轻患者记忆力的损伤,提高了患者生活质量[43],而另一项评估海马保护全脑放疗风险的研究也显示,绝对风险仅增加了0.2%[44]。由此可见,为减少PCI的神经毒性,采用新的放疗技术实施海马保护的全脑放疗是可行和安全的, RTOG有关海马保护全脑照射的Ⅲ期临床试验也在进展中,有望提供更多的关于这方面的数据加以验证。
综上所述,目前的多数研究认为PCI剂量25 Gy-30 Gy/10F,2年内不会引起严重的NCF的下降,PCI的毒性是可以接受的,远期毒性反应还有待在今后的使用中评估。
五、小 结
脑转移已经成为了NSCLC治疗失败的主要因素,尽管已发现PCI可降低或延迟脑转移发生,但是多数研究结论均未能证实患者总生存时间的获益。如果不加选择的给予PCI,可能导致明显的过度治疗,使得更多的患者面临长期神经毒性的风险。依据现有的研究结果,还没有足够的循证医学证据支持PCI在局部晚期NSCLC中的应用。预测在经选择的部分患者中可能会获得更好的应用前景。个体化选择性实施PCI是未来的研究方向,寻找NSCLC易发生脑转移的高危人群、PCI对生存的影响以及远期毒性等问题均需要我们更深层次的探讨。从分子水平来预测肺癌脑转移的发生风险,建立脑转移的预测模型是今后研究的热点,期待更多随机试验结果的出现,为临床提供更多的循证医学证据。
1 Sperduto PW, Kased N, Roberge D, et al. Summary report on the graded prognostic assessment:an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases[J]. J Clin Oncol, 2012, 30(4): 419-425.
2 Mujoomdar A, Austin JH, Malhotra R, et al. Clinical predictors of metastatic disease to the brain from non-small cell lung carcinoma:primary tumor size, cell type, and lymph node metastases[J]. Radiology, 2007, 242(3): 882-888.
3 Alsan Cetin I, Akgun Z, Atasoy BM, et al. Who may benefit from prophylactic cranial irradiation amongst stage Ⅲ non-small cell lung cancer patients[J]? J BUON, 2013, 18(2): 453-458.
4 Lockwood WW, Wilson IM, Coe BP, et al. Divergent genomic and epigenomic landscapes of lung cancer subtypes underscore the selection of different oncogenic pathways during tumor development[J]. PLoS One, 2012, 7(5): e37775.
5 Hubbs JL, Boyd JA, Hollis D, et al. Factors associated with the development of brain metastases: analysis of 975 patients with early stage non-small cell lung cancer[J]. Cancer, 2010, 116(21): 5038-5046.
6 Khan E, Ismail S, Muirhead R. Incidence of symptomatic brain metastasis following radical radiotherapy for non-small cell lung cancer: is there a role for prophylactic cranial irradiation?[J]. Br J Radiol, 2012 , 85(1020): 1546-1550.
7 Hsiao SH, Chung CL, Chou YT, et al. Identification of subgroup patients with stage ⅢB/Ⅳnon-small cell lung cancer at higher risk for brain metastases[J]. Lung Cancer, 2013, 82(2): 319-323.
8 Ding X, Dai H, Hui Z, et al. Risk factors of brain metastases in completely resected pathological stage ⅢA-N2 non-small cell lung cancer[J]. Radiat Oncol, 2012, 7: 119.
9 叶雄, 王思愚, 区伟, 等. 局部晚期非小细胞肺癌术后脑转移高危因素分析[J]. 中国肺癌杂志, 2007, 10 (2): 111-115.
10 Ceresoli GL, Reni M, Chiesa G, et al. Brain metastases in locally advanced nonsmall cell lung carcinoma after multimodality treatment: risk factors analysis[J]. Cancer, 2002, 95(3): 605-612.
11 Chen AM, Jahan TM, Jablons DM, et al. Risk of cerebral metastases and neurological death after pathological complete response to neoadjuvant therapy for locally advanced nonsmall-cell lung cancer[J]. Cancer, 2007, 109(8): 1668-1675.
12 Lee YJ, Choi HJ, Kim SK, et al. Frequent central nervous system failure after clinical benefit with epidermal growth factor receptor tyrosine kinase inhibitors in Korean patients with non-small cell lung cancer[J]. Cancer, 2010, 116(5): 1336-1343.
13 Truntzer P, Antoni DN, Santelmo N, et al. Superior sulcus non small cell lung carcinoma: retrospective analysis of 42 patients[J]. Radiat Oncol, 2014, 9: 259.
14 Kernstine KH, Moon J, Kraut MJ, et al. Trimodality therapy for superior sulcus non-small cell lung cancer: Southwest Oncology Group-Intergroup Trial S0220[J]. Ann Thorac Surg, 2014, 98(2): 402-410.
15 Foroulis CN, Zarogoulidis P, Darwiche K, et al. Superior sulcus (Pancoast) tumors: current evidence on diagnosis and radical treatment[J]. J Thorac Dis, 2013, Suppl 4: S342-S358.
16 Vos CG, Hartemink KJ, Blaauwgeers JL, et al. Trimodality therapy for superior sulcus tumours: evolution and evaluation of a treatment protocol[J]. Eur J Surg Oncol, 2013, 39(2): 197-203.
17 Cox JD, Stanley K, Petrovich Z, et al. Cranial irradiation in can cerof the lung of all cell types[J]. JAMA, 1981, 245 (5): 469- 472.
18 Umsawasdi T, Valdivieso M, Chen TT, et al. Role of elective brain irradiation during combined chemoradiotherapy for limited disease non-small cell lung cancer[J]. J Neurooncol, 1984, 2(3): 253-259.
19 Russell AH, Pajak TE, Selim HM, et al. Prophy locally advancedctic cranial irradiation for lung cancer patients at high risk for development of cerebralm etastasis: Results of a prospective randomizedtrial conducted by the radiation therapy on cology group[J]. Int J Radiat Oncol Biol Phys, 1991, 21: 637-643.
20 Mira JG, Miller TP, Crowley JJ, et al. Chest irradiation (RT) vs. chest RT+chemotherapy + prophylactic brain RT in localized non small cell lung cancer: a southwest oncology group randomized study[J]. Int J Radiat Oncol BiolPhys, 1990, 19(suppl 1): 145.
21 Gore EM, Bae K, Wong SJ, et al. Phase Ⅲ comparison of prophylactic cranial irradiation versus observation in patients with locally advanced non-small-cell lung cancer: primary analysis of radiation therapy oncology group study RTOG 0214[J]. J Clin Oncol, 2011, 29(3): 272-278.
22 Sun DS, Hu LK, Cai Y, et al. A systematic review of risk factors for brain metastases and value of prophylactic cranial irradiation in non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2014, 5(3): 1233-1239.
23 Park HS, Decker RH , Wilson LD, et al. Prophylactic Cranial Irradiation for Patients With Locally Advanced Non-Small-Cell Lung Cancerat High Risk for Brain Metastases[J]. Clin Lung Cancer, 2015, 16(4): 292-297.
24 Xie SS, Li M, Zhou CC, et al. Prophylactic cranial irradiation may impose a detrimental effect on overall survival of patients with nonsmall cell lung cancer: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(7): e103431.
25 Li N, Zeng ZF, Wang SY, et al. Randomized phase Ⅲ trial of prophylactic cranial irradiation versus observation in patients with fully resected stage ⅢA-N2 non small-cell lung cancer and high risk of cerebral metastases after adjuvant chemotherapy[J]. Ann Oncol, 2015, 26(3): 504-509.
26 Gomez DR, Cox JD, Roth JA, et al. A prospective phase 2 study of surgery followed by chemotherapy and radiation for superiorsulcus tumors[J]. Cancer, 2012, 118(2): 444-451.
27 Ruysscher DD, Groen H. Prophylactic cranial irradiation (PCI) vs 0bservation in stage Ⅲ NSCLC.(2011-1-24)[2015-8-31].https://www.clinicaltrials.gov/ct2/show/NCT01282437?term= NCT01282437.
28 Deruysscher D. Radiation therapy in preventing central nervous system (CNS) metastases in patients with non-small cell lung cancer.(2011-2-1)[2015-8-31]. https://www.clinicaltrials.gov/ct2/show/NCT01290809?term= NCT01290809.
29 Lee CG. Radiation therapy to the brain or observation in preventing brain metastases in patients with advanced non-small cell lung cancer.(2009-8-7)[2015-8-31]. https://www.clinical -trials.gov/ct2/show/NCT00955695?term= NCT00955695.
30 Li Q, Yang J, Yu Q, et al. Associations between single-nucleotide polymorphisms in the PI3K-PTEN-AKT-mTOR pathway and increased risk of brain metastasis in patients with non-small cell lung cancer[J]. Clin Cancer Res, 2013, 19(22): 6252-6260.
31 Li Z, Lu J, Zhao y, et al. The retrospective analysis of the ferquency of EGFR mutations and the efficacy of gefitinib in NSCLC patients with brain metastasis[J]. J Clin Oncol Meeting Abstracts, 2011, 29(15): supple18065.
32 Sun D, Li X, Ma M, et al. The predictive value and potential mechanisms of miRNA-328 and miRNA-378 for brain metastases in operable and advanced non-small-cell lung cancer[J]. Jpn J Clin Oncol, 2015, 45(5): 464-473.
33 Søes S, Daugaard IL, Sørensen BS, et al. Hypomethylation and increased expression of the putative oncogene ELMO3 are associated with lung cancer development and metastases formation[J]. Oncoscience, 2014 , 1(5): 367-374.
34 Xie SS, Tan M, Lin HY, et al. Overexpression of adenylate cyclase-associated protein 1 may predict brain metastasis in non-small cell lung cancer[J]. Oncol Rep, 2015 , 33(1): 363-371.
35 Preusser M, Streubel B, Berghoff AS, et al. Amplification and overexpression of CMET is a common event in brain metastases of non-small cell lung cancer[J]. Histopathology, 2014, 65(5): 684-692.
36 Iuchi T, Shingyoji M, Itakura M, et al. Frequency of brain metastases in non-small-cell lung cancer, and their association with epidermal growth factor receptor mutations[J]. Int J Clin Oncol, 2014, 10.
37 Wang L, Wang Z, Liu X, et al. High-level C-X-C chemokine receptor type 4 expression correlates with brain-specific metastasis following complete resection of non-small cell lung cancer[J] . Oncol Lett, 2014, 7(6): 1871-1876.
38 Slotman BJ, Mauer ME, Bottomley A,et al. Prophylactic cranial irradiation in extensive disease small cell lung cancer: short term health related quality of life and patient reported symptoms: results of an international Phase Ⅲ randomized controlled trial by the EORTC Radiation Oncology and Lung Cancer Groups[J]. J Clin Oncol, 2009, 27(1): 78-84.
39 赵蕾, 郭金栋, 吕长兴. 小细胞肺癌患者预防性全脑放射治疗疗效及健康相关生命质量分析[J]. 中华放射医学与防护杂志, 2013, 33(3): 294-298.
40 Le Péchoux C, Laplanche A, Faivre-Finn C, et al. Clinical neurological outcome and quality of life among patients with limited small-cell cancer treated with two different doses of prophylactic cranial irradiation in the intergroup phase Ⅲtrial[J]. Ann Oncol, 2011, 22(5): 1154-1163.
41 Gondi V, Paulus R, Bruner DW, et al. Decline in tested and self-reported cognitive functioning after prophylactic cranial irradiation for lung cancer: pooled secondary analysis of Radiation Therapy Oncology Group randomized trials 0212 and 0214[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4): 656-664.
42 Gawkowska-Suwińska M, Blamek S, Heyda A, et al. Tolerability and toxicity of prophylactic cranial irradiation in patients with non-small cell lung cancer-Results of a phase Ⅱ study (with estimation of hematological toxicity, pituitary function and magnetic resonance spectra changes)[J]. Rep Pract Oncol Radiother, 2014 , 19(6): 361-368.
43 Gondi V, Pugh SL , Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase Ⅱ multi-institutional trial[J]. J Clin Oncol, 2014, 32(34): 3810-3816.
44 Harth S, Abo-Madyan Y, Zheng L, et al. Estimation of intracranial failure risk following hippocampal-sparing whole brainradiotherapy[J]. Radiother Oncol, 2013, 109(1): 152-158.
(本文编辑:黄红稷)
张矛,陈忠民,崔洪霞,等. 非小细胞肺癌脑预防照射研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(6): 666-670.
10.3877/cma.j.issn.1674-6902.2016.06.025
吉林省卫生计生科研课题基金资助项目(2015S017)
130012 长春,吉林省肿瘤医院胸部肿瘤放疗三科1院办2、胸部肿瘤内一科3
崔洪霞,Email: 2503074283@qq.com
R734.2
A
2015-12-10)

