基于气相色谱质谱联用的乳酸菌辅助发酵过程中腐乳组分变化的分析
杨 芹,陈晓华,2,*,张 灏,陈 卫,陈永泉
(1.江南大学食品学院,江苏无锡 214122;2.衡阳师范学院生命科学与环境学院,湖南衡阳 421008)
基于气相色谱质谱联用的乳酸菌辅助发酵过程中腐乳组分变化的分析
杨 芹1,陈晓华1,2,*,张 灏1,陈 卫1,陈永泉1
(1.江南大学食品学院,江苏无锡 214122;2.衡阳师范学院生命科学与环境学院,湖南衡阳 421008)
采用代谢组学的思路,利用GC/MS联用方法分析了腐乳在常规毛霉菌发酵以及鼠李糖乳杆菌GG株(LactobacillusrhamnosusGG strain,LGG)辅助发酵过程下其化合物的变化。分离鉴定85个化合物,涉及到氨基酸,有机酸和糖类等物质,其中33个化合物的定性结果得到了标样验证。通过对发酵过程中化合物种类及其浓度变化的分析发现在添加乳酸菌LGG辅助发酵的腐乳中,丙氨酸、甘氨酸、丝氨酸、苏氨酸等甜味氨基酸和天冬氨酸等鲜、酸味氨基酸的含量显著高于常规毛霉菌发酵的腐乳,这为在实际的腐乳生产及工艺流程优化时考虑加入乳酸菌来改善腐乳成品的口味提供了物质依据。但实验中同时也发现,LGG辅助发酵条件不会促进腐乳后期发酵速度的加快。基于上述结论,在腐乳的发酵过程中,可以通过添加乳酸菌来进行辅助发酵,以此调控、优化腐乳发酵的生化过程。同时该工作亦表明代谢组学的研究思路可以用于优化腐乳发酵过程工艺设计,也适用于类似的传统发酵食品发酵过程的监控。
气相色谱-质谱联用,乳酸菌,腐乳发酵,代谢组学,氨基酸
腐乳为常规发酵食品,它是以大豆为原料,在毛霉菌等微生物的作用下进行发酵而成,在我国食用豆腐乳已有上千年的历史。腐乳的发酵过程可以分为前期发酵与后期发酵两个阶段。在腐乳的发酵过程中豆腐坯中的蛋白质在微生物的作用下会分解为游离氨基酸以及一些风味物质;淀粉等在这个过程中转化为酒精与有机酸。同时腐乳发酵过程中产生的小分子还会与辅料中的香料、酒等相互作用,生成酯类等具有特殊风味的腐乳成品[1]。
腐乳的发酵过程实际上是一个多酶系协同作用下的一个复杂的生物化学过程,其发酵过程的变化及终点时的营养组成与参与腐乳发酵的微生物的种类息息相关[2]。目前用于腐乳生产及使用在腐乳发酵前期的微生物主要是毛霉属、根霉属、细菌中芽孢杆菌属和微球菌属等,以霉菌为主[3]。考虑到毛霉耐温范围窄、根霉菌丝稀疏以及其蛋白酶和肽酶活性低而细菌中芽孢菌的含量较少等原因,有必要开发具有很好抗杂菌能力和优良发酵性能的菌种,扩展用以腐乳生产的菌种类型。另一方面,亦可以通过在后发酵开始时添加合适的微生物来达到缩短腐乳的发酵周期、改善其口味、品质等目的。此类微生物的筛选可以通过追踪腐乳生产过程中酶活力及化学组分的变化,考察实际生产中微生物对腐乳发酵成熟、缩短生产周期和提高腐乳品质等因素的影响来实现。周荧等[4]分析了腐乳发酵过程中化学组分含量和质构参数的变化,发现低盐含量下腐乳游离氨基酸和游离脂肪酸的含量较高,且腐乳成熟时间较短。Serrazanetti等[5]将乳酸菌(Lactobacilluscasei和Lactobacillusacidophilus)应用于豆腐发酵,并分析了发酵后豆腐中的抗菌化合物。他们发现L.casei和L.acidophilus的联合使用可以延长豆腐的货架期,而且发酵过程中产生的化合物及其感官特性与使用的发酵菌株息息相关。他们还指出,乳酸菌用做发酵菌株可以抑制豆腐中多不饱和脂肪酸的过氧化,降低其中醇类化合物的氧化。
本文采用气相色谱质谱联用(GC/MS)技术分析腐乳在不同发酵条件下不同时间点的小分子变化,讨论鼠李糖乳杆菌GG株(LactobacillusrhamnosusGG strain,LGG,ATCC53103)辅助发酵条件对发酵过程的影响,为腐乳品质的改善及工艺的改进提供科学依据。
1 材料与方法
1.1 材料与仪器
正己烷与甲醇 购于天地公司(色谱纯,Tedia Company Inc.,USA);盐酸甲氧胺和无水吡啶 购自百灵威公司(J&K Chemical Ltd.,China);硅烷化试剂N-甲基-N-三甲基硅三氟乙酰胺(MSTFA) 购于西格玛公司(Sigma-Aldrich Co.,USA);十五碳酸甲酯(FAME C15∶0) 购于Nu-Chek公司(Nu-Chek Prep,Inc.,USA);实验用水 由Milli-Q8超纯水发生器(Millipore Co.,USA)制备;豆腐白坯 购于当地超市;鼠李糖乳杆菌GG株(LactobacillusrhamnosusGG strain,LGG,ATCC53103) 购于中国普通微生物菌种管理中心,保存在江南大学食品生物技术中心菌种保藏中心。
Trace1310-TSQ 8000 Evo气相色谱质谱联用仪 美国赛默飞公司;Rtx-5 MS毛细管色谱柱(0.25 mm×30 m,0.25 μm) 美国Restek公司;Milli-Q8超纯水发生器 美国密理博公司。
1.2 实验方法
1.2.1 样品制备 实验室使用的豆腐乳样本,由豆腐白坯开始,将豆腐坯侧面放入蒸笼,行间留约1 cm左右空间,以通气散热,促进毛霉菌生长。采用自然接种法接种毛霉菌,温度控制在20~24 ℃,接种22 h开始第一次翻格,以调节上下温差和补充空气;培养到28 h进行第二次翻格,36 h时菌丝生长成熟。45 h时毛霉呈现浅黄色,此时通风降温,搭蒸笼凉花,促进毛霉散热和水分散发。毛霉凉透之后,将相互依连的毛霉菌丝分开,搓毛,使其包住豆腐坯。同时,在拌料盆内依次加入食盐、辣椒粉、五香粉用勺拌匀,将搓毛后的豆腐坯裹满配料依次排列、压平置消毒好的瓶子,分层加料。其中LGG辅助发酵组在拌料时将LGG菌加入配料。豆腐坯装瓶后灌入茶油,茶油淹过坯面2 cm。此时要注意茶油不宜过满以防止发酵时涌出瓶外,之后加盖封严进行后发酵。腐乳的后发酵在贮藏过程中完成,在常温条件下,一般经过1~3个月左右腐乳可发酵成熟。
将保存在-80 ℃的LGG接入液体MRS培养基,37 ℃培养18 h,活化三代。LGG培养液离心,菌体用PBS清洗2次,调浓度为109cfu/mL,以5%(v/g)的含量采用喷洒方式搅拌到配料中,大概配料中含有5×107CFU/g LGG。
1.2.2 样品处理 腐乳冻干研磨成粉,称取5 mg,加入0.5 mL正己烷,超声1 min,置振荡器上(转速:60 r/min)振荡30 min后,3600 r/min离心10 min倾去上清。残渣再加入0.5 mL正己烷,按上述条件超声,振荡,离心,再次弃去上清,留残渣。所得残渣加入0.5 mL 80%甲醇水溶液,超声1 min,置振荡器上(转速:60 r/min)振荡30 min后,3600 r/min离心10 min,取上清,冷冻离心机冻干,即为样品中的极性组分。
样品极性组分溶于40 μL 20 mg/mL的盐酸羟甲胺吡啶溶液,37 ℃水浴加热肟化90 min,然后加入40 μL MSTFA在37 ℃下硅烷化60 min。反应完毕,添加40 μL FAME(C15∶0,1 mg/mL)作为内标,涡旋,13000 r/min离心15 min,取上清进样分析。
另取各腐乳冻干粉5 mg混匀,称取混匀样5 mg共6份,按上述方法提取,作为质控(quality control,QC)样品,监控处理方法的重复性及分析过程中仪器的稳定性。
1.2.3 样品分析条件 衍生后样品在Trace1310气相色谱仪上分析,进样口温度为240 ℃,载气为高纯氦气,采用恒流模式,流速为1.5 mL/min;进样体积为1 μL,分流比10∶1。色谱柱为Rtx-5MS,柱温箱的初始温度为70 ℃,5 ℃/min升至230 ℃后以90 ℃/min升温至320 ℃,保持5 min。
TSQ 8000 Evo质谱仪配备EI源,采集数据:离子源及接口温度分别为250和280 ℃,扫描方式为全扫,质量数范围为33~600。
1.3 数据处理
通过与NIST库,Fiehn的数据库以及标样验证等方法对腐乳发酵GC/MS分析谱中的化合物。通过TraceFinder软件提取定性的化合物,采用各自样品(腐乳干粉)的重量以及内标(C15∶0 FAME)进行归一化校正。所得数据矩阵导入SIMCA P,进行多变量统计分析,寻找腐乳在发酵过程中以及在不同的微生物环境下变化显著的化合物。
此外,数据采用SPSS进行t检验,认为p<0.05的变量在两组间有显著性差异。
2 结果与讨论
2.1 基于GC/MS的代谢组学分析
本文采用常规提取极性小分子使用的溶剂80% MeOH[6]来最大化的获得样品中的化合物信息。鉴于在腐乳制备过程中为了提升其风味及营养添加了茶油,在进行极性化合物提取前,我们使用正己烷溶剂对腐乳干粉进行了脱脂处理。在比较了采用80% MeOH 两次重复提取与单次提取的GC/MS分析结果后,基于二者差异仅限于化合物的浓度,对所得化合物的种类并无影响的事实,为提高样品分析的通量,我们选取了单次提取样品的方法。

表1 腐乳提取物的GC/MS分析结果所鉴定的化合物列表
本工作采用GC/MS分析了腐乳在常规发酵及添加乳酸菌LGG后发酵过程中的化合物变化。QC样品的GC/MS总离子流色谱图见图1。图2显示的是采用QC样品来评价方法重复性的结果:在所有的特征化合物中,RSD<15%的化合物占总化合物的73.8%,RSD<30%的化合物占总化合物的84.5%。表明了该分析方法重复性良好,所得数据可以用来反应、表征腐乳发酵过程中化合物的变化。
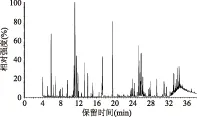
图1 GC/MS分析乳腐的总离子流图Fig.1 Total ion chromatogram of GC/MS based metabolic profiling of sufu extracts

图2 质控样品中不同化合物的相对标准偏差(RSD,%)分布Fig.2 RSD(%)of metabolites in quality control samples注:柱状图:目标化合物占总化合物的个数百分比,折线图:目标化合物占总化合物的累计个数百分比。
使用上述表征的方法采集腐乳在常规发酵(Control)和添加乳酸菌LGG辅助发酵(LGG)0、1、2、3、4、5、6周的数据。首先将腐乳的提取物进行肟化反应,降低还原糖的色谱图的复杂性[7],同时亦减小随后定性工作的难度,随后进行硅烷化衍生,用于GC/MS分析。所得结果通过与文献对比以及NIST/Fiehn数据库检索,鉴定得到85个化合物,其中33个化合物的定性结果得到了标样验证,所得的化合物涉及到20余种氨基酸,10余种有机酸和多种糖及糖醇、糖酸类物质,鉴定结果见表1。

续表

续表
注:*定性结果已经标样验证。此前,Ma等[8]采用HPLC-UV方法分析了臭腐乳(grey sufu)在发酵过程中的化合物变化,检测到15种游离氨基酸和乳酸、丁酸、琥珀酸等挥发性有机酸酸。Han[9]等分析了固态发酵的腐乳,检测到18种游离氨基酸。相对于文献报道,我们当前的方法检测到了较丰富的化合物种类,为从腐乳化学组成的角度表征腐乳发酵的过程与特征提供了充分依据。此外,本实验中还检测到一个黄酮类化合物,经与数据库对照,为染料木素(Genistein)。
2.2 腐乳发酵过程中化学组分的变化
常规用于腐乳发酵的微生物主要为毛霉属、根霉属、细菌中的芽孢杆菌属和微球菌属菌株,较少使用其它菌类。然而,鲁绯等[10]报道从青方腐乳中分离得到了三株对腐乳风味有促进作用的植物乳杆菌。Serrazanetti等[5]比较了两株乳酸菌Lactobacilluscasei和Lactobacillusacidophilus共同以及单独作用于豆腐生产及腐乳发酵的结果,发现,乳酸菌的加入可以降低豆腐发酵过程中多不饱和脂肪酸的过氧化和醛类化合物的还原。同时考虑到乳酸菌在食品方面利用的各种优势,在本实验中我们选择在常规腐乳发酵方法的基础上添加LGG来进行辅助发酵,考查添加乳酸菌后腐乳发酵小分子的变化以及对发酵整个过程进程的影响。

图3 不同发酵条件(常规毛霉菌发酵(对照组)和鼠李糖乳杆菌GG株辅助发酵(LGG组))的腐乳的主成分分析得分图(A)和PLS-DA得分图(B)Fig.3 PCA(A)and PLS-DA(B)score plots of sufu fermented by Mucor only(Control) and Mucor-Lactobacillus rhamnosus GG strain(LGG)
首先采用主成分分析(PCA)不同的发酵过程中小分子的变化趋势。在PCA得分图(图3 A)上,可以看到添加乳酸菌LGG后,发酵过程中的腐乳的小分子组分发生了明显变化:在第一和第二个主成分对角线方向上,常规发酵(Control)及添加乳酸菌LGG辅助发酵(LGG)样品呈现出由于发酵条件不同而带来的差异性,第二个主成分则更多地反映了发酵时间对腐乳发酵过程的影响。
为了进一步比较添加LGG进行辅助发酵后对腐乳发酵过程的影响,以前期数据分析所得到的87个化合物为变量,对常规发酵条件下的21个腐乳样本与LGG辅助发酵下的21个样本进行偏最小二乘判别分析(PLS-DA)分析,以寻找在两种发酵条件下变化较大的物质,进一步评价乳酸菌LGG辅助发酵的效果。其得分图如图3(B)所示,可以看到在第一个主成分上,两类样品按发酵条件的不同,常规发酵的腐乳与乳酸菌LGG辅助发酵的样品得到了完全分离。该模型的参数R2Y=0.90,说明了所建模型可以很好地解释建模数据,同时参数Q2=0.86,则表明该模型具有良好的对未知数据的预测能力。鉴于PLS-DA为有师监督的模式识别方法,为了确保所得模型的可靠性,对该模型进行交叉验证,数据交互计算(permutation)999次,其R2和Q2的截距分别为0.347和-0.271,说明模型没有过拟合,所得的PLS-DA的分析结果是可靠的。

表2 腐乳不同发酵条件下的差异性化合物
选取PLS-DA分析结果中VIP(variable importance in projection)值大于1的所有变量,发现在腐乳的发酵过程中,变化比较大的化合物主要涉及氨基酸,小分子酸和部分糖类(表2)。在LGG组呈上升趋势的化合物以氨基酸为主,主要包括丙氨酸(1.40),甘氨酸(2.62),丝氨酸(1.67),苏氨酸(1.47),高丝氨酸(1.78),天冬氨酸(1.85),鸟氨酸(1.44)和天冬酰胺(2.43)。小分子酸为乳酸(1.31)和甘油酸(1.77)(括号内数字为LGG辅助发酵组样本相对对照组的变化倍数,详见表2)。乳酸菌用于发酵腐乳的一个最大顾虑是其产乳酸的能力较强,可能在腐乳成品中引入较重的酸味。然而实验结果表明,LGG组与Control组的乳酸含量虽然存在显著性差异(p<0.01),但其绝对量的变化相对较小,而且相对于氨基酸在乳酸菌发酵下含量的提高,大部分有机酸小分子则呈现下降趋势(表2),该结果可以部分地缓解我们对在腐乳发酵过程中引入乳酸菌后可能带来的产品酸度升高的顾虑。油酸(0.75),11-反-十八烯酸(0.81)和单油酸甘油酯(0.63)是在腐乳进行脱脂后得到的三个长链脂肪酸相关的化合物,其含量在LGG辅助发酵组呈现下降趋势,根据余若黔等[11]在解释腐乳中游离脂肪酸变化时将脂肪酸的含量与催化其与乙醇进行酯化反应的脂肪酶的活性相联系,本实验中可能是由于乳酸菌LGG辅助发酵与常规发酵条件下对脂肪酶的活性影响不一致,乳酸菌环境导致了酶活的增强或是随发酵的进行保持酶活力仍能保持而引起的。
纵观上述所有化合物的变化,其倍数主要处在0.5~2.5倍左右,主要为氨基酸且含量升高的氨基酸中大部分是具有增加甜味、鲜味或酸味的功能,这表明加入乳酸菌可以改善腐乳的发酵过程。
2.3 发酵过程氨基酸的变化
对于大豆产品来说,一旦发酵过程开始,主要的一个变化即为蛋白质的解离[12]。GC/MS的分析结果也表明在腐乳发酵过程中,添加乳酸菌后变化较大的化合物主要是氨基酸。因此,腐乳在发酵过程中的游离氨基酸,可以看作是监测腐乳发酵工艺、流程的一个重要指标。Dajanta等[12]分析了大豆发酵前后游离氨基酸的变化,发现发酵过程大大增加了Thua nao中游离氨基酸的含量。本工作中同样检测到大量氨基酸,由表1可知腐乳提取物发现了除了组氨酸、赖氨酸和精氨酸之外的其它17种蛋白质氨基酸以及多种必需氨基酸,这说明,腐乳可以提供相对丰富的氨基酸种类,与其它豆制品一样也是优质的食物蛋白质来源[9]。同时,部分呈味氨基酸的存在也为腐乳提供了丰富的口感。

图4 差异性氨基酸(p<0.05)在两种发酵过程中含量的变化Fig.4 Changes of differential amino acids(p<0.05)along the fermentation
此外,在比较LGG辅助发酵及常规毛霉菌发酵条件下的氨基酸变化情况时亦发现:大多数的氨基酸在乳酸菌LGG辅助发酵条件下的含量比单纯毛霉菌发酵条件下的含量高。这说明乳酸菌LGG的加入可以显著促进腐乳的发酵程度。图4所示为部分在两组之间存在显著差异(p<0.05)的氨基酸及其在整个发酵过程中含量的变化情况。这些氨基酸有多种为呈味氨基酸,这是氨基酸在食品中的另一重要作用[8,13]。天然蛋白质中的氨基酸都属于L型,大多具有甜味或是苦味,有少数具有鲜味或是酸味[8]。本实验对腐乳发酵过程中氨基酸化合物的分析结果表明,添加乳酸菌LGG辅助发酵的腐乳中丙氨酸、甘氨酸、丝氨酸、苏氨酸等甜味氨基酸和天冬氨酸等鲜、酸味氨基酸的含量显著高于常规毛霉菌发酵的腐乳。这为在实际的腐乳生产及工艺流程优化时考虑加入乳酸菌来改善腐乳成品的口味提供了物质依据。
然而另一方面,由图4我们可以发现虽然随着发酵时间的延长,腐乳中的氨基酸含量呈上升趋势,但对比各氨基酸在发酵过程中含量的变化情况,则发现两种不同发酵条件下腐乳中氨基酸含量达到最高值的时间点基本是一致的。若以腐乳中大部分氨基酸的含量达最高值为后发酵阶段基本完成的标志[4],本实验结果表明乳酸菌LGG的加入对促进腐乳后发酵过程的速度并无明显优势。
3 结论
基于GC/MS技术采集了不同发酵条件下腐乳在发酵过程中的化合物信息,利用代谢组学的思路考察了发酵过程中化合物的变化并在此基础上评估了乳酸菌辅助发酵对腐乳发酵的影响。添加乳酸菌后,虽然其乳酸的含量相对常规发酵过程会升高,但就其物质的绝对量来看,乳酸菌的添加不会导致腐乳最终口味的酸化。实验结果表明,乳酸菌辅助发酵条件下,一些具有甜味的氨基酸如丙氨酸、甘氨酸等以及呈现鲜味的天冬氨酸等含量升高,此类化合物作为形成食物风味的物质基础,也说明鼠李糖乳杆菌GG株的添加能够提升腐乳的口味。
[1]王越鹏,李立英,王建明. 腐乳生产过程中风味物质的变化分析[J]. 食品与发酵科技,2012,48(2):76-81.
[2]吴拥军,龙菊,程昌泽,等. 腐乳发酵过程中酶活力和化学组分变化研究[J]. 食品科学,2009,30(3):249-253.
[3]蒋芳芳. 腐乳发酵过程中各成分变化的研究[D]. 长沙:湖南农业大学,2012.
[4]周荧,潘思轶. 腐乳发酵过程中化学组分与质构的变化[J]. 食品科学,2011,32(1):70-73.
[5]Serrazanetti D I,Ndagijimana M,Miserocchi C,et al. Fermented tofu:Enhancement of keeping quality and sensorial properties[J]. Food Control,2013,34(2):336-346.
[6]Yuan M,Breitkopf S B,Yang X,et al. A positive/negative ion-switching,targeted mass spectrometry-based metabolomics platform for bodily fluids,cells,and fresh and fixed tissue[J]. Nat. Protocols,2012,7(5):872-881.
[7]Asres D D,Perreault H. Monosaccharide permethylation products for gas chromatography-mass spectrometry:how reaction conditions can influence isomeric ratios[J]. Canadian Journal of Chemistry,1997,75(10):1385-1392.
[8]He X,Liu J,Cheng L-l,et al,Quality Properties of Crispy Winter jujube Dried by Explosion Puffing Drying[J]. International Journal of Food Engineering,2013:99.
[9]Han B-Z,Rombouts F M,Nout M J R. Amino acid profiles of sufu,a Chinese fermented soybean food[J]. Journal of Food Composition and Analysis,2004,17(6):689-698.
[10]鲁绯,腐乳发酵机理、品质改进和模式识别研究[D]. 北京:中国农业大学,2005.
[11]余若黔,涂煜,李杰伟,等. 腐乳生产后期发酵的化学变化[J]. 华南理工大学学报:自然科学版,2001,29(5):64-67.
[12]Dajanta K,Apichartsrangkoon A,Chukeatirote E,et al. Free-amino acid profiles of thua nao,a Thai fermented soybean[J]. Food Chemistry,2011,125(2):342-347.
[13]Fernstrom J D,Munger S D,Sclafani A,et al. Mechanisms for Sweetness[J]. The Journal of Nutrition,2012,142(6):1134S-1141S.
A gas chromatography/mass spectrometry based metabolomics study of the fermentation of sufu
YANG Qin1,CHEN Xiao-hua1,2,*,ZHANG Hao1,CHEN Wei1,CHEN Yong-quan1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.College of Life Science and Environment,Hengyang Normal University,Hengyang 421008,China)
Metabolonic study of sufu fermented byMucorand Mucor-LactobacillusrhamnosusGG strain(LGG)was conducted,using gas chromatography/mass spectrometry(GC/MS)to acquire the changes of the chemical components of sufu during the fermentation. 85 compounds including amino acids,organic acids and sugars were identified and 33 of them were validated by authentic standards. The analysis revealed that sufu fermented with the assistance of LGG could produce higher content of amino acids such as alanine,glycine,serine,threonine and aspartate,thus enhance its taste of sweetness or palatable. Though profiles of compounds at different time under different fermentation indicated that the addition of lactobacillus could not accelerate fermentation of sufu,this work indicated that lactobacillus could be use to improve and optimize the fermentation of sufu. Besides,the study has demonstrated that metabolomic strategies could apply to optimize the fermentation process of sufu,as well as other traditional fermented foods.
gas chromatography/mass spectrometry; lactic acid bacteria; fermentation of sufu; metabolomics; amino acid
2016-06-17
杨芹(1981- ),女,博士,讲师,研究方向:食品分析,E-mail:qyang@jiangnan.edu.cn。
*通讯作者:陈晓华(1981-),女,讲师,主要从事食品微生物和功能食品开发方面的研究,E-mail:chxh0217@163.com。
湖南省自然科学基金项目(2015JJ6012)。
TS201.2
A
1002-0306(2016)22-0178-08
10.13386/j.issn1002-0306.2016.22.027

