鱼源胶原蛋白及胶原功能肽的研究进展
蔡路昀,马 帅,曹爱玲,李秀霞,吕艳芳,于志鹏,邓尚贵,励建荣,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州 121013;2.西南大学食品科学学院,重庆 400715;3.萧山出入境检验检疫局,浙江杭州 311208;4.浙江海洋学院食品与医药学院,浙江舟山 316022)
鱼源胶原蛋白及胶原功能肽的研究进展
蔡路昀1,2,马 帅1,曹爱玲3,李秀霞1,吕艳芳1,于志鹏1,邓尚贵4,励建荣1,2,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁锦州 121013;2.西南大学食品科学学院,重庆 400715;3.萧山出入境检验检疫局,浙江杭州 311208;4.浙江海洋学院食品与医药学院,浙江舟山 316022)
为解决鱼类加工废弃物综合利用程度低的问题,提高鱼类加工废弃物的经济附加值,本文综述了胶原功能肽的制备方法等方面的最新研究进展,并分析了目前胶原功能肽相关研究存在的问题,同时对其应用前景进行了展望,旨在为鱼源胶原功能肽的开发和应用提供科学理论依据。
鱼源,胶原蛋白,功能肽
我国是水产品生产和贸易大国,在水产品生产加工过程中会产生大量的废弃物,造成了环境的污染和资源的严重浪费。目前,对鱼类加工废弃物的开发利用仅限于生产鱼粉、皮革、调味料等低附加值产品[1-3]。然而随着水产行业的不断发展和人们生活水平的提高,这些低附加值的产品已不能满足人们对生活更高层次的追求,因此,亟待研究者从鱼类加工废弃物中获取一种或多种高附加值的产品来满足人们的需求。而研究表明,鱼类加工废弃物中鱼鳞、鱼皮和鱼骨等部位富含胶原蛋白,是一种优质且资源丰富的蛋白质资源[4-5]。近年来,鱼胶原蛋白因其来源广、低抗原性、低过敏性和使用安全等特点深受研究者的广泛重视。鱼胶原蛋白逐渐替代了传统的胶原蛋白,为鱼类加工废弃物的高值化利用提供了一条新的途径。本文主要综述了鱼胶原蛋白的来源分布、制备方法及分子结构、鱼胶原功能肽的制备方法、鱼胶原功能肽等方面的最新研究进展,旨在增强人们对鱼胶原蛋白及胶原功能肽的了解,完善我国鱼类加工和综合化利用产业链。
1 鱼胶原蛋白的来源分布
目前,已分离出来的鱼胶原蛋白主要分布在鱼鳞、鱼皮、鱼骨、鱼鳔和肌肉等部位。有报道显示,胶原蛋白占鱼鳞总蛋白的10%~40%,更有利于胶原蛋白的提取和分离[6]。钱曼[7]研究表明,鲢鱼(Hypophthalmichthysmolitrix)鱼鳞中蛋白质含量约为78.27%,是提取胶原蛋白的优质原料。Kimura等[8]研究发现鲤鱼(Cyprinuscarpio)鱼骨胶原蛋白的提取率明显高于鱼鳞胶原蛋白的提取率,分别为20%和7%,且鱼骨和鱼鳞胶原蛋白均由两种不同的α-肽链构成,而两者的胶原蛋白在交联度上有明显差异。鱼皮中也富含胶原蛋白,有研究显示,鱼皮中的胶原蛋白含量占蛋白质总含量的80%左右,比鱼体其他部位的胶原蛋白含量高许多[9]。在淡水鱼中,傅燕风等[10]研究发现,鲢鱼、鳙鱼(Aristichthysnobilis)和草鱼(Ctenopharyngodonidellus)鱼皮的蛋白质含量分别约为25.9%、23.6%和29.8%;在海水鱼中,Puwastien P等[11]研究发现,马鲛鱼(Scomberomorusniphonius)、黄笛鲷鱼(Plectorhinchusflavomaculatus)、黄鳍金枪鱼(Thunnusalbacores)和军曹鱼(Rachycentroncanadum)皮中粗蛋白含量分别为21.50%、32.00%、32.66%和28.53%;其中黄鳍金枪鱼和军曹鱼皮中胶原蛋白含量占其鱼皮的22.64%和20.09%。与其他部位相比,鱼肉中的胶原蛋白含量仅占蛋白质总量的3%[12]。
2 鱼胶原蛋白的提取方法
根据采用的提取介质不同,鱼胶原蛋白的提取方法可分为热水提取法、酸法、碱法、酶法和中性盐提取法。在诸多情况下,往往单一的提取方法达不到预期的效果,因此在实际操作中,通常将多种提取方法互相结合使用。
2.1 热水提取法
热水提取法是利用热水经浸提、回流、高压蒸煮等手段从动物原料中获取有效成分的一种方法[13],具有操作快速、简便、成本低等优点。因在提取过程中不需要添加任何促溶剂,提取温度在60~75 ℃,所以此法提取的胶原蛋白纯度也较高。40 ℃以上的热处理会使胶原蛋白中的氢键和共价键断裂,从而破坏了胶原蛋白的三股螺旋结构,最终得到的产品为易变性的明胶[14]。黄雯等[15]采用热水法提取斑点叉尾(Ietaluruspunetaus)鮰鱼皮胶原蛋白,胶原蛋白的得率为16.98%。林家福等[16]研究了采用热水法提取罗非鱼(Oreochromisspp)皮胶原蛋白的工艺,结果表明,最佳工艺条件为提取温度为90 ℃、提取时间为2 h、提取pH为6.0、固液比1∶13(g/mL),罗非鱼皮胶原蛋白的得率为212 mg/g。
2.2 酸提取法
酸提取法是指原料在酸性环境和低离子浓度条件下破坏其分子间的盐键及Schiff键,从而引起胶原纤维溶解,最终将胶原蛋白提取出来。常使用的酸主要有盐酸、磷酸、乳酸、柠檬酸及乙酸等[17]。该方法作用条件温和,能够最大限度保持胶原蛋白的三股螺旋结构[18],使得到的胶原蛋白氨基酸组成、性质与天然胶原蛋白基本相同,但是经酸处理后胶原蛋白的溶解量很少,且胶原蛋白产率较低,设备腐蚀程度比较严重。Okazaki E等[19]研究竹荚鱼(Trachurusjaponicus)、蜥蜴鱼鱼鳞酸溶性胶原蛋白的提取方法,发现鱼鳞酸溶性胶原蛋白的提取率仅为干重的1.50%和0.43%。
2.3 碱提取法
碱提取法是利用碱性物质将原料中胶原蛋白的肽键水解,从而使胶原纤维膨胀、溶解,最终将胶原蛋白提取出来的一种方法[20]。但碱法提取出来的水解产物具有较低的相对分子质量,水解严重时,还会产生D-型、L-型氨基酸消旋混合物,且有的D-型氨基酸有毒。因此,很少使用此方法来提取完整结构的胶原蛋白。Sato等[21]采用NaOH溶液从鳟鱼(Squaliobarbusourriculus)、鲤鱼、鲭鱼(Pneumatophorusjaponicus)和鳗鱼(Anguillajaponica)鱼肉中提取胶原蛋白,胶原蛋白的提取率分别为0.47%、0.60%、0.50%和1.99%(以湿重计)。Yoshimur等[22]研究采用0.5 mol/L的NaOH溶液(含10%氯化钠),在4 ℃条件下对鲨鱼皮浸提20~30 d,得到的鲨鱼(Shark)皮碱性胶原蛋白粘度较大且易变性。
2.4 酶提取法
酶提取法是采用不同的蛋白酶在一定的外界环境条件下对胶原蛋白进行限制性降解,从而将末端肽切割下来,最终将胶原蛋白提取出来的一种方法[23]。此法具有反应速度快、提取率高、对胶原蛋白破坏性较小和无污染等优点,且提取的胶原蛋白具有纯度高、水溶性好、物理化学性质稳定等特点。常使用的蛋白酶有胃蛋白酶、木瓜蛋白酶、碱性蛋白酶和胰蛋白酶等[24-25]。Liu等[4]研究分别以鳙鱼的皮、鳞、鳍、骨骼和膀胱为实验对象,采用胃蛋白酶从其中提取和表征胶原蛋白,比较分析从同一鱼体不同部位提取出的胶原蛋白结构特征,结果显示,从这5个部位提取出的酶溶性胶原蛋白(PSC)均有两条完整的α1和α2肽链,且保持了完整的三股螺旋结构。
2.5 中性盐提取法
中性盐提取法的原理是在低浓度及中性环境的盐溶液中,胶原蛋白不能溶解,当盐浓度达到一定程度时,胶原蛋白就会发生溶解,最终得到盐溶性胶原蛋白。常使用的中性盐有Tris-HCl、氯化钾、氯化钠、乙酸钠、柠檬酸盐等。Montero等[26]研究以鲑鱼(Oncorhynchus)和欧洲无须鳕(hake)的肌肉和鱼皮为研究对象,采用不同浓度的NaCl溶液从其中提取盐溶性胶原蛋白,鱼皮中胶原蛋白提取量分别为48.8%和34.2%。Nishimoto等[27]研究用硫酸铵溶液分级沉淀日本琥珀鱼(S.dumerili)和日本鲽鱼(Pleuronichthyscornutus)胶原蛋白,结果显示,最终得到了V型和I型胶原蛋白。
3 鱼胶原蛋白的组成及结构特征
鱼胶原蛋白富含7种人体必需的氨基酸[28],其中,脯氨酸和羟脯氨酸约占总氨基酸含量的25%,甘氨酸占总氨基酸含量的三分之一左右,此外,丙氨酸和谷氨酸的含量也相对较多。
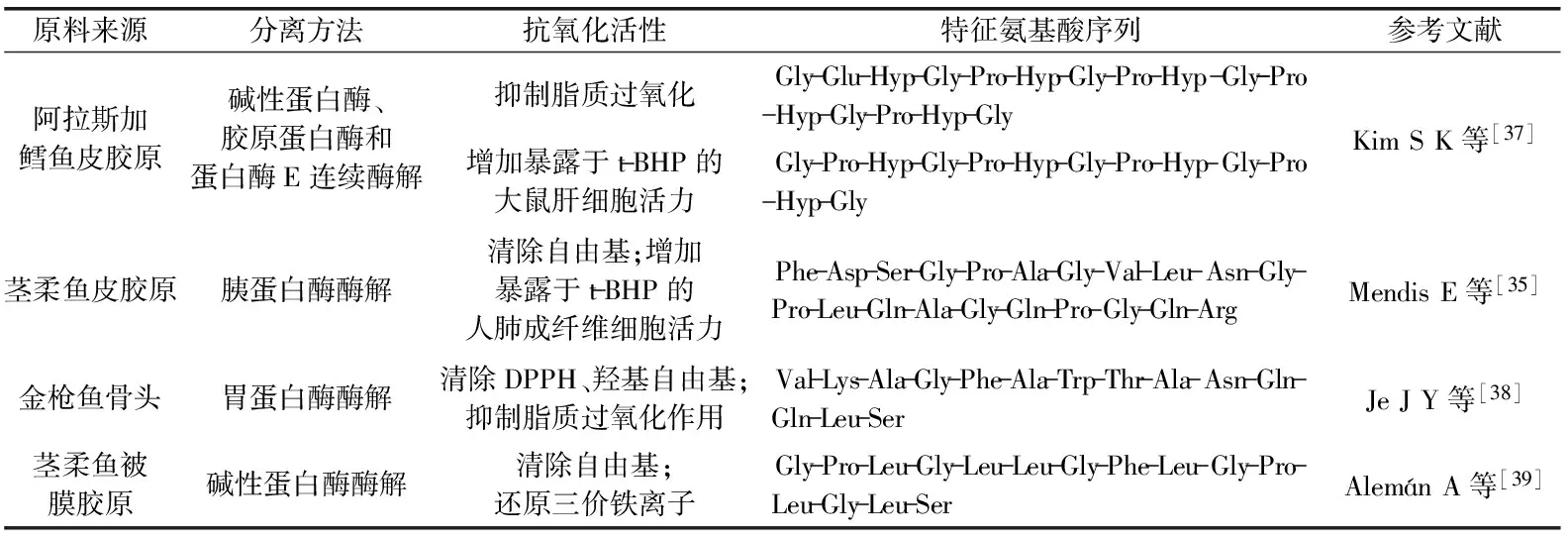
表1 来源于鱼类胶原蛋白的抗氧化肽
Zhang等[29]比较分析了草鱼皮、河豚鱼(Tetraodontidae)皮、大眼鲷鱼(Priacanthustayenus)皮及猪皮、牛皮中胶原蛋白的氨基酸组成,结果表明,这几种鱼皮中的亚氨基酸含量较接近(186残基/1000残基),但均低于猪皮和牛皮中的亚氨基酸含量(220残基/1000残基)。鱼胶原蛋白主要含有Ⅰ型和Ⅴ型胶原蛋白,主要分布在鱼皮、鱼鳞和鱼骨等处,由3条相同或不同的α-肽链相互缠绕而形成的螺旋结构的纤维状蛋白。鱼胶原蛋白含有大多数动物胶原蛋白所没有的第3条α-肽链,即鱼胶原蛋白是由3条不同种类的α-肽链形成的单一型杂分子α1(Ⅰ)α2(Ⅰ)α3(Ⅰ)组成,而非[α1(Ⅰ)]2α2(Ⅰ)杂分子使其水解物可能暴露更多的活性中心而使鱼胶原蛋白拥有多种生物活性[30]。
4 鱼胶原蛋白肽的制备
胶原多肽又称水解明胶,是胶原蛋白或明胶经过蛋白酶等降解处理使胶原蛋白的三股螺旋结构彻底打开,肽链被降解成为短的肽链,得到的相对分子质量约为3~20 ku的具有特殊生理活性的生物活性肽[31]。目前,鱼胶原蛋白肽的制备方法有化学或重组DNA合成法、体外蛋白酶水解法和从天然生物中提取法[32]。化学法合成的胶原蛋白肽一般成本较高,且副产物可能对人体有害,同时在生产过程中还会产生一些污染环境的排出物[33];重组DNA法合成的胶原蛋白肽一般为长肽,而鱼胶原蛋白功能肽普遍为短肽,因此此法不适合制备鱼类胶原蛋白肽;从天然产物中提取的胶原蛋白肽含量较少,不适宜在工业中生产;而体外蛋白酶水解法制备胶原蛋白肽具有降解所需的时间短、产品营养流失较少和无污染等优点,因此一般采用蛋白酶水解胶原蛋白的方法提取胶原蛋白肽[34]。Mendis等[35]研究以巨型鱿鱼(Architeuthisdux)皮为原料,采用三步酶解法制备了具有较好抗氧化活性的鱼皮胶原活性肽,同时又从其中制得了酶解产物,并测定其氨基酸序列。
5 鱼胶原蛋白活性肽的功能特性
鱼胶原蛋白活性肽具有ACE抑制、免疫调节、抗氧化和抗肿瘤等多种活性功能[36]。
5.1 鱼胶原蛋白肽的抗氧化活性
国内外对鱼胶原蛋白肽的抗氧化活性和其氨基酸序列进行了大量研究(表1)。
5.2 鱼胶原蛋白肽的降血压活性
目前,高血压已经成为影响人们生活质量水平的主要疾病。目前,对高血压的治疗集中在肾素-血管紧张素方面,主要是通过抑制血管紧张素转化酶(ACE)和肾素这两种关键酶来实现的。据报道,Fahmi等[40]发现碱性蛋白酶水解鲆类骨骼所得胶原蛋白肽对ACE抑制活性较强,其IC50为0.57 mg/mL。此外,在鱼类加工废弃物的水解液中也存在具有抑制ACE活性的胶原蛋白肽(见表2)。
5.3 鱼胶原蛋白肽的其他功能特性
除具有抗氧化活性和ACE抑制活性以外,鱼胶原蛋白肽还具调节人体免疫力、促进钙离子的吸收和抗肿瘤等活性功能[48]。Kato等[49]研究在三维人体皮肤组织模型中,得出含非洲鲫鱼皮胶原蛋白的饮料通过皮下吸收后可减弱由紫外光线引起的组织以及DNA损伤。Saito等[50]证实,鲑鱼和鳟鱼皮胶原多肽可影响脂质的吸收代谢,具有降脂作用。Okawa等[51]研究通过小鼠实验,结果显示,胶原三肽可有效改善由丙酮引起的皮肤瘙痒及干燥问题。此外研究者还发现鱼胶原蛋白酶解物具有抑制血小板凝集等多种生物活性[52]。
6 讨论
近年来,关于鱼胶原蛋白及胶原功能肽的研究逐渐增多,但还存在以下3个方面的问题:a:目前,在实际生产过程中鱼胶原蛋白及胶原功能肽的提取工艺仍需进一步优化完善,需要结合新型的生物技术寻求一种绿色高效的方法提取鱼胶原蛋白及胶原功能肽;b:目前,在生物医学和功能食品领域,鱼胶原蛋白及胶原功能肽的开发利用程度较低,下一步应该加强该方面的研究开发利用;c:现阶段,鱼胶原蛋白及胶原功能肽的研究基本上都是处于实验室研究阶段,并未真正的做到工业化,这其中的关键问题就是鱼胶原蛋白及胶原功能肽的提取技术还不够纯熟完善,需要科研工作者和相关部门进一步加强完善该方面的研究和探讨。

表2 鱼类废弃物中胶原蛋白源ACE抑制肽
从鱼类加工废弃物中提取胶原蛋白及胶原功能肽,不仅解决了鱼类加工废弃物的污染和资源的浪费问题,而且还能达到“低投入,高产出”的生产模式,促进鱼类加工行业的可持续发展,同时又消弱了对陆源胶原蛋白的依赖需求。随着科学技术的不断提高,鱼类加工废弃物将会得到越来越充分的开发利用,其发展前景将十分广阔。
[1]Glencross B,Blyth D,Irvin S,et al. An evaluation of the complete replacement of both fishmeal and fish oil in diets for juvenile Asian seabass,Lates calcarifer[J]. Aquaculture,2016,451:298-309.
[2]Muralidharan N,Shakila R J,Sukumar D,et al. Skin,bone and muscle collagen extraction from the trash fish,leather jacket(Odonusniger)and their characterization[J]. Journal of Food Science and Technology,2013,50(6):1106-1113.
[3]Huynh H L,Danhi R,Yan S W. Using fish sauce as a substitute for sodium chloride in culinary sauces and effects on sensory properties[J]. Journal of Food Science,2016,81(1):S150-S155.
[4]Liu D,Liang L,Regenstein J M,et al. Extraction and characterisation of pepsin-solubilised collagen from fins,scales,skins,bones and swim bladders of bighead carp(Hypophthalmichthysnobilis)[J]. Food Chemistry,2012,133(4):1441-1448.
[5]Li J R,Lu H X,Zhu J L,et al. Aquatic products processing industry in China:Challenges and outlook[J]. Trends Food Science & Technology,2009,20(2):73-77.
[6]赵敏. 鲢鱼鳞营养成分分析及营养学评价[J]. 安徽农业科学,2012,40(28):14002-14004.
[7]钱曼. 鱼鳞胶原蛋白的提取及胶原海绵的制备研究[D]. 武汉:华中农业大学,2008.
[8]Kimura S,Miyauchi Y,Uchida N. Scale and bone type I collagens of carp(Cyprinus carpio)[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1991,99(2):473-476.
[9]鸿巢章二,桥本周久. 水产利用化学[M]. 北京:中国农业出版社,1994.
[10]傅燕凤,沈月新,杨承刚,等. 淡水鱼鱼皮胶原蛋白的提取[J]. 上海水产大学学报,2004,13(2):146-151.
[11]Puwastien P,Judprasong K,Kettwan E,et al. Proximate composition of raw and cooked Thai freshwater and marine fish[J]. Journal of Food Composition and Analysis,1999,12(1):9-16.
[12]张延华,马国红,宋理平,等. 4种鱼肉的基本成分及胶原蛋白含量分析[J]. 农学学报,2014,4(9):79-81.
[13]刘永峰,刘毅,张振兴,等. 鱼胶原蛋白提取方法研究进展[J]. 食品工业,2013,34(12):206-210.
[15]黄雯,周秋淑,袁春红,等. 响应面法优化斑点叉尾鮰鱼皮胶原蛋白的热水法提取工艺[J]. 湖北农业科学,2016,55(1):157-162.
[16]林家福,谢福美,易美华,等. 热水提取罗非鱼鱼皮胶原蛋白的研究[J]. 中国热带医学,2008,8(8):1317-1319.
[17]Chen J,Li L,Yi R,et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia(Oreochromis niloticus)[J]. LWT-Food Science and Technology,2016,66:453-459.
[18]Caputo I,Lepretti M,Scarabino C,et al. An acetic acid-based extraction method to obtain high quality collagen from archeological bone remains[J]. Analytical Biochemistry,2012,421(1):92-96.
[19]Okazaki E,Osako K. Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J]. Food Chemistry,2014,149:264-270.
[20]Liu D,Wei G,Li T,et al. Effects of alkaline pretreatments and acid extraction conditions on the acid-soluble collagen from grass carp(Ctenopharyngodonidella)skin[J]. Food Chemistry,2015,172:836-843.
[21]Sato K,Yoshinaka R,Sato M,et al. Collagen content in the muscle og fishes in association with their swimming movement and meat texture[J]. Bulletin of Japanese Society of Scientific Fisheries,1986,52(9):1595-1600.
[22]Yoshimura K,Terashima M,Hozan D,et al. Preparation and dynamic viscoelasticity characterization of alkali-solubilized collagen from shark skin[J]. Journal of Agricultural and Food Chemistry,2000,48(3):685-690.
[23]Deyl Z,Mikšik I,Eckhardt A. Preparative procedures and purity assessment of collagen proteins[J]. Journal of Chromatography B,2003,790(1):245-275.
[24]Huang Y R,Shiau C Y,Chen H H,et al. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish(Diodonholocanthus)[J]. Food Hydrocolloids,2011,25(6):1507-1513.
[25]Singh P,Benjakul S,Maqsood S,et al. Isolation and characterisation of collagen extracted from the skin of striped catfish(Pangasianodonhypophthalmus)[J]. Food Chemistry,2011,124(1):97-105.
[26]Montero P,Borderf J. Characterization of hake(Merlucciousmerlucciusl)and flout(Salmoirideusgibb)collagen[J]. Journal of Agricultural and Food Chemistry,1990,38:604-609.
[27]Nishimoto M,Sakamoto R,Mizuta S,et al. Identification and characterization of molecular species of collagen in ordinary muscle and skin of the Japanese flounder Paralichthys olivaceus[J]. Food Chemistry,2005,90(1):151-156.
[28]Kielty C M,Grant M E. The collagen family:structure,assembly,and organization in the extracellular matrix[J]. Connective Tissue and Its Heritable Disorders:Molecular,Genetic,and Medical Aspects,Second Edition,2003:159-221.
[29]Zhang Y,Liu W,Li G,et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodonidella)[J]. Food Chemistry,2007,103(3):906-912.
[31]Takahashi M,Moriguchi S,Ikeno M,et al. Studies on the ileum-contracting mechanisms and identification as a complement C3a receptor agonist of oryzatensin,a bioactive peptide derived from rice albumin[J]. Peptides,1996,17(1):5-12.
[32]Huang C Y,Wu C H,Yang J I,et al. Evaluation of iron-binding activity of collagen peptides prepared from the scales of four cultivated fishes in Taiwan[J]. Journal of Food and Drug Analysis,2015,23(4):671-678.
[33]Kamalov M,Harris P W R,Wood J M,et al. On resin synthesis and cross-linking of collagen peptides containing the advanced glycation end-product pyrraline via Maillard condensation[J]. Chemical Communications,2015,51(46):9475-9478.
[34]Li B,Chen F,Wang X,et al. Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry,2007,102(4):1135-1143.
[35]Mendis E,Rajapakse N,Byun H G,et al. Investigation of jumbo squid(Dosidicusgigas)skin gelatin peptides for theirinvitroantioxidant effects[J]. Life Sciences,2005,77(17):2166-2178.
[36]Wu X,Cai L,Zhang Y,et al. Compositions and antioxidant properties of protein hydrolysates from the skins of four carp species[J]. International Journal of Food Science & Technology,2015,50(12):2589-2597.
[37]Kim S K,Kim Y T,Byun H G,et al. Purification and characterization of antioxidative peptides from bovine skin[J]. Journal of Biochemistry and Molecular Biology,2001,34(3):219-224.
[38]Je J Y,Qian Z J,Byun H G,et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry,2007,42(5):840-846.
[39]Alemán A,Giménez B,Pérez-Santin E,et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry,2011,125(2):334-341.
[40]Fahmi A,Morimura S,Guo H C,et al. Production of angiotensin I converting enzyme inhibitory peptides from sea bream scales[J]. Process Biochemistry,2004,39(10):1195-1200.
[41]Fujita H,Yoshikawa M. LKPNM:a prodrug-type ACE-inhibitory peptide derived from fish protein[J]. Immunopharmacology,1999,44(1-2):123-127.
[42]Wu H,He H L,Chen X L,et al. Purification and identification of novel angiotensin-I-converting enzyme inhibitory peptides from shark meat hydrolysate[J]. Process Biochemistry,2008,43(4):457-461.
[43]Matsufuji H,Matsui T,Seki E,et al. Angiotensin I-converting enzyme inhibitory peptides in an alkaline protease hydrolyzate derived from sardine muscle[J]. Bioscience,Biotechnology,and Biochemistry,1994,58(12):2244-2245.
[44]Byun H G,Kim S K. Purification and characterization of angiotensin I converting enzyme(ACE)inhibitory peptides from Alaska pollack(Theragra chalcogramma)skin[J]. Process Biochemistry,2001,36(12):1155-1162.
[45]Hulmes D J S,Miller A,Parry D A D,et al. Analysis of the primary structure of collagen for the origins of molecular packing[J]. Journal of Molecular Biology,1973,79(1):137-148.
[46]Lee J K,Jeon J K,Byun H G. Effect of angiotensin I converting enzyme inhibitory peptide purified from skate skin hydrolysate[J]. Food Chemistry,2011,125(2):495-499.
[47]Himaya S W A,Ngo D H,Ryu B M,et al. An active peptide purified from gastrointestinal enzyme hydrolysate of Pacific cod skin gelatin attenuates angiotensin-1 converting enzyme(ACE)activity and cellular oxidative stress[J]. Food Chemistry,2012,132(4):1872-1882.
[48]Deng C,Tang L H,Chen W. Effects of collagen peptide from Cyanea nozakii on mouse immune function[J]. Agricultural Science and Technology,2009,10(2):118-121.
[49]Kato S,Matsui H,Saitoh Y,et al. Fish collagen-containing drink is subcutaneously absorbed and attenuates the UVA-induced tissue-integrity destruction and DNA damages in 3D-human skin tissue model[J]. Journal of Functional Foods,2011,3(1):50-55.
[50]Saito M,Kiyose C,Higuchi T,et al. Effect of collagen hydrolysates from salmon and trout skins on the lipid profile in rats[J]. Journal of Agricultural and Food Chemistry,2009,57(21):10477-10482.
[51]Okawa T,Yamaguchi Y,Takada S,et al. Oral administration of collagen tripeptide improves dryness and pruritus in the acetone-induced dry skin model[J]. Journal of Dermatological Science,2012,66(2):136-143.
[52]Ikoma T,Kobayashi H,Tanaka J,et al. Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J]. International Journal of Biological Macromolecules,2003,32(3):199-204.
Research progress of fish collagen and functional polypeptides from fish collagen
CAI Lu-yun1,2,MA Shuai1,CAO Ai-ling3,LI Xiu-xia1,LV Yan-fang1, YU Zhi-peng1,DENG Shang-gui4,LI Jian-rong1,2,*
(1.College of Food Science and Engineering of Bohai University,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Lab of Liaoning Province,Jinzhou 121013,China; 2.College of Food Science,Southwest University,Chongqing 400715,China; 3.Xiaoshan Entry-Exit Inspection and Quarantine Bureau,Hangzhou 311208,China; 4.Zhejiang Ocean University,Food and Medicine College,Zhoushan 316022,China)
In order to solve the problem of low comprehensive utilization of fish processing wastes and improve the economic additional value of fish processing wastes,this article provided a brief introduction of the extraction methods of the functional polypeptides from fish collagen,the new study progress of functional polypeptides from fish collagen,and analyzed the existing problems of functional polypeptides from fish collagen. Additionally,the application prospects of functional polypeptides from fish collagen were proposed.
fish-derived;collagen;functional polypeptides
2016-03-30
蔡路昀(1981-),男,博士,副教授,主要从事水产品加工方面的研究,E-mail:clyun2007@163.com。
*通讯作者:励建荣(1964-),男,博士,教授,主要从事水产品和果蔬贮藏加工、食品安全方面的研究,E-mail:li34008@126.com。
国家自然科学基金(31401478,31471639);中国博士后基金面上项目(2015M570760);“十二五”国家科技支撑计划(2012BAD29B06);辽宁省科技攻关项目(2015103020);重庆市博士后特别资助项目(Xm2015021)。
TS254.9
A
1002-0306(2016)22-0384-06
10.13386/j.issn1002-0306.2016.22.066

