两种鼠血清与两种培养基对PK15细胞培养的比较
肖兵南,高中文,李剑锋,蒋小文
(1湖南民康生物技术研究所,湖南长沙410022;2.湖南省宁乡县畜产品检测中心,湖南宁乡410600)
两种鼠血清与两种培养基对PK15细胞培养的比较
肖兵南1,高中文1,李剑锋2,蒋小文1
(1湖南民康生物技术研究所,湖南长沙410022;2.湖南省宁乡县畜产品检测中心,湖南宁乡410600)
为比较研究DMEM培养基和RPM I-1640培养基对PK15细胞的培养效果,选择效果好的作为基础培养基,用大鼠血清和小鼠血清分别以不同量添加进行培养,用细胞显微病变(CPE)观察法和四甲基偶氮唑盐(MTT)测定法测定其对细胞生长的影响,为血药试验选择试验动物提供依据。结果表明:DMEM培养基较RPM I-1640培养基对PK15细胞的培养效果好,加5%大鼠血清或2.5%小鼠血清配制DMEM培养基的培养,对PK15细胞的培养生长无副作用,即两种血清的无毒安全浓度分别为5%和2.5%。
鼠血清;培养基;DMEM;RPM I-1640;PK15细胞;培养
用含药血清进行体外试验时,经常会遇到选择何种试验动物的问题,原则上首先要使体外培养细胞在该种动物血清中生长良好、形态正常,对照组血清质量稳定,并且血清添加量能够比较高[1]。猪肾上皮细胞PK15,来源于猪肾,正常的细胞形态为上皮样,贴壁生长。PK15细胞对多种病毒比较敏感,如猪圆环病毒(PCV)、猪细小病毒(PPV)、猪瘟病毒(CSFV)等,可应用于猪圆环病毒疫苗、猪细小病毒疫苗、猪瘟病毒疫苗等的制备,在科研中被广泛使用,其优点是它的遗传稳定,营养要求较低,可使用多种培养基,易培养、易保存[2,3]。为此,本试验选用无血清培养基DMEM和RPMI-1640对PK15细胞作比较培养试验,筛选出效果好的作基础培养基,再添加大鼠和小鼠两种常用试验动物的血清,配制不同浓度的鼠血清培养基对PK15进行培养试验,测定其对PK15细胞生长的影响,为血药试验选择试验动物提供依据。
1 材料与方法
1.1 试验材料
猪传代肾细胞PK15(湖南农大动医院提供);0.25%胰蛋白酶、RPMI-1640细胞培养基、DMEM细胞培养基、犊牛血清均为GIBCO公司生产;青霉素-链霉素,两性霉素,PBS缓冲液,均为细胞培养用。
1.2 主要试验仪器
10L-CO2培养箱(长沙市长锦科技有限公司);倒置显微镜(日本OLYMPUS公司);纯水仪(艾柯试验设备有限公司);低速离心机(XYJ-801型,江苏医疗仪器厂);塑料培养瓶、培养板、冻存管(美国COSTAR公司产品);25mm滤器和0.22μm的微孔滤膜(上海兴亚医用净化器材厂)。
1.3 试验试剂配制方法
1.3.1 细胞生长液(培养液):在DMEM/RPMI-1640培养液中加入10%的小牛血清和1mL双抗,4℃保存;
1.3.2 细胞维持液(营养液):在DMEM/RPMI-1640培养液中加入2%的小牛血清,4℃保存;
1.3.3 大鼠血清和小鼠血清:由湖南斯莱克景达试验动物有限公司提供,56℃灭活30min,0.22μm微孔滤膜过滤灭菌分装-20℃保存;
1.4 两种培养基对PK15细胞培养的比较[4]
1.4.1 细胞复苏培养:取细胞冻存管置37℃水浴摇动解冻,用移液枪吸入2个培养瓶中,加入适量DMEM细胞生长液,于37℃、5%CO2培养;4 h后细胞贴壁,换新的培养液至单层细胞形成。
1.4.2 接种与培养:复苏细胞长成单层时,及时取出,在无菌条件下小心吸出旧培养液,用37℃预热的PBS清洗(冲洗)后,加入适量预热的胰蛋白酶消化液1mL消化3~5min,倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不再连接成片,90%细胞脱落,为消化适度。然后离心弃去胰蛋白酶液,加入DMEM细胞营养液10mL,用吸管轻轻吹打数十次,打散细胞,取少量均匀细胞悬液镜下观察,用白细胞计数板进行细胞计数。将细胞悬液平均分为2份,分别离心,再加入不同的培养液,混合均匀后接种6孔板上,每孔加入悬液1mL(细胞数量为6.2×104)。将细胞板置37℃、5%CO2培养箱培养。1.4.3试验分组:试验I组:RPMI-1640培养液;试验Ⅱ组:DMEM培养液;每组设6个重复。
1.4.4 细胞观察计数:观察细胞生长情形,并分别于培养后10 h、15 h、20 h、25 h、30 h用胰酶消化5~7 min,加入1mL营养液,快速吹打分散,用白细胞计数板计数。
1.5 两种鼠血清对PK15细胞生存影响的测定
1.5.1 血清处理:取灭活大鼠血清和小鼠血清,用维持液倍比稀释稀释成不同的浓度:80%、40%、20%、10%、5%、2.5%、1.25%、0.625%,置37℃预热备用。
1.5.2 鼠血清对PK15细胞的培养:按1.4方法用96孔板以DMEM培养液培养PK15细胞约24 h至单层贴壁后,弃去上清液;从高浓度到低浓度分别加入含不同稀释度鼠血清的DMEM培养液,每孔100 μL,每个浓度重复8孔,设10%犊牛血清培养液作对照,37℃,5%CO2培养48 h。
1.5.3 鼠血清对细胞生存影响的测定
(1)细胞毒性作用的测定:对含鼠血清培养细胞,定时于倒置显微镜下观察细胞病变率(CPE)并记录结果,以最后的记录结果为最终结果。
(2)细胞增殖作用的测定:细胞培养48 h后,弃去上清液,用预热至37℃的PBS溶液漂洗2次;每孔加入10μL的MTT(5mg/mL溶于PBS),37℃继续培养4 h后,加入DMSO 100μL,在微量振荡器上振荡10min,以溶解细胞中的紫色结晶物;然后在酶标仪570 nm处测定光吸收值,计算活细胞率:活细胞率(%)=(加鼠血清孔OD值/犊牛血清对照孔OD值)×100%
1.6 数据统计处理
用Exce1和Spss11.5对数据进行分析,各组数据均以x±SD表示,并用Spss11.5软件的ANOVA进行单因素方差分析。
2 结果与分析
2.1 两种培养液对PK15细胞生长的影响
培养结果显示:DMEM培养液培养明显优于RPMI-1640培养液,细胞密度大,生长快,长势好。统计分析计算二者差异显著(P<0.05),结果见表1。
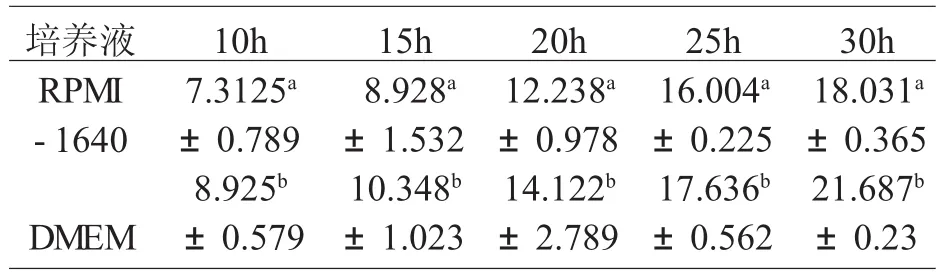
表1 不同培养基对p k-1 5生长的影响(×1 0 4)(x±s,n=6)
2.2 两种鼠血清对PK15细胞生存的影响
2.2.1 细胞病变率(CPE)测定:PK15细胞用含不同浓度大鼠血清和小鼠血清的DMEM培养液分别进行培养(48h),镜检显示:大鼠血清和小鼠血清对PK15细胞均呈现一定的毒副作用,高浓度时导致细胞病变:细胞圆缩、堆积、脱落。这种病变随着血清浓度的降低而下降,至含2.5%小鼠血清和5%大鼠血清时无CPE出现(见表2),由表2可见,2.5%小鼠血清和5%大鼠血清为最大的无毒浓度。

表2 不同浓度鼠血清导致的CPE情况(4 8 h)
2.2.2 细胞生长存活率测定:用MTT法测定OD值,计算细胞生长存活率(与犊牛血清比较),结果见表3:高浓度时大鼠血清对PK15细胞的副作用较小鼠血清小,同浓度血清活细胞多;低浓度时,大鼠血清5%及其以下保持细胞生长增殖,小鼠血清2.5%及其以下保持细胞生长增殖。

表3 不同浓度鼠血清作用P K 1 5细胞的生存率
3 结论与讨论
3.1 DMEM和RPMI-1640培养液对PK15细胞的比较培养,从细胞生长速度、细胞密度等生长情况显示,DMEM培养液比RPMI-1640培养液更适合PK15细胞的生长,与付世新2004年的报道[5]相似。
3.2 小鼠和大鼠血清对PK15细胞的最大无毒分别为2.5%和5%。这一结果与赵秀梅等报道的用异种动物血清对培养人肿瘤细胞生长的影响[6]结果相似。
3.3 吴健宇等用MTT法检测不同种属的动物血清和人血清对3T3细胞增殖的影响,结果显示不同种属动物血清对细胞的毒性作用与其种属亲源有关[7]。所以,在选择含药血清的供体动物时,应尽量选择与培养细胞亲缘关系较近者。本试验在某种意义上支持这一结论。
[1]汪鸿宇,俞仲毅,符胜光,等.血清药理实验中不同动物种属血清对脾脏淋巴细胞的影响[J].中国中医药科技,2001,(3): 185-186.
[2]陈丹英,高云飞,李丽霞,等.PK15细胞凋亡过程中角蛋白中间纤维的变化[J].动物学报,2002,48(1):58-63.
[3]董关木,郑海发,刘发顺,等.精致Vero细胞狂犬病疫苗的临床观察及免疫学效果的研究[J].中华试验和临床病毒学杂志,2000,14(1):356-359.
[4]于丽华,崔洪新.不同种类血清对新生大鼠大脑皮层神经细胞培养的影响[J].实用医药杂志,2002,(3):
[5]付世新,李晓龙,王长远,等.不同培养基对PK15细胞增殖影响的研究[J].黑龙江八一农垦大学学报,2004,(1):62-64.
[6]赵秀梅,冯文茹,胡人杰.异种动物血清对体外培养人肿瘤细胞生长的影响[J].中国比较医学杂志,2010,(6):190-192.
[7]吴健宇,穆静,李仪奎.血清药理试验中异种动物血清对细胞的毒性作用和灭活后的减毒作用[J].中国药理学通报,2000,16(1):118-119.
Q253
A
1006-4907(2016)02-0044-03
10.3969/j.issn.1006-4907.2016.02.021
2015-12-23

