PRV定量PCR检测方法的建立及其在猪精液检测中的初步应用
聂 昂,王婕敏,张居作,蔡文杰,袁安文※,薛立群※
(1.湖南农业大学动物医学院,湖南长沙410128;2.湖南省畜牧兽医研究所,湖南长沙410131)
PRV定量PCR检测方法的建立及其在猪精液检测中的初步应用
聂 昂1,王婕敏1,张居作1,蔡文杰2,袁安文1※,薛立群1※
(1.湖南农业大学动物医学院,湖南长沙410128;2.湖南省畜牧兽医研究所,湖南长沙410131)
文章根据PRV基因序列,设计特异性引物扩增gH基因,构建重组质粒;优化实验条件,建立PRV SYBR Green I荧光定量PCR检测方法。结果表明该方法的标准曲线线性关系良好,R 2=0.998,E=103.854%;特异性强,检测猪细小病毒、猪繁殖与呼吸综合征病毒、猪圆环2型病毒、猪乙脑病毒和猪瘟兔化弱毒疫苗等均无扩增曲线;灵敏度高,最低可检测到的27.9拷贝;在公猪精液中最低可检测到病毒量为16TCID50/100μL,可重复验证,变异系数均低于3.5%;利用该方法对湖南省109份公猪精液样品进行了检测,发现20份阳性样品,阳性率为18.35%,比国标普通PCR法检出率高。该方法的建立将为PRV的流行病学调查提供可靠的技术支持。
PRV;荧光定量PCR;公猪精液;流行病学
猪伪狂犬病病毒(Pseudorabies virus,PRV)又称猪疱疹病毒Ⅰ型,是危害养猪业的主要病原之一,主要引起仔猪死亡,母猪繁殖障碍(早产,流产,死胎,木乃伊胎);而成年猪多为潜伏感染[1]。猪伪狂犬病毒可以在猪群中水平传播,也能够通过公猪精液垂直传播[2,3]。随着人工授精技术在养猪业的推广使用,病毒在猪群中的广泛传播的风险增加。为了掌握公猪精液中携带伪狂犬病毒的情况,有必要建立一种能够在公猪精液中检测出猪伪狂犬病毒的方法。荧光定量PCR技术是在普通PCR技术上发展起来的一种新的检测技术。具有操作简单快速、重复性好、特异性强、灵敏度高,可以准确定量检测,能够有效检出早期感染和潜伏感染病毒的特点,现已在动物疫病检测上广泛应用[4]。
1 材料与方法
1.1 材料
1.1.1 病毒和疫苗
猪伪狂犬病毒(PRV)分离株和猪细小病毒(PPV)分离株由湖南农业大学动物医学院临床分子实验室保存;猪圆环病毒2型(PCV2)毒株由湖南农业大学动物医学院功能蛋白组学实验中心馈赠,猪繁殖与呼吸综合征病毒(PRRSV),猪瘟病毒(CSFV)和猪乙型脑炎病毒(JEV)均为疫苗株。
1.1.2 主要试剂和仪器
1.1.3 公猪精液样品
公猪精液样品于2015年~2016年间采自湖南省内15个猪场和人工授精站的公猪精液样品共计109份,其中包括8个散养户猪场的34份精液;5个规模化猪场的68份精液;2个人工授精站的7份精液。
1.2 方法
1.2.1 引物的设计
比对GenBank中的多株PRV病毒gH基因序列,选取保守序列,参照PRV毒株(GenBank:NC_006151. 1)的gH基因,应用PrimerPremier5.0生物软件设计了上游引物(PRV-F)和下游引物(PRV-R)由北京六合华大基因科技股份有限公司合成。
1.2.2 标准品的制备
运用PRV-F和PRV-R引物对提取的PRV DNA模板进行PCR扩增,反应程序为:94℃3min;94℃15s,62℃15s,72℃20s,35个循环;72℃10min。PCR产物1.5%琼脂糖凝胶电泳,切胶回收纯化目的基因片段,与pMD-18T载体连接构建重组质粒,转化进感受态细菌中,经过蓝白斑筛选,确定阳性菌落,大量培养,提取阳性重组质粒。对阳性重组质粒进行PCR验证和Eco I和HindⅢ双酶切验证,对验证正确的阳性重组质粒进行测序鉴定。用Nanodrop2000核酸分析仪对测序正确的重组质粒进行浓度测定,计算拷贝数。
1.2.3 PRV SYBRGreen I荧光定量PCR标准曲线的建立
将PRV重组质粒标准品进行10倍倍比系列稀释,选取各稀释梯度重组质粒作模板进行荧光定量PCR反应;其20μL体系为:SYBR Premix ExTaq (2×)20μL;PRV-F(20μM)和PRV-R(20μM)各0.2μL;ROX Reference Dye(50×)0.4μL;DNA模板2μL;ddH2O 7.2μL。反应程序为:95℃1min;95℃5s,62℃30s,共40个循环。溶解曲线反应程序为:95℃15s,60℃1min,95℃15s。进行数据分析,确定标准曲线。
1.2.4 PRVSYBRGreen I荧光定量PCR的特异性实验
用PCV2、PRV、PPV的DNA,PRRSV、CSFV及JEV的cDNA作为模板,同时设立空白对照,每个样品3个复孔,用建立的PRV SYBRGreen I荧光定量PCR方法进行检测。用以检测其特异性。
1.2.5 PRVSYBRGreen I荧光定量PCR的敏感性实验
将已测浓度的PRV阳性重组质粒进行10倍梯度系列稀释,用所建立的荧光定量PCR方法进行检测,得出所构建方法的重组质粒模板的最低检出拷贝数。同时选取PRV病毒液(105.405TCID50/100μL)经PBS 5倍梯度系列稀释,将各稀释度PRV病毒液混入阴性公猪精液中,提取DNA作模板,进行荧光定量PCR检测,测定该方法在精液中的最低检出病毒量。同时进行国标(GB/T 18641-2002)常规PCR[5]检测,对比两种方法的灵敏度。
1.2.6 PRVSYBRGreen I荧光定量PCR的重复性实验
选取浓度为2.79×106copies/μL、2.79×105copies/μL、2.79×104copies/μL的阳性重组质粒稀释品和选取混入PRV病毒50819 TCID50/100μ L、407 TCID50/100μL、16 TCID50/100μL的精液样品,用建立的PRV SYBRGreen I rea1-time PCR进行3次批内重复试验和3次批间重复试验,实验结束后对扩增曲线及Ct值进行分析。
1.2.7 临床样品检测
对湖南省内15个猪场和人工授精站采集的109份公猪精液样品,应用构建的PRV SYBRGreen Irea1-time PCR方法进行检测,同时根据国家标准GB/T 18641-2002中的检测方法[5]进行常规PCR检测,对比检测结果。
2 结果
2.1 PRV阳性标准品的制备
运用设计的引物经梯度PCR扩增和1.0%琼脂糖凝胶电泳检测,结果如图1所示,扩增出与预期大小相符的片段(146 bp),最佳退火温度为62℃。构建的PRV重组质粒送华大测序,测序结果与参考序列进行比对,同源性为100%。用Nanodrop2000核酸分析仪测得PRV重组质粒浓度为86.7ng/μL,计算得出拷贝数为2.79×1010copies/μL。

(M:DL2000DNAMarker;1:52℃;2:54℃;3:56℃;4:58℃;5:60℃;6:62℃)图1 PRV目的基因PCR扩增结果
将制备的标准质粒10倍倍比稀释,选取2.79×1010copies/μL浓度的标准质粒做模板,进行荧光定量PCR反应,根据结果系统绘制出标准曲线,结果显示在2.79×106~2.79×101copies/μL浓度有良好的线性关系,得到的标准曲线较为理想(图2)。标准曲线的相关系数为:R2:0.998;E=103. 854%。PRV的拷贝数与Ct值之间的线性关系表达式为:Ct=-3.233×1gDNA拷贝数+19.696。进行溶解曲线分析发现溶解峰单一,溶解温度在88.8℃左右。
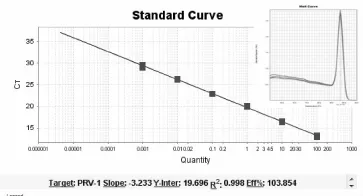
图2 FQ-PRV荧光定量PCR标准曲线

图3 FQ-PRV荧光定量特异性实验结果
2.2.2 特异性实验
特异性实验结果(图3)表明,PRV有特异性扩增,对照组PPV、PCV2、PRRSV、CSFV、JEV和阴性对照组均无特异性扩增。
2.2.3 敏感性实验
构建的PRV荧光定量PCR方法扩增2.79× 101copies/μL浓度重组质粒模板和在公猪精液中检测到16 TCID50/100μL仍然有S型曲线,低于该浓度不能检测出,表明最低可以检测到2.79×101拷贝数量级(图4)和在公猪精液中最低可以检测到16 TCID50/100μL(图5)。国标普通PCR法[5]检测结果显示在81 TCID50/100μL时仍可见单一明显条带,低于该浓度后出现杂带,结果不能准确判定,说明国标普通PCR法[5]最低可检测到81 TCID50/100μL的病毒含量(图6)。结果表明构建的荧光定量PCR法的灵敏度比国标普通PCR法灵敏度高5倍。
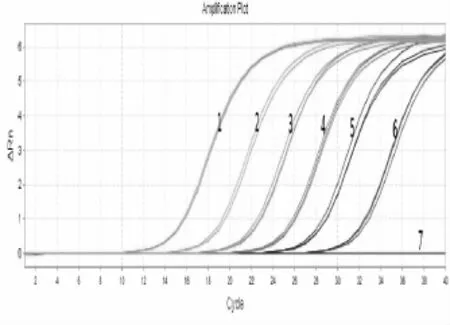
(1~6:2.79×106copies/μL~2.79×101 copies/μL;7.阴性对照)图4 FQ-PRV敏感性实验结果

(1.50819TCID50/100μL;2.10164TCID50/100μL;3.2033TCID50/100μL; 4.407TCID50/100μL;5.81TCID50/100μL;6.16 TCID50/100μL;7.3.3 TCID50/100μL;8.阴性对照)图5 FQ-PCR检测公猪精液中PRV敏感性实验结果
2.2.4 PRV重复性实验
3次批内重复实验和3次批间重复实验结果表明:在重组质粒检测中其批内实验变异系数为0.10%~0.77%,批间实验变异系数为1.88%~2.48%;在带毒精液中批内实验变异系数为0.17%~0.50%,批间实验变异系数为0.50%~3.46%。表明该方法有较高的重复性,保证了检测结果的稳定性与可靠性。

(1.50819TCID50/100μL;2.10164TCID50/100μL;3.2033TCID50/100μL;4. 407 TCID50/100μL;5.81 TCID50/100μL;6.16 TCID50/100μL;7.3.3 TCID50/100μL;8.0.66 TCID50/100μL;+:阳性对照;-:阴性对照;M. DL2000DNAM arker)图6 PCR检测公猪精液中PRV敏感性实验
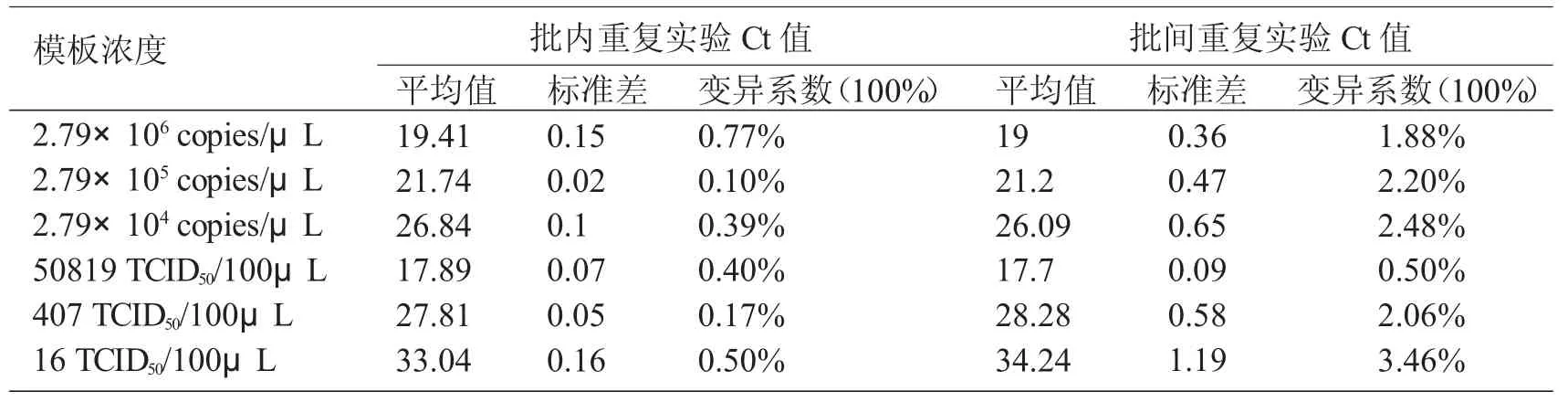
表1 荧光定量PCR的重复性试验
2.3 临床样品检测结果
采集的109份临床精液样品进行荧光定量PCR和国标GB/T 18641-2002普通PCR法[5]检测。结果表明,国标普通PCR检测出15份阳性样品,检出率13.76%;构建的PRV SYBR Green I rea1-time PCR方法检出20份阳性样品,阳性率18.35%。说明构建的PRV荧光定量PCR方法比国标普通PCR法灵敏度高。
3 讨论
gH基因是伪狂犬病毒复制的必须基因,较为保守[6]。本实验对多株伪狂犬病毒毒株进行了同源性比较,选取gH基因的保守性序列,应用Primer Premier5.0生物软件设计了1对特异性引物。构建的SYBRGreen Irea1-time PCR方法标准曲线线性关系良好,R2=0.998,E=103.854%;特异性强,溶解曲线峰值单一,检测猪细小病毒、猪繁殖与呼吸综合征病毒、猪圆环2型病毒、猪乙脑病毒和猪瘟兔化弱毒疫苗等均无扩增曲线;灵敏度高,最低可检测到的27.9拷贝的阳性质粒,在公猪精液中最低可检测到的病毒量为16TCID50/100μL,灵敏度与杨红杰等[7]和李雪明等[8]建立的PRV SYBRGreen I荧光定量PCR方法的检测灵敏度(86拷贝/μL和69拷贝/μL)相当;重复性检测结果良好,批内和批间实验的变异系数均低于3.5%。
PCR技术已被用于检测精液中猪伪狂犬病毒。2006年4月~10月间孙泉云等对上海及其周边地区30个猪场和人工授精站的355份精液进行了检测,结果表明,PRV阳性率为2.54%,且存在PRV和PPV混合感染[9];黄夏等应用PCR技术对广西6市12个种猪场441份精液进行检测发现,PRV精液样品阳性率为0.45%[10]。2006年黄夏等应用PCR技术对广西11个种猪场235份精液进行检测,PRV阳性率为5.53%[11],并且发现PRV和PPV、PCV2混合感染严重。2009年冯迎春等对四川各地区猪场76份精液进行了检测,检测结果表明PRV带毒率较高为19.7%[12]。王军一等对2007~2009年山东部分地区727份精液样品进行5种主要病原检测,结果显示PRV阳性率为0.96%[13]。雷湘兰等于2010年~2012年对海南省部分种猪的精液进行调查发现PRV感染率为4.80%[14]。本研究运用构建的荧光定量PCR方法和国标普通PCR法[5]对109份精液样品进行检测,结果发现构建的荧光定量PCR方法检出20份阳性样品,阳性率18.35%。而国标普通PCR法检出15份阳性样品,阳性率为13.76%。结果表明构建的荧光定量PCR检出率比普通PCR要高,有利于种公猪精液中PRV在潜伏感染期和早期感染的检出。
人工授精技术的广泛应用为PRV通过种猪精液传播提供了可能。因此,加强种公猪精液病原生物的监测对于控制疫病的传播有重要意义。本研究构建的PRV SYBRGreen Irea1-time PCR方法具有稳定性强、灵敏度高、特异性好等特点,为检测种公猪精液中PRV感染情况提供了有效的检测手段,有较高的应用价值。
[1]罗满林.动物传染病学[M].北京:中国林业出版社,2013: 78-82.
[2]VAN RIJN P A,WELLENBERG G J,HAKZE-VAN DER HONING R,et al.Detection of economically important viruses in boar semen by quantitative RealTime PCRTMtechnology[J].J. Virol.Methods,2004,120(2):151-160.
[3]GUéRIN B,POZZIN.Viruses in boar semen:detection and clinical aswell as epidemiological consequences regarding disease transmission by artificial insemination[J].Theriogenology. 2005,63(2):556-572.
[4]杨丽莎,薛立群.荧光定量PCR检测技术及其在猪病诊断中的应用[J].湖南畜牧兽医,2014,(2):1-4.
[5]GB/T 18641-2002伪狂犬病诊断技术[S].北京:中国标准出版社,2002.
[6]PEETERSB,DEWIND N,BROER R,et al.Glycoprotein H of pseudorabies virus is essential for entry and cell-to-cell spread of the virus[J].JVirol,1992,66(6):3888-3892.
[7]杨红杰,于长青,林树伯,等.伪狂犬病病毒gB基因荧光定量PCR检测方法的建立[J].北京农学院学报,2015,(3):48-51.
[8]李雪明,于红欣,杨红杰,等.伪狂犬病病毒gE基因荧光定量PCR检测方法的建立[J].北京农学院学报,2015,(4):74-77.
[9]孙泉云,周锦萍,张维谊,等.种公猪精液中与繁殖障碍有关的6种病毒的检测[J].动物医学进展,2007,(11):30-33.
[10]黄夏,陈义祥,覃芳芸,等.公猪精液CSFV、PRRSV、PCV-2、PRV和PPV的PCR检测[J].广西农业科学,2008,(2): 236-239.
[11]黄夏,陈义祥,磨龙春,等.应用PCR方法对广西公猪精液的伪狂犬病、圆环病毒2型和细小病毒混合感染情况的检测[J].广东畜牧兽医科技,2008,(1):41-43.
[12]冯迎春,黄攀,颜其贵.四川省部分猪场公猪精液带毒情况的PCR和RT-PCR检测[J].养猪,2010,(5):71-72.
[13]王军一,金扩世,徐敬龙.山东种公猪精液携带主要病原的检测[J].动物医学进展,2012,(8):108-111.
[14]雷湘兰,马乃祥,沈振国.海南种公猪精液中的病毒调查研究[J].养猪,2012,(4):40.
S852.65
A
1006-4907(2016)02-0031-05
10.3969/j.issn.1006-4907.2016.02.016
2016-03-01
聂昂(1991~),男,临床兽医硕士研究生。
※通讯作者:袁安文(1967~),男,教授,研究方向:动物生殖医学,yuananweng@163.com。
※通讯作者:薛立群(1955~),男,教授,研究方向:动物生殖医学,liqun_xue@aliyun.com。

