解淀粉芽孢杆菌GSBa-1凝乳酶的生产及其酶学性质研究
腾军伟,郑喆,梅雪洋,付琦洁,张健,杨贞耐
(北京工商大学,北京食品营养与人类健康高精尖创新中心/食品添加剂与配料北京高校工程研究中心, 北京,100048)
解淀粉芽孢杆菌GSBa-1凝乳酶的生产及其酶学性质研究
腾军伟,郑喆,梅雪洋,付琦洁,张健,杨贞耐*
(北京工商大学,北京食品营养与人类健康高精尖创新中心/食品添加剂与配料北京高校工程研究中心, 北京,100048)
采用正交试验设计优化了解淀粉芽孢杆菌GSBa-1发酵产凝乳酶的工艺条件:发酵温度35 ℃,装液量40%,摇床转速180 r/min,发酵时间84 h。在此优化条件下,获得的凝乳酶凝乳活力为558.14 Su/mL。进一步研究了该酶的酶学性质,凝乳酶最适反应温度为55 ℃,酶活力在25~45 ℃比较稳定,60 ℃保持50 min完全失活。在pH5.5时凝乳酶活力最高,在pH 5.5~7.0范围内,随着pH增大,凝乳酶活力逐渐下降,pH 6.5时,凝乳酶活力稳定性最高。Ca2+、Mg2+、Fe2+、Zn2+以及Al3+均对凝乳酶的凝乳活力有促进作用,其中Ca2+对凝乳活力的促进作用最为显著,且Ca2+浓度为0.020 mol/L时凝乳酶的凝乳活力达到最大值,而Na+、K+和Cu2+对凝乳活力均有抑制作用;凝乳酶Km为2.35 g/L,Vmax=1.18 U/mL。
解淀粉芽孢杆菌;凝乳酶;正交试验;酶学性质
凝乳酶是制作干酪时添加于原料乳中起凝乳作用的必需酶[1],其凝乳特性及蛋白水解活力会最终影响干酪的得率、风味和质构[2-4]。传统的凝乳酶来源于未断奶的牛犊皱胃。随着世界干酪产业的发展,传统凝乳酶的供应已出现世界性短缺。为此,国内外研究者进行了大量的研究以开发不同来源的凝乳酶。微生物生产凝乳酶具有周期短、产量高、提取方便、成本低、经济效益高等优点,是目前最有发展潜力的凝乳剂[5-7]。
宫廷奶酪是我国的一种传统乳酪产品,由江米酒凝固牛乳制作而成,口感细腻,具有良好的乳胶体稳定性。其制作过程中江米酒的凝乳作用主要与其中的凝乳酶有关[8-9];该酶是江米酒发酵剂酒曲中微生物发酵代谢的产物[10-11]。江米酒是一种传统安全食品,采用其中筛选得到的菌株进行发酵产凝乳酶,无须考虑非酶类代谢产物的安全性问题[12-13]。虽然细菌是酒曲中主要菌系组成之一,但国内尚无从酒曲中筛选高产凝乳酶细菌的相关报道。本实验研究前期从甜酒曲中筛选得到1株产凝乳酶细菌,经鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),菌株编号为GSBa-1。本文通过对解淀粉芽孢杆菌GSBa-1发酵产凝乳酶条件的优化,利用乙醇分级沉淀制取凝乳酶,并研究了不同因素对其酶学性质的影响,验证了该凝乳酶在干酪加工的潜在应用价值,为进一步研究开发食用安全的干酪加工用细菌凝乳酶奠定了基础。
1 材料与方法
1.1 材料与试剂
解淀粉芽孢杆菌GSBa-1菌株由本实验室分离纯化并于-70 ℃冷冻保藏。基础发酵培养基(LB):酵母提取物5 g/L,胰蛋白酶10 g/L,NaCl 10 g/L。脱脂乳粉,澳大利亚进口;酪蛋白,SIGMA公司;试验试剂均为分析纯;实验用水为去离子水。
1.2 仪器与设备
HWS 12恒温水浴加热锅,上海一恒科学实验装备有限公司;HZQ-Q 气浴恒温摇床,哈尔滨东联电子科技有限公司;高速离心机CR21GⅢ,日本日立有限公司;分光光度计U-3900,日本日立有限公司。
1.3 方法
1.3.1 正交试验设计
本试验利用正交试验设计4因素3水平(表1)共9个试验点的试验(表2),研究解淀粉芽孢杆菌GSBa-1发酵产凝乳酶的最佳条件。其中1、2、3分别代表自变量的低、中、高水平,测定每组实验得到的发酵液凝乳酶活力。
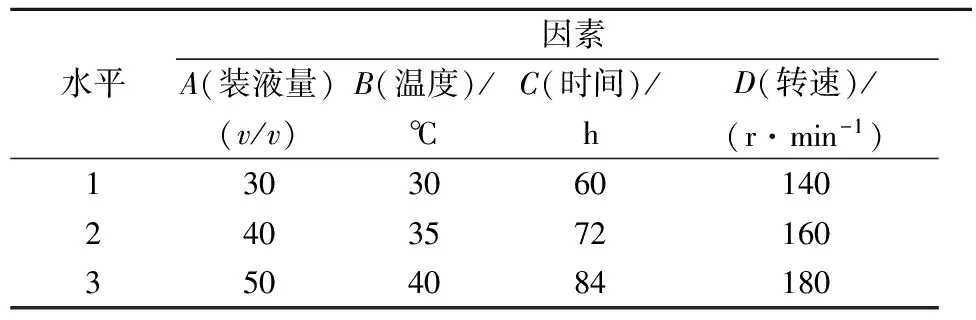
表1 正交实验设计因素水平表
1.3.2 菌株发酵实验
基础发酵LB液体培养基按不同装液量分装于100 mL三角瓶中,于121 ℃高压灭菌30 min,冷却至室温;把解淀粉芽孢杆菌GSBa-1甘油管种子(-70 ℃保存)室温下融化,按体积分数3%(v/v)接种到30 mL已灭菌的 LB液体培养基中,摇匀培养14 h作为活化种子液;种子液按体积分数3%(v/v)接种到LB液体发酵培养基中摇匀,根据正交试验设计因素(温度、时间、转速)于摇床中水平发酵。发酵完成后将发酵液于10 000 r/min离心30 min,取上清液,于4 ℃冰箱冷藏备用。
1.3.3 解淀粉芽孢杆菌GSBa-1凝乳酶的提取
向4 ℃的粗酶液中加入预冷的无水乙醇,使混合后的乙醇体积分数为60%,离心后取上清继续加入无水乙醇使乙醇体积分数为70%,迅速搅拌均匀,于4 ℃冰箱中静置过夜,10 000 r/min 离心30 min,离心温度4 ℃,收集沉淀,沉淀用0.005 mol/L的磷酸盐缓冲液溶解,用透析袋(8 000~14 000 Da)于4 ℃条件下透析48 h,之后冷冻干燥成凝乳酶冻干粉,于4 ℃冰箱冷藏备用。
1.3.4 凝乳酶活力(milk-clotting activity, MCA)的测定
活力测定根据改进的MAGDA[14]方法,将脱脂乳粉溶于0.01 mol/L的CaCI2溶液配制成10%的脱脂乳溶液,室温放置30 min;于35 ℃中保温5 min,35 ℃下,准确量取待测酶液0.2 mL加入2 mL 10%的脱脂乳溶液中,迅速混匀,开始计时,准确记录至絮状凝集颗粒出现为止。凝乳酶活力的定义:在40 min内凝固100 g/L的脱脂乳1 mL所要的凝乳酶量规定是1个索氏单位(Soxhelt unit,Su),计算公式见式(1):

(1)
式中:MCA为发酵液酶活力,Su/mL;T为凝乳时间,s; D为酶液稀释倍数。
式中:A为所测的凝乳酶活力,Su/mL;A0为对照的凝乳酶活力,Su/mL。
1.3.5 蛋白水解活力(proteolyticactivity,PA)测定方法[15]
取2mL1.5%酪蛋白溶液于35 ℃保温5min,加入0.5mL预热好的待测酶液混匀后继续水浴恒温放置60min,然后加入2mL8%的三氯乙酸终止反应,将沉淀过滤出去测定滤液在280nm处的吸光度A280。制备空白样品时,先取0.5mL待测酶液直接与8%的三氯乙酸混合,使其立刻终止反应,后加入2mL1.5%酪蛋白溶液,重复过滤步骤,滤液作为空白对照,测定其在280nm处的吸光度A280'。
本实验条件下,60min引起A280增加0.001单位所需的酶量为1个酶活力单位,计算公式见式(2):
1mL酶液的蛋白水解活力(U/mL)=2(A280-A280')
(2)
1.4 不同因素对凝乳酶的影响
1.4.1 温度对凝乳酶活力的影响
分别在25、30、35、40、45、50、55、60、65、70 ℃测定凝乳酶的凝乳活力和蛋白水解活力,重复3次。将55 ℃时测定的MCA和C/P值(即酶的凝乳活力与蛋白水解活力的比值)定义为100%,分别计不同温度条件下凝乳酶的相对酶活力和C/P值。
1.4.2 凝乳酶的热稳定性
将酶液分装于试管中,分别在25、30、35、40、45、50、55、60 ℃水浴中温育60min,在此期间,每隔10min取样,迅速冷却。在35 ℃条件下测定残余凝乳酶的活性,重复3次。将未处理酶液的酶活力定义为100%,分别计算不同温度条件下凝乳酶的相对酶活力。
1.4.3pH值对凝乳酶活力的影响
将酶液以及10%的脱脂乳用0.1mol/LHCI溶液和0.1mol/LNaOH溶液分别调pH值至5.0、5.5、6.0、6.5、7.0、7.5,分别测定凝乳酶凝乳活力和蛋白水解活力,重复3次。将pH5.5条件下测定的MCA和C/P值定义为100%,分别计算不同值条件下凝乳酶的相对酶活力和C/P值。
1.4.4 凝乳酶的pH稳定性
用0.1mol/LHCI溶液和0.1mol/LNaOH溶液将酶液的pH调到5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,在4 ℃下放置1h后,再用0.1mol/LHCl和0.1mol/LNaOH将酶液的pH值统一调至6.5,在35 ℃下测定凝乳酶的残余酶活,重复3次。将最高酶活力定义为100%,分别计算不同pH值条件下凝乳酶的相对酶活力。
1.4.5 金属离子对凝乳酶活力的影响
在脱脂乳和1.5%的酪蛋白中,分别添加NaCl、KCl、MgCl2、CaCl2、ZnCl2、CuCl2FeCl2、AlCl3,使其浓度为5mmol/L,在35 ℃条件下分别测定凝乳酶的凝乳活力和蛋白水解活力,设定以不添加金属离子的底物溶液(空白对照)测定的酶活力和C/P值为100%,分别计算不同条件下凝乳酶的相对酶活力和C/P值。
1.4.6Ca2+浓度对凝乳酶活力的影响
在脱脂乳中添加CaCl2,使其浓度分别为0.005、0.010、0.015、0.020、0.025、0.030、0.035、0.040、0.045、0.050mol/L,于35 ℃下测定凝乳酶的凝乳活力,重复3次。将最高酶活力定义为100%,分别计算不同条件下凝乳酶的相对酶活力。
1.4.7 酶动力学特性研究
1.4.7.1 酪蛋白底物浓度对凝乳酶活力的影响
分别配制0、2、4、6、8、10、12、14、16、18g/L的酪蛋白底物浓度,按照1.3.5蛋白酶活性测定方法,测得凝乳酶蛋白水解活性。
1.4.7.2 米氏常数和最大反应速率的测定
分别将不同酪蛋白底物浓度下测得的蛋白水解活力与底物浓度取倒数作图,求米氏常数Km和最大反应速率Vmax。
2 结果与分析
2.1 解淀粉芽孢杆菌GSBa-1凝乳酶的生产[16-18]
本研究采用4因素3水平的试验即选用L9(34)正交表来设计实验优化解淀粉芽孢杆菌GSBa-1发酵产凝乳酶条件。正交试验结果见表2。
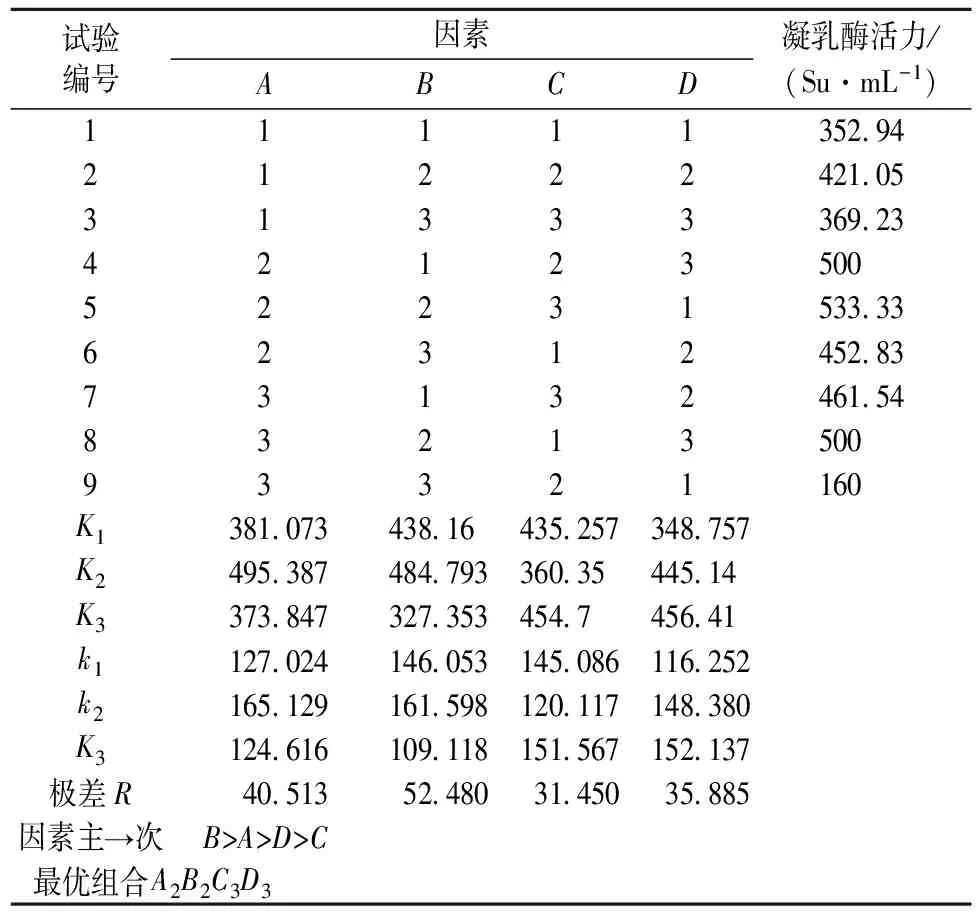
表2 正交实验优化设计及结果
由表2可知,4个因素对解淀粉芽孢杆菌GSBa-1发酵产凝乳酶凝乳活力的影响大小依次为温度>装液量>摇床转速>发酵时间。由k值大小可知各因素选取水平及最优组合为A2B2C3D3,即发酵温度35 ℃,装液量40%,摇床转速180 r/min,发酵时间84 h。根据最优组合条件,得到解淀粉芽孢杆菌GSBa-1发酵产凝乳酶凝乳活力为558.14 Su/mL,高于试验组5(试验组最高)的凝乳活力533.33 Su/mL,且结果重复性好。由此优化发酵条件下,采用乙醇分级沉淀制备获得的凝乳酶用于后续酶学性质的研究。
2.2 不同因素对解淀粉芽孢杆菌GSBa-1凝乳酶酶学性质的影响
2.2.1 温度对酶活力的影响
由图1可知,当温度低于25 ℃时,酶反应进行较慢,相对酶活力较低。在25~55 ℃,随着反应温度的上升,凝乳酶相对活力逐渐增大,当反应温度为55 ℃时凝乳酶相对活力达到最大值;当温度高于55 ℃时,相对酶活力下降明显,到65 ℃时凝乳酶完全失活。因此该酶的最适凝乳温度为55 ℃。韦薇等报道,小牛凝乳酶的最适反应温度为50 ℃[19]。从米黑毛霉菌中得到的凝乳酶的最适温度为60 ℃[20],高于该酶的最适温度。本实验条件下,温度对凝乳酶的C/P值影响与酶活力的影响趋势一致, 凝乳酶的C/P值也在55 ℃时达到最大。
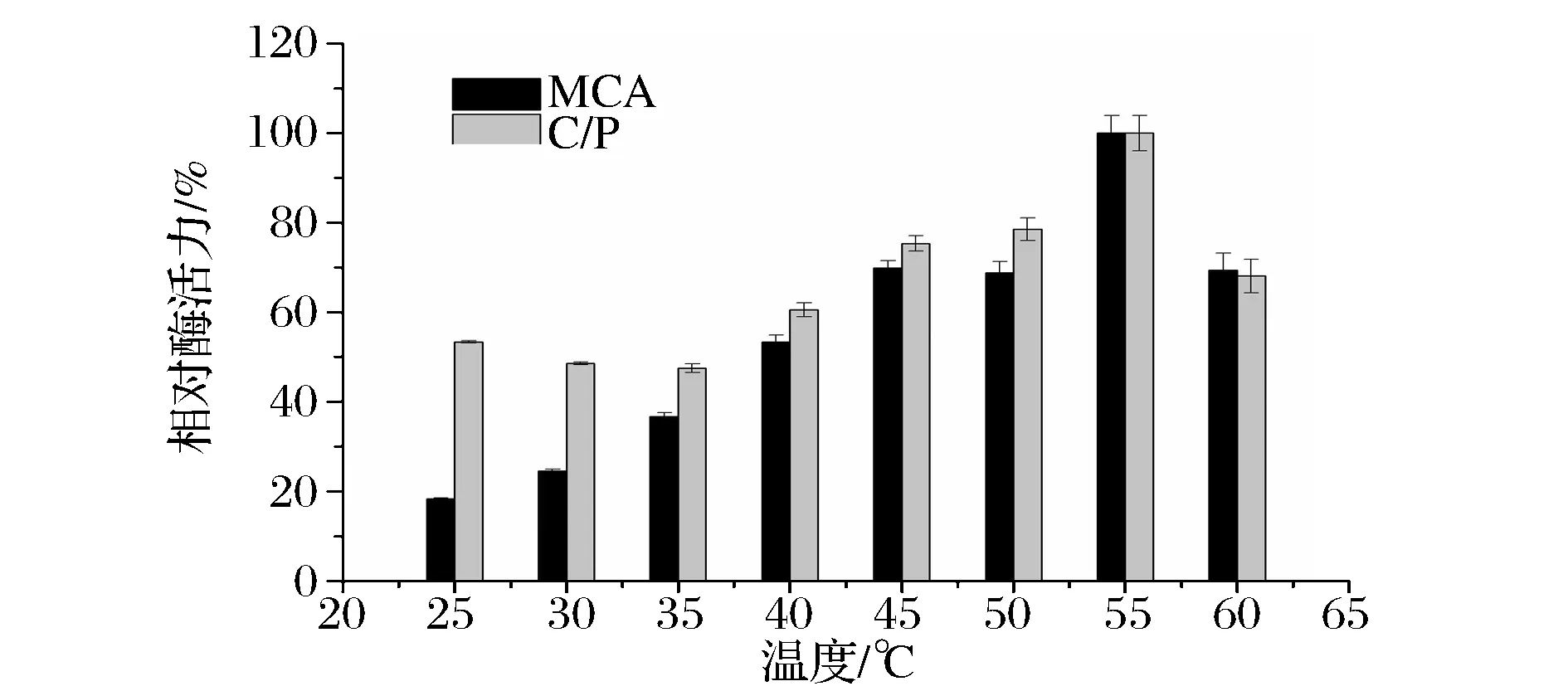
图1 温度对凝乳酶活力的影响Fig.1 Effect of temperature on the activity of the rennet from B. amyloliquefaciens GSBa-1
在实际干酪加工中,干酪的苦味和其他不良风味大多是由凝乳酶的蛋白水解力较强降解酪蛋白产生的苦味肽物质所致[8]。因此蛋白水解活力低的凝乳酶,即C/P比值高的酶更适用于干酪加工中良好风味的形成。
2.2.2 酶的热稳定性
由图2所示,凝乳酶在25~45 ℃有较好的热稳定性,此温度区间温育60 min后,均保持较高的相对酶活力。但继续升高温度,当达到50℃时保持40 min后,相对酶活力明显降低;当温度上升到55℃时,保持20 min后,相对酶活力持续性显著损失,60 min后残留的相对酶活力为40.77%;当温度为60 ℃保持20 min,残留的酶活只剩33.46%,保持50 min后酶活力完全丧失。韦薇等[19]报道的小牛凝乳酶 55 ℃保温90 min,相对酶活力为 36.7%;60 ℃保持60 min酶完全失活。KUMAR等[21]发现Rhizopusoryzae凝乳酶60 ℃保持20 min,相对酶活力仍为48%。说明该凝乳酶的热稳定性低于小牛和Rhizopusoryzae两种凝乳酶。由于在干酪加工时需经过凝乳酶的灭酶环节(大约50 ℃)[22],以减少残留的凝乳酶作用产生苦味肽物质,因此该凝乳酶在干酪制作时有一定优势。

图2 凝乳酶的热稳定性Fig.2 Thermal stability ofthe rennet from B. amyloliquefaciens GSBa-1
2.2.3 pH值对酶活力的影响
在实验条件下,当脱脂乳的pH调至5.0时,脱脂乳呈现出凝集状态,因而无法测定凝乳活力。从图3可以看出,凝乳酶在pH 5.5时,表现出最高的凝乳活力和C/P值;此后在pH为5.5~7.0之间,随着pH的增大,相对凝乳酶活力和相对C/P值逐渐减小,当pH 7.5时酶活力完全丧失。据文献[23]报道,毛霉菌Mucorbaciliformis产生的凝乳酶在pH值5.5时表现出最大的凝乳活力,与本结果一致。
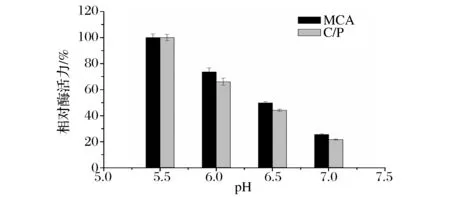
图3 pH对凝乳酶活力的影响Fig.3 Effect of pH on the activity of the rennet from B. amyloliquefaciens GSBa-1
2.2.4 酶的pH稳定性
由图4所示,随着pH升高相对凝乳酶活力逐渐增大,在pH6.5时,该凝乳酶相对酶活力达到最大值即凝乳酶活力稳定性最好;此后继续升高pH,凝乳酶相对酶活力逐渐减小,当pH为8.5时,相对酶活力只剩38.32%。有研究表明在中性或弱碱性条件下,凝乳酶的凝乳活力会显著损失,可能在这种条件下凝乳酶的构象发生了不可逆转的变化[24]。还有文献指出,因为pH对酶促凝乳的机理是复杂的,它不仅影响酶的稳定性而且影响酶的活性中心必需基团的解离程度、空间结构和底物的解离状态[25]。
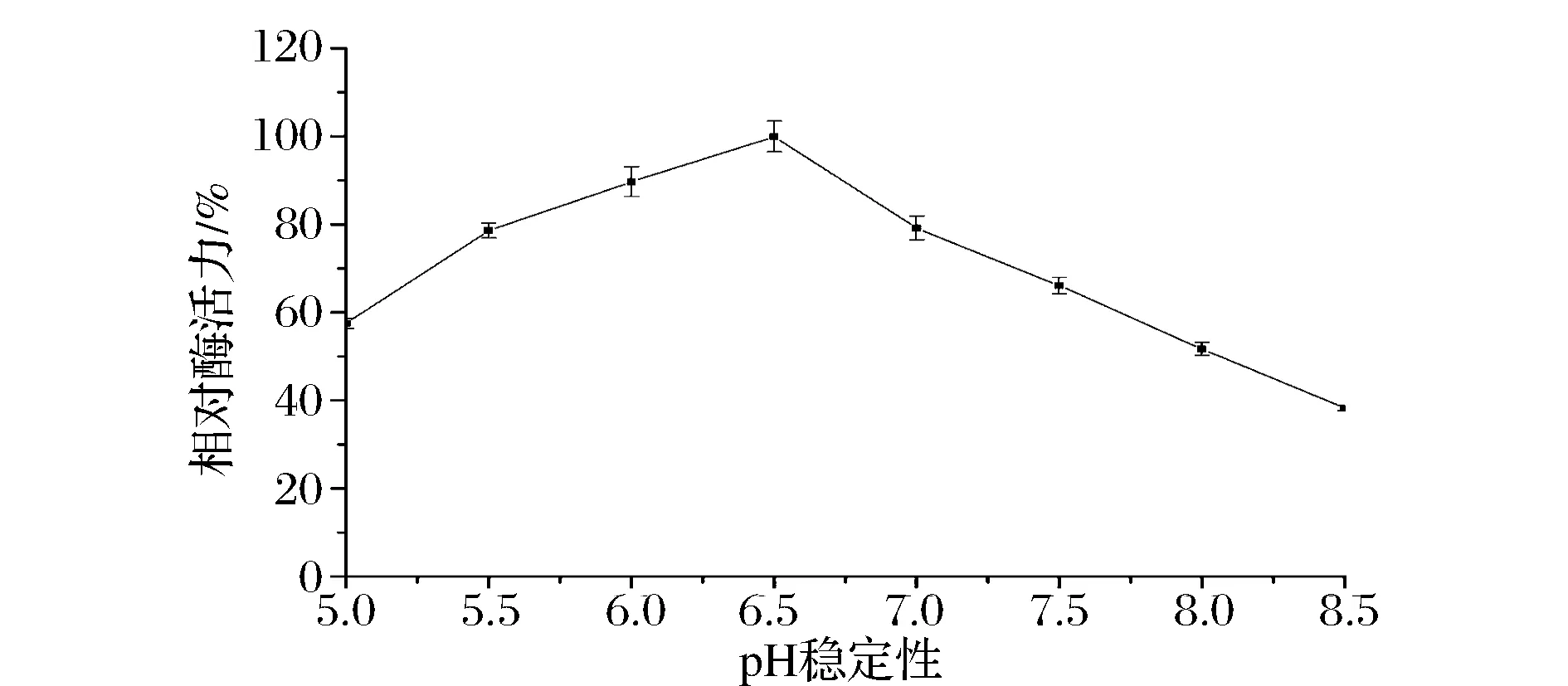
图4 凝乳酶的pH稳定性Fig.4 pH stability of the rennet from B. amyloliquefaciens GSBa-1
2.2.5 金属离子对酶活力的影响
由图5可知,与对照组相比,Ca2+、Mg2+、Fe2+、Zn2+以及Al3+均对凝乳酶的凝乳活力有促进作用,同时使C/P值也有不同程度的升值,其中添加Ca2+的作用最为明显,为空白对照的1.57倍。而Na+、K+、Cu2+对凝乳酶的凝乳活力和C/P值均有抑制作用。
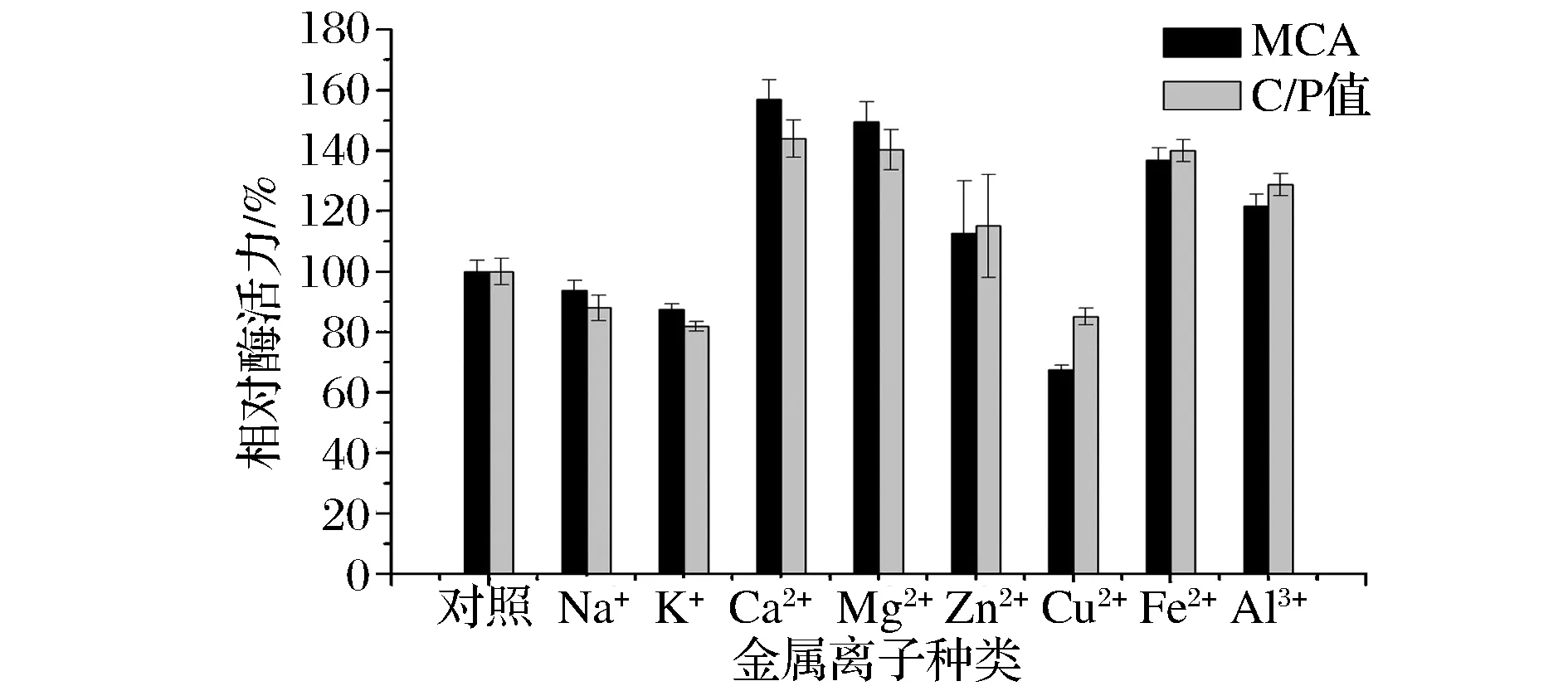
图5 金属离子对凝乳酶活力的影响Fig.5 Effect of metal ions on the activity of the rennet from B. amyloliquefaciens GSBa-1
一般认为,由于Ca2+可与H+之间进行交换从而降低了底物的pH值,间接加快了酶促反应的速率。由于Ca2+可与酪蛋白胶束中的胶体磷酸钙进行离子交换,使κ-酪蛋白胶束的表面电荷进一步减少,使胶束间的空间排斥力减小,导致大量的胶束互相靠近而凝聚,形成了交联网状结构。凝乳酶的来源不同,金属离子也会对凝乳作用有不同的影响。吴进菊等[26]报道,Ca2+、Zn2+、Fe3+、Fe2+、K+和Mg2+对根霉F34凝乳酶活力具有促进作用,而Na+和Cu2+具有明显的抑制作用。李玉秋[27]等研究表明,Ni2+和Fe2+对重组微小毛霉凝乳酶有抑制作用,Cu2+对凝乳酶活力没有影响。在干酪加工过程中,盐类一般具有防腐作用,并能增加干酪的功能性和感官效果,因此选择合适种类的盐类可以达到最佳的凝乳效果。
2.2.6 Ca2+离子浓度对酶活力的影响
由图6可知,随着Ca2+浓度增大,凝乳酶相对酶活力逐渐增大;当Ca2+浓度为0.020 mol/L时,相对酶活力达到最大值;此后继续增加Ca2+浓度,相对酶活力持续降低。因此,解淀粉芽孢杆菌GSBa-1凝乳酶的最适Ca2+浓度为0.020 mol/L。当Ca2+浓度为0.020 mol/L时凝乳速度最快,凝固效果也最好,对凝乳酶凝乳活力的促进作用也最为显著。因此在乳中添加适量的CaCl2以促进乳凝固,这也是西式干酪制作时添加的CaCl2原因,但CaCl2添加量不宜过大,否则会影响干酪的硬度、口感和风味。
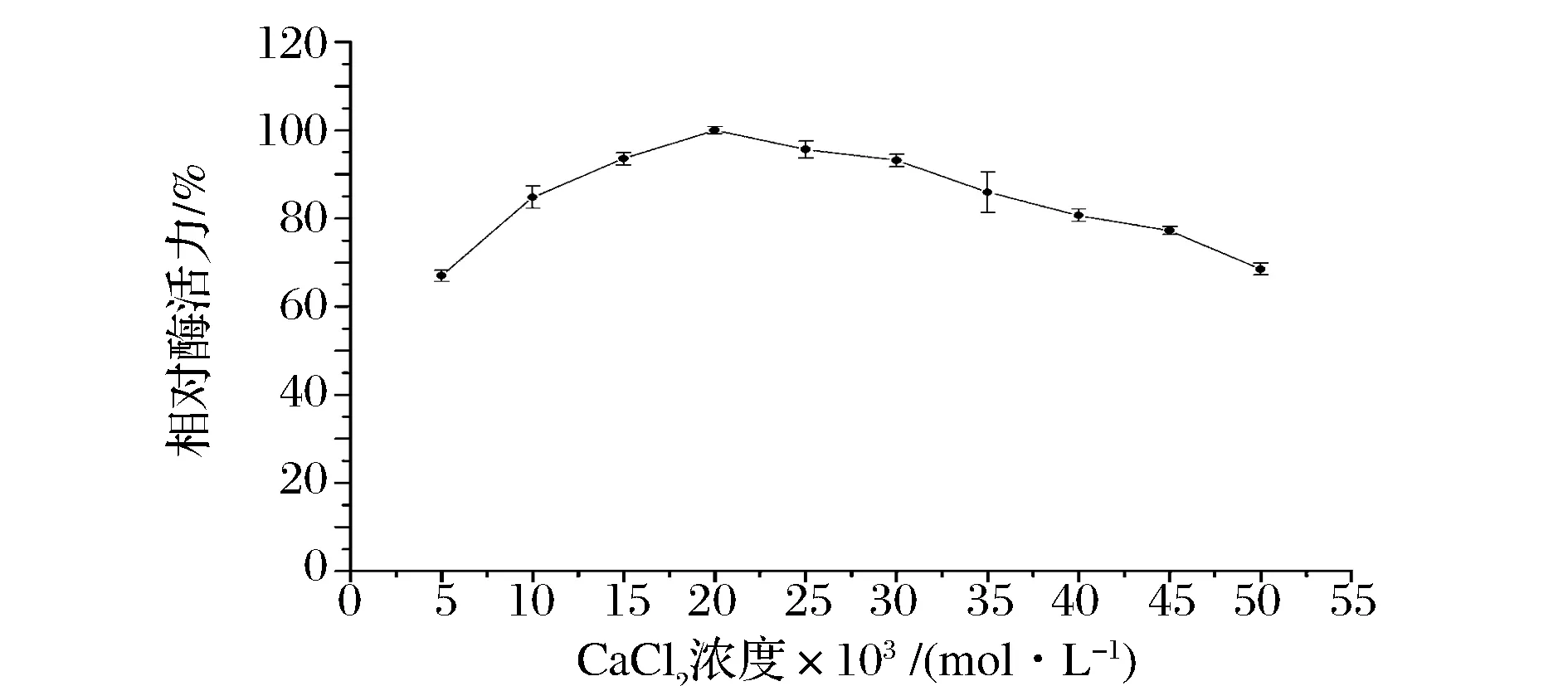
图6 CaCl2对凝乳酶活力的影响Fig.6 Effect of CaCl2 on the activity of the rennet from B. amyloliquefaciens GSBa-1
2.2.7 酶动力学特性研究
2.2.7.1 底物浓度对酶活力的影响
由图7可以看出,随着底物浓度增大,凝乳酶对酪蛋白水解活性逐渐增大,当底物浓度小于8 g/L时,随底物浓度增加,反应速度迅速随之增大;当底物浓度大于8 g/L时,反应速度趋于稳定,继续增大底物浓度,反应速度几乎不受底物浓度的影响,这一结果符合米氏规律。
2.2.7.2 米氏常数和最大反应速率的测定

图8 底物浓度倒数与酶活性倒数关系图Fig.8 Relationship between the reciprocal of substrate concentration and the reciprocal of enzyme activity
由图8可知,X轴上的截距即为-1/Km,Y轴上的截距即为1/Vmax,根据方程式求得Km=2.35 g/L,Vmax=1.18 U/mL。Km值是反应速度达到最大反应速度一半时的底物浓度,单位与底物浓度的单位一样,是衡量酶与底物亲和力大小的一个指标,从Km值的大小可以评价反应达到饱和的速度快慢。由于凝乳酶酶促凝乳作用并非简单的酶学反应,因而无法直接用牛乳作为底物测定其Km,因此,在研究凝乳酶动力学特性时,通常选择酪蛋白或血红蛋白作为底物,以蛋白水解活性为指标进行研究[28]。高维东等[1]研究表明,微小毛霉凝乳酶的Km=0.023 8 mol/L,Vmax=1.122 7 mg/min。从本实验结果来看,Km值较小,该凝乳酶酶解酪蛋白活性容易达到饱和,即在较高的底物浓度时,该凝乳酶对酪蛋白水解速度较慢,主要表现凝乳作用,从前面研究结果也能得出该凝乳酶具有较高的C/P值,这正是干酪生产中所需要的特性。
3 结论
本研究针对1株分离自酒曲的高产凝乳酶解淀粉芽孢杆菌GSBa-1菌株,获得其产凝乳酶的最佳条件为发酵温度35 ℃,装液量40%,摇床转速180 r/min,发酵时间84 h。在此最优发酵条件下菌株产凝乳酶活力为558.14 Su/mL。解淀粉芽孢杆菌GSBa-1凝乳酶的最适反应温度为55 ℃,在25~45 ℃之间酶活性稳定性较好。酶的最适反应pH为5.5,在pH<7.0之间,随着pH的增大,凝乳酶活力逐渐降低;当pH>7.0时,凝乳酶活力完全失活。在pH6.5时,凝乳酶活力保持最为稳定。金属离子对凝乳酶活性的影响研究显示,Ca2+、Mg2+、Fe2+、Zn2+以及Al3+均对凝乳酶的凝乳活力有促进作用,其中Ca2+对凝乳活力的促进作用最为显著,而Na+、K+和Cu2+对凝乳活力有抑制作用。酶水解酪蛋白底物的最大反应速度为1.18 U/mL,米氏常数为2.35 g/L。上述研究表明解淀粉芽孢杆菌GSBa-1凝乳酶具有较高的凝乳活力和C/P比值,可作为传统牛凝乳酶的替代品,具有潜在干酪生产应用价值。
[1] 高维东,甘伯中,丁福军,等. 微小毛霉凝乳酶的酶学性质研究[J].食品科学,2010,31(3):185-188.
[2] 杭 峰,洪 青,王钦博,等.凝乳酶的研究进展[J].食品科学,2016,37(3):273-279.
[3] 普燕,张富春.干酪用牛凝乳酶替代品的研究进展[J].食品与发酵工业,2015,41(5):227-234.
[4] 潘道东,韩玲玲. 根霉凝乳酶的分离纯化及其酶学特性研究[J].中国食品学报,2011,11(2):53-59.
[5] 周俊清, 林亲录, 赵谋明.微生物源凝乳酶的研究进展[J].中国食品添加剂, 2004(2): 6-9.
[6] 丁明亮,欧阳安然,王望斐,等.枯草芽孢杆菌产凝乳酶发酵条件的优化[J].食品科学,2011,32(3):156-160.
[7] 高维东,甘伯中,丁福军,等.微生物凝乳酶的研究进展[J].中国乳品工业,2009,37(5):34-47.
[8] 刘振民,骆承庠. 江米酒乳凝固机理研究[J]. 食品科学,2000,21(7):13-15.
[9] 薛璐,陈历俊,姜铁民,等.江米酒凝乳酶酶学特性的研究[J].食品科学,2008,29(4):259-262.
[10] WANG Y P, CHENG Q L, AHMED Z, et al. Purification and partial characterization of milk-clotting enzyme extracted from glutinous rice wine mash liquor[J]. Korean Journal of Chemical Engineering, 2009, 26(5): 1 313-1 318.
[11] 滕国新,李里特.Rhizopussp.052凝乳酶的部分酶学性质[J].食品与发酵工业,2006,32(7):12-15.
[12] ZHAO XIAO, WANG JI, ZHENG ZHE,et al.Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme[J]. Journal of Food Biochemistry,2015,39(1):70-79.
[13] 刘振民,刘 辉,骆承庠.酒药中凝乳酶菌株筛选及产酶条件研究[J].食品与发酵工业,2001,27(5):8-11.
[14] MAGADA A, BENDARY E L, MAYSA E M, et al. Purification and characterization of milk clotting enzyme produced byBacillussphaericus[J]. Journal of Applied Sciences Research, 2007, 3(8):695-699.
[15] 薛璐,姜铁民,任发政,等.江米酒凝乳机理的初步研究[J].食品与发酵工业,2006,32(9):37-38.
[16] 于振, 李建科, 马倩倩,等. 响应面法优化红曲米中凝乳酶高产菌株的发酵条件[J]. 食品工业科技, 2012, 33(13):146-150.
[17] 李建涛, 陈历俊, 姜铁民. 解淀粉芽孢杆菌产凝乳酶发酵条件的优化[J]. 中国食品添加剂, 2012(1):55-59.
[18] 赵爱梅, 赵笑, 段紫怡,等. 酒曲发酵产凝乳酶及其酶学特性研究[J]. 中国乳品工业, 2016, 44(2):16-21.
[19] 韦薇, 韩刚,徐凤彩.小牛凝乳酶的分离及部分特性研究[J].中国乳品工业, 1997, 25(4): 21-24.
[20] 宋礼,何潇,高维东,等.米黑毛霉凝乳酶酶学性质研究[J].食品工业科技,2012,33(23):192-197.
[21] KUMAR S,SHARMA N S,SAHARAN M R, et al. Extracellular acid protease fromRhizopusoryzae:purification and characterization[J].Process Biochemistry,2005,40(5):1 701-1 705.
[22] SHEEHAN J J, OLIVEIRA J C, KELLY A L, et al. Effect of cook temperature on primary proteolysis and predicted residual rennet activity of a semi-hard cheese manufactured using thermophilic cultures[J]. International Dairy Journal, 2007, 17(7): 826-834.
[23] El-Tanboly E S, El-Hofi M, Youssef Y B, et al. Utilization of salt whey from Egyptian Ras (Cephalotyre) cheese in microbial milk clotting enzymes production[J]. Acta Sci Pol, Technol. Aliment, 2013, 12(1): 9-19.
[24] HORNE D S, BANKS J M. Rennet-induced coagulation of milk[J]. Cheese: Chemistry, Physics and Microbiology, 2004, 1: 47-70.
[25] KUO C Y,WANG F S,LIN C W. Factors affecting milk clotting activity of sweet leaving extract involved in coagulation of a yoghurt-like product[J]. Food Chemistry,1996,55(2):129-131.
[26] 吴进菊,徐尔尼,陈卫平,等.酒曲根霉F34菌株凝乳酶的初步纯化及部分酶学性质的研究[J].食品工业科技,2008,29(9):135-137.
[27] 李玉秋,王景会,李铁柱,等.重组微小毛霉凝乳酶的发酵条件及其酶学性质[J].食品科学,2010,31(19):225-230.
[28] Nord F F. The Specificity and Mechanism of Pepsin Action[J]. Advances in Enzymology & Related Areas of Molecular Biology, 1970, 33:401-443.
Production of rennet byBacillusamyloliquefaciensGSBa-1 and its enzymological characteristics
TENG Jun-wei, ZHENG Zhe, MEI Xue-yang, FU Qi-jie, ZHANG Jian, YANG Zhen-nai*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Technology & Business University (BTBU),Beijing 100048, China)
In this paper, fermentation conditions for the rennet production fromBacillusamyloliquefaciensGSBa-1 were optimized by the orthogonal experimental design method. The optimal conditions were as follows: fermentation temperature of 35 ℃, liquid loading volume of 40%, shaking speed of 160 r/min, fermentation time of 84 h. The milk-clotting activity of the enzyme produced under the optimal condition was 558.14 Su/mL. The rennet fromBacillusamyloliquefaciensGSBa-1 was prepared and further studies were carried out on factors affecting enzymological characteristics of the rennet. Results showed that the optimum reaction temperature was 55 ℃, the enzyme activity was stable between 25-45 ℃, and incubation at 60 ℃ for 50 min resulted in complete loss of enzyme activity. The rennet presented the highest enzymatic activity at pH5.5, then it gradually decreased with the increase of pH from 5.5 to 7.0, and the enzyme activity of rennet was the most stable at pH 6.5. The rennet activity was positively affected by Ca2+, Mg2+, Fe2+, Zn2+and Al3+, of which Ca2+showed the most significant promoting effect, and the milk-clotting activity reached maximum at Ca2+concentration of 0.02 mol/L, while Na+, K+and Cu2+showed inhibition effect on the milk-clotting activity. ThekmandVmaxof the enzyme were 2.35 g/L and 1.18 U/mL, respectively.
Bacillusamyloliquefaciens; rennet; orthogonal experimental design method; enzymological characteristics
10.13995/j.cnki.11-1802/ts.201612015
硕士研究生(杨贞耐教授为通讯作者,E-mail:yangzhennai@th.btbu.edu.cn)。
国家自然科学基金面上项目(编号:31371804);北京市百千万人才工程资助项目(B类);2016年北京工商大学研究生科研能力提升计划项目
2016-06-30,改回日期:2016-08-08

