樟芝固态发酵产物抗氧化性分析
刘晓凤, MmanywaMarim Said, 赵 庆, 罗先江, 廖军艺,葛康杰, 石帅帅, 雀古拉·巴布提江, 艾连中, 夏永军
上海理工大学医疗器械与食品学院,上海食品微生物工程技术研究中心,上海 200093
樟芝固态发酵产物抗氧化性分析
刘晓凤, MmanywaMarim Said, 赵 庆, 罗先江, 廖军艺,葛康杰, 石帅帅, 雀古拉·巴布提江, 艾连中, 夏永军*
上海理工大学医疗器械与食品学院,上海食品微生物工程技术研究中心,上海 200093
本文对樟芝谷物固态发酵产物抗氧化性能及活性成分进行了研究。在所选谷物中,樟芝青稞固态发酵产物的乙醇提取物总抗氧化性最好,较未发酵青稞提高了4.02倍。通过无水乙醇50 ℃水浴振荡提取80 min,其总抗氧化性达到了769.60 U/g。对其抗氧化性能分析发现,樟芝青稞固态发酵乙醇提取物为6 mg/L时,对DPPH自由基、羟基自由基以及超氧阴离子的去除率分别为91.9%、51.2%、61.3%,对铁离子的螯合能力为79.5%。相对于未发酵谷物,大米、小米、玉米以及青稞的樟芝发酵产物中总酚含量均有显著的提升,其中青稞乙醇提取和水提取物中总酚含量分别提高了2.36倍和4.23倍。通过HPLC分析可知,樟芝固态发酵产物含有丰富的活性化合物,包括马来酸衍生物(Antrodin)以及泛醌类衍生物(Antroquinonol),且各组分含量较为均衡;而樟芝液态发酵菌丝体乙醇提取物中主要活性成分为马来酸衍生物,不含有泛醌类化合物。
樟芝; 固态发酵; 抗氧化; 总酚; 青稞
樟芝(Antrodiacamphorata),又称为牛樟芝、红樟菇等,原产于台湾地区的珍稀药用真菌,早期台湾原住民多用来治疗饮酒所致的肝脏疾病以及食物中毒、过敏、肠胃不适等问题[1]。研究表明,樟芝可以作为潜在新药的研发来源,含有多种生理活性成分,如活性多糖、三萜类化合物、固醇类化合物、苯环类化合物、多酚类化合物等,无论是樟芝子实体还是菌丝体产物,都具有非常好的保肝、抗癌等生理活性,许多学者的研究也证实了这一点[2-6]。
机体过度氧化是许多健康问题的主要引发原因,适当的抑制体内自由基的形成可以有效地缓解多种疾病。樟芝的抗氧化活性备受关注,许多学者对其液态发酵菌体和发酵液的抗氧化性能进行了研究。Song[7]等人研究显示,樟芝液态发酵发酵液过滤组分能强烈地抑制脂质体过氧化,但是有机溶剂萃取组分抗氧化能力较弱。Hseu[8]等人研究发现樟芝菌体水提物可以有效地抑制由AAPH引发的红细胞氧化性溶血和脂质体/蛋白的过氧化,并且可以阻止红细胞内谷胱甘肽和ATP的损耗。
虽然樟芝菌丝体发酵产物中不含有麦角甾烷类三萜化合物,但是培养方式的改变同时也带来不同的合成代谢途径,使得樟芝发酵产物产生新的活性物质,这些活性物质同样具有良好的生理活性。目前关于樟芝固态发酵产物的抗氧化研究较少,本文对比了樟芝不同谷物固态发酵产物的总抗氧化性能及总酚含量,分析了不同提取条件对总抗氧化性的影响,并对其自由基清除能力进行了研究,为开拓樟芝固态发酵产物的活性功能以及保健产品开发提供技术支持。
1 材料与方法
1.1 菌株
樟芝S-29来源于实验室,保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC 9590。
1.2 培养基及培养条件
樟芝A.camphorataS-29菌株接种于PDA斜面,28 ℃避光培养9 d,于4 ℃保藏。
孢子悬浮液制备:取茄型瓶斜面,利用含有Tween 80(0.1% v/v)的无菌水25 mL洗下孢子,镜检孢子数达到1×108个/mL。
种子培养基:葡萄糖20 g/L,大豆蛋白胨4 g/L,柠檬酸0.5 g/L,MgSO40.5 g/L,KH2PO40.5 g/L,pH 5.0。28 ℃,110 r/min培养4 d。
固态发酵培养基(1 L锥形瓶):谷物原料100 g,大豆蛋白胨0.4 g,MgSO40.5 g,KH2PO40.5 g,初始含水量70%(m/v),初始pH 5.0。固态发酵接种量为30%(v/m),28 ℃培养20 d。实验选取大米、小米、玉米、青稞、黑米等谷物进行固态发酵。
液态发酵培养基:葡萄糖40 g/L,大豆蛋白胨6 g/L,MgSO40.5 g/L,KH2PO40.5 g/L,pH 5.0。28 ℃,110 r/min培养8 d。
所有培养基均在115 ℃灭菌20 min。
1.3 樟芝固态发酵产物抗氧化性能分析
1.3.1 樟芝谷物发酵产物总酚含量的比较
将樟芝不同谷物发酵物粉碎,利用100目筛网过筛,得到发酵粉末。选用乙醇和水作为提取溶剂,分别称取1 g发酵谷物粉末,放入20 mL提取溶剂中,40 ℃振荡浸提1 h,测定提取液总酚含量,并以未发酵谷物提取物作为对照。
1.3.2 樟芝不同谷物发酵物抗氧化性比较
将樟芝不同谷物发酵物粉碎,利用100目筛网过筛,得到发酵粉末。选用乙醇和水作为提取溶剂,分别称取1 g发酵谷物粉末,放入20 mL提取溶剂中,40 ℃振荡浸提1 h,测定提取液总抗氧化性,并以未发酵谷物提取物作为对照。
1.3.3 不同提取溶剂萃取青稞发酵产物
将樟芝青稞固态发酵产物进行粉碎,利用100目筛网过筛,得到发酵粉末。实验选取正己烷、丙酮、氯仿、乙酸乙酯、乙醇作为提取溶剂进行实验。称取1 g发酵粉末,分别放入20 mL提取溶剂中,室温振荡浸提1 h,测定总抗氧化性,并以未发酵谷物提取物作为对照。1.3.4 乙醇浓度对樟芝固态发酵产物抗氧化性影响
将樟芝青稞固态发酵产物进行粉碎,利用100目筛网过筛,得到发酵粉末。实验选取乙醇浓度分别为60%、70%、80%、90%、100%,称取1 g发酵粉末,分别放入20 mL提取溶剂中,室温振荡浸提1 h,测定总抗氧化性。
1.3.5 乙醇萃取温度对樟芝固态发酵产物抗氧化性影响
将樟芝青稞固态发酵产物进行粉碎,利用100目筛网过筛,得到发酵粉末。选取无水乙醇作为提取溶剂,称取1 g谷物粉末,放入20 mL乙醇中,设定提取温度为20 ℃~60 ℃,振荡浸提1 h,测定总抗氧化性。
1.3.6 乙醇萃取时间对樟芝固态发酵产物抗氧化性影响
将樟芝青稞固态发酵产物进行粉碎,利用100目筛网过筛,得到发酵粉末。选取无水乙醇作为提取溶剂,称取1 g谷物粉末,放入20 mL乙醇中,设定提取时间为60 min~120 min,测定总抗氧化性。
1.4 分析方法
1.4.1 总抗氧化性分析
樟芝发酵产物总抗氧化性(T-AOC)分析采用南京建成生物科技有限公司试剂盒。
1.4.2 总酚含量的测定
樟芝固态发酵产物总酚含量采用福林-酚法测定[9]。
1.4.3 樟芝固态发酵乙醇萃取物的制备
将10 g樟芝青稞固态发酵产物放置于容器中,按固液比1∶20加入无水乙醇,50 ℃水浴振荡提取80 min,抽滤得到乙醇提取液。重复提取两次,合并提取液,旋蒸浓缩至干,放置于4 ℃冰箱保存备用。
1.4.4 樟芝液态发酵菌丝体乙醇萃取物的制备
将10 g干燥后的樟芝液态发酵菌体粉碎后放置于容器中,按固液比1∶20加入无水乙醇,50 ℃水浴振荡提取80 min,抽滤得到乙醇提取液。重复提取两次,合并提取液,旋蒸浓缩至干,放置于4 ℃冰箱保存备用。
1.4.5 DPPH清除率[10]
分别取樟芝谷物发酵产物乙醇萃取物2 mg/mL和6 mg/mL各2 mL,加入1 mL DPPH溶液(0.2 mmol/L,以无水乙醇溶液溶解),混合均匀,然后在室温下遮光反应30 min后,然后在转速6 000 r/min下离心10 min,取上层清液,最后在波长为517 nm处测定样品的吸光度。空白组样品以等体积的无水乙醇溶液代替0.2 mmol/L DPPH的无水乙醇溶液,对照组样品以等体积相应溶剂代替谷物萃取液,并做3次平行。
1.4.6 清除HO-羟基能力[11]
在10 mL具塞试管中依次加入1 mL硫酸亚铁溶液(5 mmol/L),1 mL水杨酸-乙醇溶液(5 mmol/L),1 mL过氧化氢溶液(3 mmol/L)混合均匀,然后自上述体系中加入樟芝谷物发酵产物乙醇萃取物2 mg/mL、6 mg/mL各2 mL,用双蒸水补齐至刻度,在37 ℃的恒温水浴中反应15 min,然后再转速6 000 r/min离心10 min,以双蒸水做参比,在波长510 nm下测定吸光度,吸光值数据平行测定3次。
1.4.7 超氧阴离子自由基清除率[12]
取0.05 mol/L Tris-HCl缓冲液(pH8.2)4.5 mL,置于25 ℃水浴中预热20 min,分别加入樟芝谷物发酵产物乙醇萃取物2 mg/mL、6 mg/mL 各2 mL和0.1 mL 25 mmol/L邻苯三酚溶液(以10 mmol/L盐酸配制,调零管取用10 mmol/L盐酸代替邻苯三酚的盐酸溶液),混匀后于25 ℃水浴中反应5 min,加入1 mL 8 mol/L盐酸终止反应,325 nm处测定吸光度。空白对照组以双蒸水代替样品液。
1.4.8 亚铁离子螯合能力[13]
分别樟芝谷物发酵产物乙醇萃取物2 mg/mL和6 mg/mL各2 mL与0.1 mL抗坏血酸溶液(10 g/L),0.1 mL硫酸亚铁溶液(4 g/L)和1 mL氢氧化钠溶液(0.2 mol/L)混合,在37 ℃水浴中孵育20 min然后加入0.2 mL三氯乙酸(10%),经离心10 min得上层清液,加入0.5 mL邻菲罗啉(1 g/L)溶液,反应10 min后,在510 nm波长下测定吸光度。(以双蒸水作为空白对照)调零用双蒸水调零。
1.4.9 HPLC分析方法
樟芝固态发酵产物HPLC分析条件如下:色谱柱,Sepax HP C18(4.6 mm×250 mm,5 μm);流速:1 mL/min;检测波长:254 nm;流动相A:水/TFA=100/0.5,流动相B:乙腈;洗脱梯度如下:0 min~4 min,流动相B 35%~57%;4 min~10 min,流动相B 57%~70%;10 min~15 min,流动相B 70%~90%;15 min~18 min,流动相B 90%~100%;18 min~28 min,流动相B 100%~35%。
1.5 数据统计分析
每个实验重复三次,数据采用SPSS 19.0统计软件对数据进行处理,实验结果以均值±标准偏差(Mean+SD)表示。
2 结果与讨论
2.1 樟芝固态发酵产物总酚含量分析

天然多酚化合物由于含有多羟基基团,具有良好的抗氧化活性。如图1所示,樟芝固态发酵产物中含有丰富的多酚类化合物。经过樟芝发酵,大米、小米、玉米以及青稞的乙醇提取液总酚含量均有显著的提升,其中青稞发酵产物总酚含量最高,达到了5.82 mg/g,较未发酵青稞提高了2.36倍。在水提物中,樟芝固态发酵产物的总酚含量依次为小米>青稞>玉米>大米,其中小米与青稞的总酚含量分别为8.61 mg/g、8.26 mg/g。然而,在大米、小米与玉米的未发酵谷物几乎没有检测到多酚类化合物。有趣的是,经过樟芝发酵,无论是乙醇提取液还是水提液中,黑米中的总酚含量有明显的下降,为所选谷物中总酚含量最低的样品,其中乙醇提取总酚含量为1.96 mg/g,较未发酵黑米降低了43%。这可能是樟芝发酵过程中会对黑米中的花青素进行利用降解,从而导致总酚含量有所降低。实验结果可知樟芝发酵谷物可以显著提高谷物中总酚类化合物的含量。
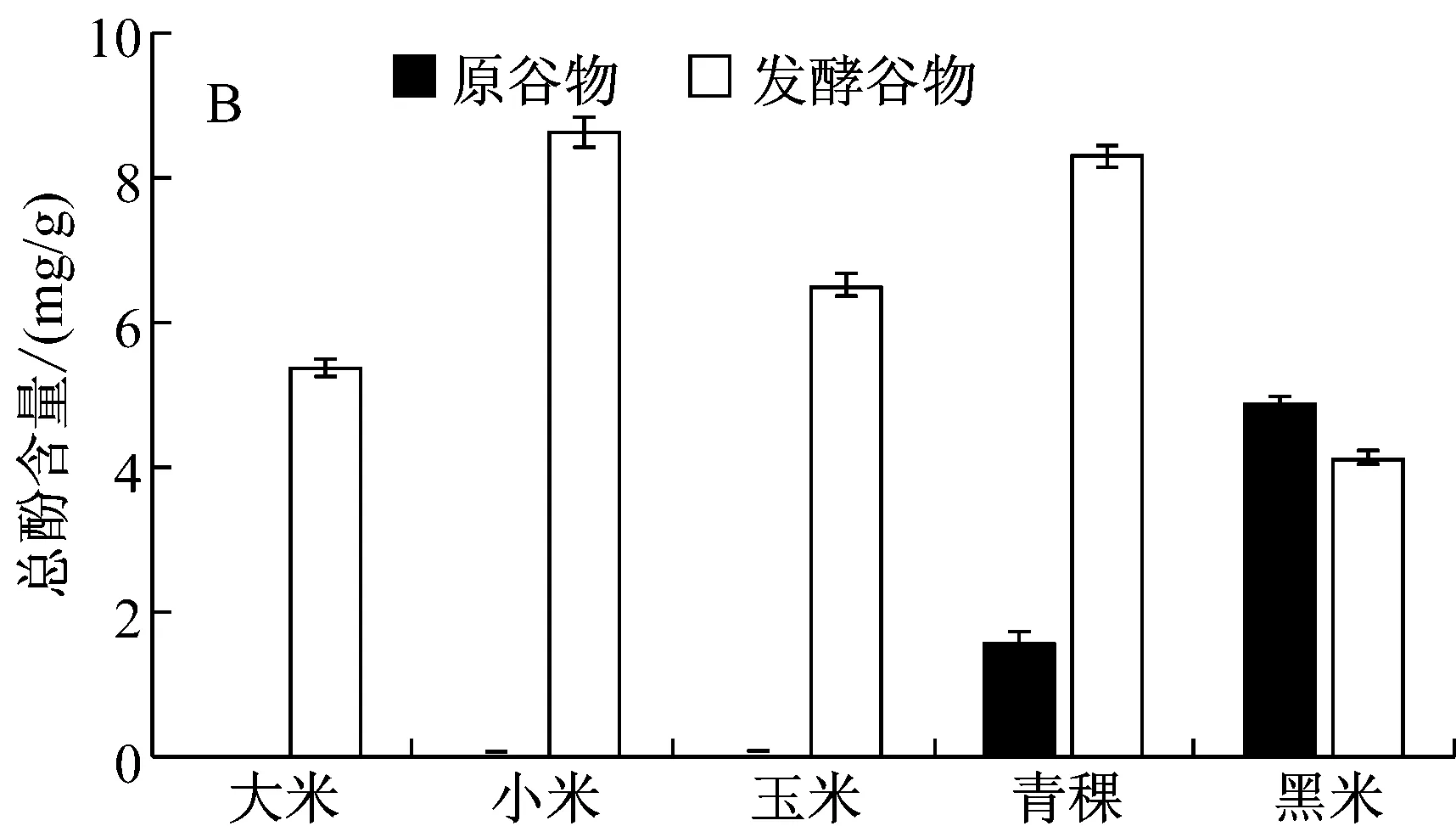
A:乙醇提取;B:水提取图1 樟芝固态发酵产物总酚含量分析
2.2 樟芝不同谷物发酵抗氧化性能分析
樟芝在实验所选谷物上均生长良好,其中青稞、大米生长较快,小米生长较慢。如图2所示,樟芝不同谷物发酵抗氧化性有较大差异。在所选谷物中青稞发酵产物乙醇提取物总抗氧化活性最高,达到了772.07 U/g,比Vc参照组总抗氧化值高出了56.50%,相当于1.69 mmol/L的Vc;黑米发酵产物其次,为762.20 U/g;大米和小米发酵产物总抗氧化性较低,均在300 U/g以下(图2B)。如图1A所示,热水提取的樟芝谷物固态发酵产物总抗氧化性较乙醇提取物低,其中最高的为青稞发酵产物,仅有426.11 U/g;但是与其他谷物不同的是,小米发酵的水提物总抗氧化性高于乙醇提取物,两者相差达到1.78倍。因此,后续实验选取青稞作为固态发酵原料。
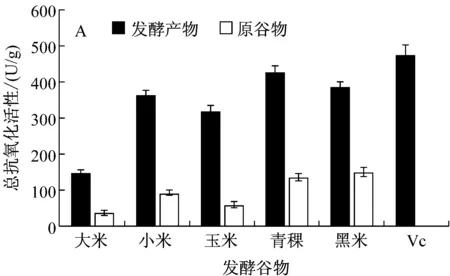
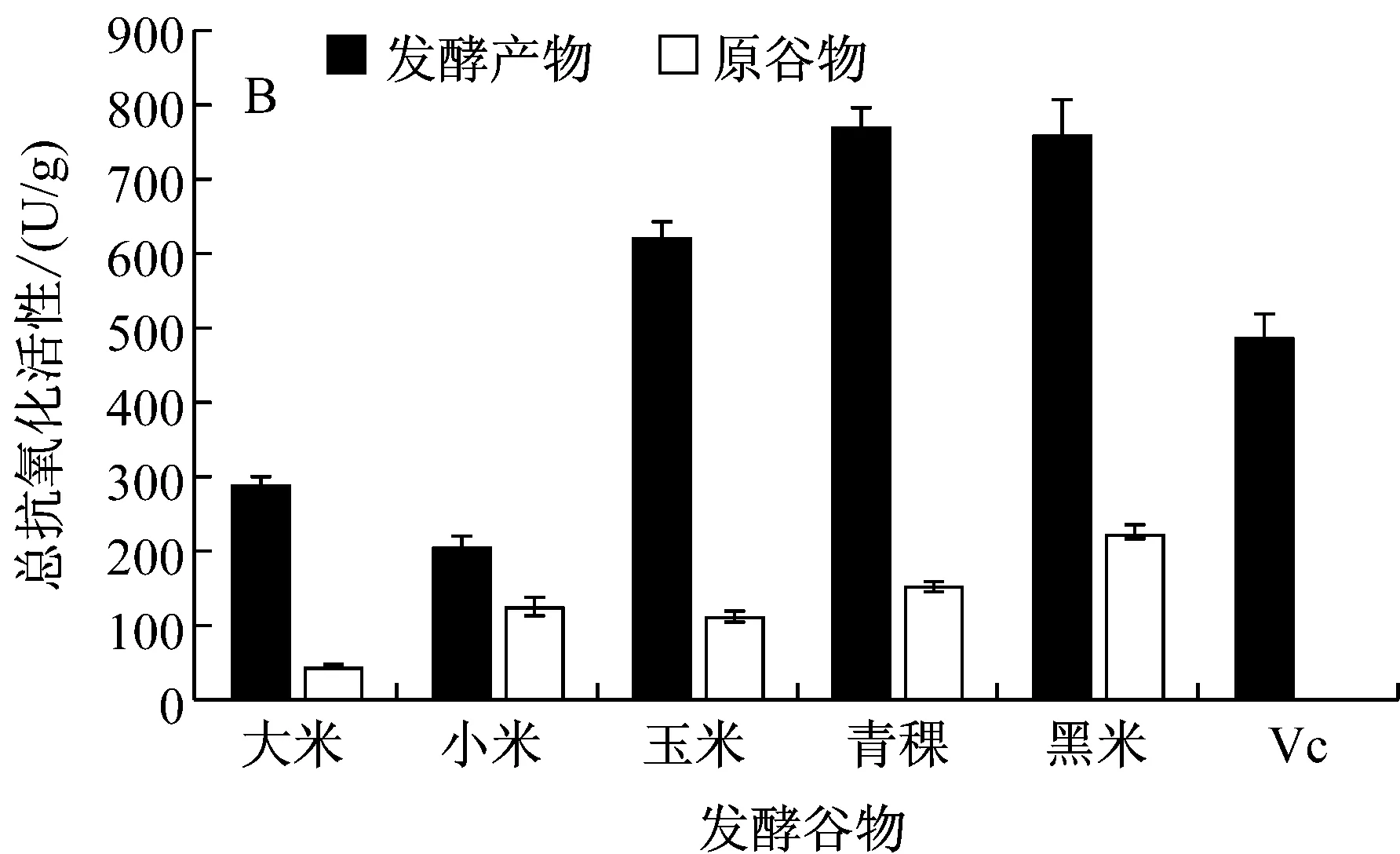
A:水提取;B:乙醇提取图2 樟芝不同谷物固态发酵产物总抗氧化性分析
2.3 不同有机溶剂萃取抗氧化性能分析
不同溶剂的极性不同,因此所提取的化合物种类有一定差异,本实验选取了不同的有机溶剂对樟芝青稞发酵产物总抗氧化性能进行分析,实验结果如图3所示。结果显示乙醇提取液的总抗氧性最好,达到了757.27 U/g,丙酮提取液总抗氧化性其次,仅有357.67 U/g。乙醇作为提取剂,能够诱导非极性化合物产生一定的偶极矩,令其产生一定的极性,从而增加溶解度,同时对青稞发酵产物的穿透力强,成分提取比较全面且使用安全,因此,后续实验选用乙醇作为提取溶剂。

图3 不同提取溶剂对樟芝青稞发酵产物总抗氧化性的影响
2.4 乙醇浓度对樟芝固态发酵产物抗氧化性影响
不同浓度乙醇溶液提取樟芝青稞固态发酵物的抗氧化活性结果如图4所示。当乙醇浓度较低时(60%~80%),乙醇提取液的总抗氧化性变化幅度较小,且处于较低水平;当乙醇浓度进一步提高(80%~100%),乙醇提取液的总抗氧化性迅速增加,在100%乙醇提取时达到最高。

图4 乙醇浓度对樟芝固态发酵产物抗氧化性影响
2.5 提取温度及提取时间对樟芝固态发酵产物抗氧化性影响
图5显示了提取温度和时间对樟芝固态发酵产物抗氧化性影响。提取温度及时间会影响活性成分在提取溶剂中的扩散作用以及稳定性。如图5A所示,温度对乙醇提取液总抗氧化性有显著影响。在40 ℃~60 ℃之间,总抗氧化性没有显著差异,其中50 ℃时总抗氧化值达到730.17 U/g,说明在实验选择温度范围内,乙醇提取物的温度稳定性较好;当提取温度为20 ℃时,提取液的总抗氧化性迅速下降,仅有140.16 U/g,降低了80.74%。如图5B所示,随着提取时间的延长,樟芝青稞发酵产物乙醇提取液的总抗氧化性逐渐提高,当提取时间为80 min时达到最大,高达769.60 U/g,随着温度继续上升,总抗氧化性稍有下降。因此,后续实验选择提取温度为50 ℃、提取时间为80 min。
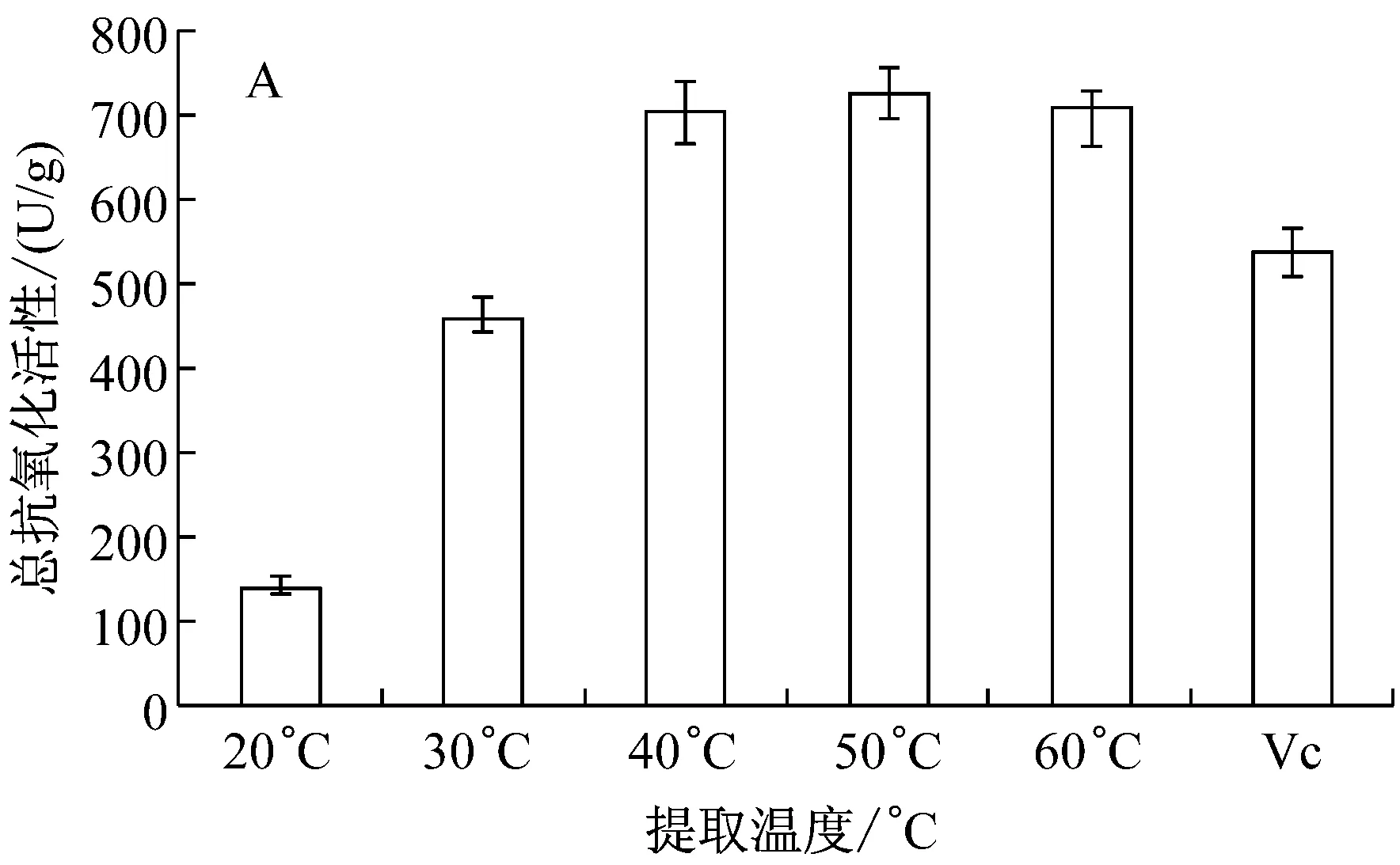
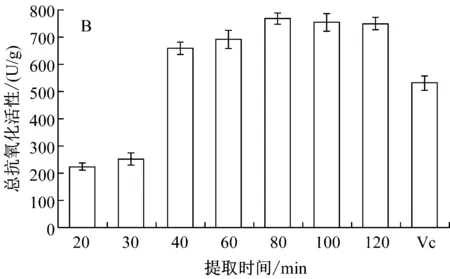
A:提取温度;B:提取时间图5 提取温度及提取时间对樟芝青稞发酵产物总抗氧化性的影响
2.6 樟芝青稞固态发酵产物抗氧化性能评价
自由基等会造成机体组织过氧化、核酸与蛋白质解聚断裂,对机体健康有着极大的损害。对自由基的清除效果是反应抗氧化能力的重要指标。如图6A所示,樟芝青稞固态发酵产物具有较好的清除自由基能力。当浓度为乙醇提取物浓度为6 mg/L时,DPPH自由基清除效率达到了91.9%,通过标曲换算相当于4.48 mmol/L的Vc;羟基自由基和超氧阴离子的清除率也分别达到了51.2%和63.3%。对樟芝固态发酵产物铁离子螯合能力研究发现,随着乙醇提取物浓度提高,螯合能力逐渐提高,当6 mg/L时达到了79.5%。樟芝液态发酵菌丝体乙醇提取物也具有较好的抗氧化性,但自由基清除能力较固态发酵产物低(图6B)。


A:固态发酵产物;B液态发酵产物图6 樟芝菌丝体发酵产物抗氧化性能对比
2.7 樟芝发酵产物HPLC分析
樟芝主要有三种人工培养方式:牛樟树椴木栽培法、固态发酵法、深层液态发酵法,第一种得到的是子实体,后两种得到的是菌丝体或其混合物。目前,樟芝菌丝体培养是有效的大规模人工培养方式。如图7所示,樟芝青稞固态发酵乙醇提取物中含有丰富的活性化合物,包括马来酸衍生物(Antrodin A、C)以及泛醌类衍生物(Antroquinonol、Antroquinonol B),而樟芝液态发酵菌丝体乙醇提取物中主要活性成分为马来酸衍生物(Antrodin A、C),不含有泛醌类化合物[14]。
3 结论
本文对樟芝固态发酵产物相关成分进行了测定,并对比评价其抗氧化性能。结果显示,通过樟芝固态发酵,发酵产物中的总酚含量以及清除自由基等抗氧化性能均有显著的提高。在实验所选谷物中,樟芝青稞固态发酵产物抗氧化性能最好,其乙醇提取和水提取物中总酚含量较未发酵谷物分别提高了2.36倍和4.23倍,总抗氧化能力分别提高了2.19倍和4.02倍。樟芝青稞固态发酵产物的自由基清除能力以及铁离子螯合能力均好于液态发酵菌体提取物,而且从活性成分分析可知,樟芝青稞固态发酵乙醇提取物中含有丰富的活性化合物,且各组分含量较为均衡;而樟芝液态发酵菌丝体乙醇提取物中活性成分较为单一。由此可知,樟芝固态发酵产物在抗氧化方面具有较好的潜力,需要进一步对其抗氧化活性成分进行鉴定,并且研究其对细胞组织氧化应激损伤的保护作用。

A:液态发酵;B:固态发酵1:Antroquinonol B; 2:Antrodin C; 3:Antrodin A; 4:Antroquinonol图7 樟芝发酵产品HPLC分析图
[1] Wu SH, Ryvarden L, Chang TT.Antrodiacamphorata(“niu-chang-chih”), new combination on medicinal fungus in Taiwan[J]. Bot Bull Acad Sinica,1996, 38(4): 273-275.
[2] Shao YY, Chen CC, Wang HY. Chemical constituents ofAntrodiacamphoratasubmerged whole broth[J]. Nat Prod Res, 2008, 22(13): 1151-1157.
[3] Chang JS, Kuo HP, Chang KL,etal. Apoptosis of hepatocellular carcinoma cells induced by nanoencapsulated polysaccharides Extracted fromAntrodiacamphorata[J]. PloS One, 2015, 10(9):e0136782.
[4] Qiao X, Wang Q, Ji S,etal. Metabolites identification and multi-component pharmacokinetics of ergostane and lanostane triterpenoids in the anticancer mushroomAntrodiacinnamomea[J]. J Pharm Biomed Anal, 2015, 111: 266-276.
[5] Kumar KJ, Vani MG, Chueh PJ,etal. Antrodin C inhibits epithelial-to-mesenchymal transition and metastasis of breast cancer cells via suppression of smad2/3 and β-catenin signaling pathways[J]. PloS One, 2015, 10(2):e0117111.
[6] Yen IC, Yao CW, Kuo MT,etal. Anti-cancer agents derived from solid-state fermentedAntrodiacamphoratamycelium[J]. Fitoterapia, 2015, 102:115-119.
[7] Sond TY, Yen GC. Antioxidant properties ofAntrodiacamphoratain submerged culture[J]. J Agric Food Chem, 2002, 50(11): 3322-3327.
[8] Hseu YC, Chang WC, Hseu YT,etal. Protection of oxidative damage by aqueous extract fromAntrodiacamphorata, mycelia in normal human erythrocytes[J]. Life Sci, 2002, 71(4): 469-482.
[9] Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdic phosphotungstic acid reagents[J].Am J EnolVitic,1964, 16: 144-158.
[10] Shimada K, Fujikawa K, Yahara K,etal. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. J Agric Food Chem, 1992, 40(6): 945-948.
[11] Liu F, Ooi VE, Chang ST. Free radical scavenging activities of mushroom polysaccharide extracts[J]. Life Sci, 1997, 60(10): 763-771.
[12] Nishikimi M, Appaji N, Yagi K. The Occurrence of Superoxide Anion in the Reaction of Reduced Phenazine Methosulfate and Molecular oxygen[J].Biochem Biophys Res Commun, 1972, 46(2): 849-854.
[13] Decker EA, Welch B. Role of Ferritin as a Lipid Oxidation Catalyst in Muscle Food. J Agric Food Chem, 1990, 38(3): 674-677.
[14] 夏永军. 樟芝菌发酵生产Antrodins等活性产物的研究[学位论文]. 出版地:无锡,出版者: 江南大学,出版年 2012.
Antioxidant of Antrodia camphorata by solid state fermentation
LIU Xiao-feng, MmanywaMarim Said, ZHAO Qing, LUO Xian-jiang, LIAO Jun-yi, GE Kang-jie, SHI Shuai-shuai, Xugla Bamutjan, AI Lian-zhong, XIA Yong-jun
School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai Engineering Research Center of Food Microbiology, Shanghai, 200093
The antioxidant and bioactive compounds ofAntrodiacamphorataby solid state fermentation (SSF) were investigated. Results showed that the ethanol extract of fermented highland barley had the highest antioxidant activity with 4.02 times than that of the unfermented highland barley. The antioxidant activity could reach up to 769.60 U/g under the extracting conditions: ethanol 100%, temperature 50℃, extracting time 80 min. When concentration of ethanol extract was 6 mg/g, free radical scavenging activity for DPPH radical, hydroxyl free radicals, superoxide anion were 91.9%, 51.2%, 61.3% respectively; and the chelating effects of ethanol extract on ferrous ions was 79.5%. The total phenolic contents of fermented grains, such as rice, millet, corn and highland barley were increased significantly than those of unfermented grains. There were 2.36, 4.23 times increasing for the fermented highland barley extracted by ethanol and water, respectively. In SSF,Antrodiacamphoratacould synthesize more bioactive compounds than in liquid state fermentation (LSF), including antrodin and antroquinonol. However, there was no antroquinonol produced in LSF.
Antrodiacamphorata; solid state fermentation; antioxidant activity; total phenolic; highland barley
10.3969/j.issn.1001-6678.2016.06.006
上海市自然科学基金项目(15ZR1428900);上海市大学生创新创业训练计划项目(201510252146);沪江基金研究基地专项(D15012)。
刘晓凤(1991~),女,硕士,食品微生物资源开发及利用。E-mail:18354286623@163.com。
*通信作者:夏永军(1981~),男,讲师,博士,食品生物技术。E-mail:dreamup@126.com。

