接种丛植菌根真菌对湿生植物氮磷吸收能力的影响
段 灏, 王 磊, 曹湛波
同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,200092
接种丛植菌根真菌对湿生植物氮磷吸收能力的影响
段 灏, 王 磊*, 曹湛波
同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,200092
丛枝菌根(Arbuscularmycorrhizal, AM)真菌是一类能够与大多数陆生植物共生,并改善植物生长和氮磷吸收的微生物。湿生植物在湿地污染净化过程中起着决定性的作用,但利用AM真菌改良湿生植物氮磷吸收能力的研究鲜有报道。本研究选取了3种湿生植物千屈菜、旱伞草和黄花鸢尾,在盆栽培养的基础上,分别接种根内球囊霉(RE)、摩西球囊霉(GM)、幼套球囊霉(CE)三种AM真菌,并和空白对照比较接种AM真菌对不同植物地上、地下及整株的生物量和氮磷吸收的影响。结果表明,接种AM真菌对植物生长和氮磷吸收的影响呈现出植物间和植物内的差异,促进与抑制效应表现不一。综合AM真菌对植物生物量和氮磷吸收的促进效应,最佳AM真菌-植物的组合为:千屈菜-RE,旱伞草-RE,黄花鸢尾接种-GM。三种植物接种最佳的AM真菌后植物生物量、TN量和TP量分别提高了17.7%~29.8%、15.7%~39.0%和22.3%~62.6%。本研究为今后强化湿生植物的氮磷吸收能力提供了一种新的可选择的途径。
丛枝菌根真菌; 湿生植物; 侵染率; 植物生物量; 氮磷吸收
植物作为湿地生态系统的重要组成部分,具有吸收氮磷和重金属、改善水体微生物生境、抑藻等功能[1]。其中,湿生植物的氮磷吸收能力对水体富营养化问题有直接的影响。如何筛选优势植物,并利用一些生物学手段改善植物生境,从而加强其氮磷吸收能力,对于湿地功能的完善和强化有较大的意义。
真菌是分布最广泛的真核微生物,具有广泛的应用价值,如真菌发酵产亚麻酸等[2]。自然界中普遍存在真菌与植物共生的现象,AM真菌能够与陆地80%以上的植物根系建立共生关系[3],通过侵染植物根系使真菌菌丝和植物营养根系形成一种联合体即菌根。菌根能够增强植物对土壤矿质元素的吸收,促进植物生长,提高氮磷吸收能力和植物抗逆性[4-7],在农业生产和环境保护的应用前景十分广阔。
关于AM真菌的研究目前主要集中在山体的护坡功能和农田水系氮磷的吸收方面[8],对于湿生植物接种AM真菌后其氮磷吸收能力有何变化的研究相对较少。本研究对3种湿生植物进行3种AM真菌的接种实验,通过比较接种不同AM真菌对植物生长和氮磷吸收能力的影响,寻求最佳的AM真菌-植物组合,以期提高湿生植物的N、P吸收能力,从而为缓解湖库、河道的富营养化问题提供一种新的技术选择。
1 材料与方法
1.1 材料
1.1.1 植物
选取3种湿生植物作为实验对象,分别为千屈菜科千屈菜(LythrumsalicariaL)、鸢尾科黄花鸢尾(IriswilsoniiC.H.Wright)、莎草科旱伞草(Cyperusalternifolius),植物幼苗购买自上海市泽龙生物工程有限公司。
1.1.2 AM真菌
在查阅相关文献的基础上,比对中国丛植菌根真菌种质资源库,筛选出适合湿生植物的3种AM真菌:幼套球囊霉(Claroideoglomusetunicatum, CE)、根内球囊霉(Rhizophagusintruradices, RE)、摩西球囊霉(Glomusmosseae, GM)。

A.幼套球囊霉-CE;B. 根内球囊霉-RE; C. 摩西球囊霉-GM。筛选自欧洲菌藏中心(BEG)、国际丛枝菌根真菌保藏中心(INVAM)和中国丛枝菌根真菌菌藏和种质资源库(BGC)
图1 3种AM真菌的形态
1.1.3 AM真菌扩繁
选取以玉米、高粱等为宿主植物,以土壤+草炭为培养基质的盆栽培养体系,对CE,RE和GM三种AM真菌进行扩繁,为实验提供AM菌剂来源。基质土壤选自上海市崇明区东滩湿地公园,土壤经自然风干后,过2 mm土壤筛,经121 ℃高温高压灭菌2 h,放置一周备用。由于土壤是围垦的贫瘠土壤,肥力较差,加入经灭菌的发酵有机肥。施肥之后的土壤理化性质如表1。

表1 培养基质理化性质
1.2 植物栽培与接种过程
研究开始于2015年5月29日,地点为同济大学环境学院生态楼北侧水泥平地。选取21 cm×16 cm的塑料花盆作为培养容器,使用前75%酒精消毒,盆内装入灭菌土壤3 kg。设置每种植物不接种空白对照CK,接种GM、CE、RE的四种处理,每种处理3个重复,共计36盆。3种AM菌剂分别与灭菌土壤均匀搅拌,并将此土壤混合菌剂50 g加入相应处理的花盆土壤中,拌匀。选择长势一致的千屈菜、旱伞草、黄花鸢尾,每盆移栽1株。实验期间,根据实际情况对植物进行浇水。
2015年8月29日,收获整株植物,采集后用自来水洗净,地上部分和地下部分分开处理。地下部分样品一部分用于测定菌根侵染率,另一部分用于测定其生物量。用于后续理化指标分析的植物样品在测定生物量后粉碎,过0.5 mm筛。
1.3 样品分析
植物生物量:80 ℃烘箱中2 d至恒重,电子天平称量。地下部分的总干重根据其鲜重的比例进行计算。
AM真菌侵染率[9]:采用酸性品红染色法。随机取5穴幼苗的根,采用酸性品红染色法进行染色后,随机取15条1 cm~2 cm长的根在显微镜下进行观察,并按Trouvelot*的方法记录侵染情况,再用菌根侵染程度计算丛枝菌根真菌侵染率F%。
植物总氮[10]: 采用德国Elementar公司Vario EL III元素分析仪测定。
植物全磷[11]:采用H2O2-H2SO4消解法测定。H2O2-H2SO4消解之后定容,转移溶液至比色管,钒钼酸铵滴定显色,紫外分光光度法测定440 nm处吸光度。
1.4 数据分析
采用Excel软件对数据进行处理,SPSS 19.0软件对数据进行方差和相关性分析(P=0.05或0.01)。
2 结果与讨论
2.1 接种AM真菌的菌根侵染率及其对湿生植物生长的影响
由表2可知,千屈菜接种CE的侵染率高于接种GM和RE,为39%。旱伞草接种3种AM真菌的侵染率差异不显著,为38.5%~44.5%(P>0.05)。黄花鸢尾接种GM的菌根侵染率要高于接种CE和RE的处理,为38%。AM真菌对宿主植物的侵染程度是其对宿主植物产生影响的主要因素之一[12],不同的AM真菌与植物之间存在不同的亲和力[13],不同的宿主植物对同一种AM真菌也会表现出不同的依赖性[14]。

表2 不同湿生植物接种AM真菌的菌根侵染率
注:1、相同字母表示没有显著性,不同字母表示在P<0.05水平异常显著; 2、GM-摩西球囊霉;CE-幼套球囊霉;RE-根内球囊霉; CK-空白
AM真菌与植物根系的结合,能促进植物营养代谢,增加植物的生物量[15]。与对照相比,千屈菜接种AM真菌,植物地下部分均有增长,增长幅度21.0%~31.4%,而地上部分只有接种RE有一定的生物量增长。从总生物量来看,千屈菜接种RE的提高幅度最大,为17.7%。旱伞草接种AM真菌后,植物地下部分生物量均上升,而地上部分只有GM和RE是上升的,其中接种GM对旱伞草总生物量的促进效果最明显,提高了29.8%。黄花鸢尾接种AM真菌后,总生物量有6.4%~23.6%的提高。
植物地下部分生物量的增加,可以增强植物根系对土壤的锚固作用和加筋作用以及扩大植物根系对土壤的包裹量,提高土壤的抗冲刷能力[16,17]。植物地上部分生物量的增加,可以提高植物氮磷吸收量地上与地下部分的比例,有利于土壤氮磷向地上的转移。从接种AM真菌促进植物生物量增长的角度,湿生植物与AM真菌的最佳组合为:千屈菜-RE、旱伞草-GM、黄花鸢尾-GM。

表3 AM真菌对湿生植物生物量的影响

表4 侵染率与植物生物量的相关性分析
**表示相关性在P<0.01水平非常显著;*表示相关性在P<0.05水平显著
由表4可知,侵染率与植物地上部分生物量、总生物量和植物地下部分生物量之间的相关性并不显著。总生物量与植物地下部分的相关性系数(0.677)大于与地上部分(0.577,P<0.05水平),说明植物接种AM真菌主要是通过促进植物地下部分生物量的增长,从而使得植物总生物量增加。
2.2 接种AM真菌对湿生植物氮吸收的影响
土壤中氮的去除主要有两个途径:植物吸收和土壤微生物的硝化-反硝化作用[18]。研究者们对植物吸收在湿地脱氮除磷的贡献率研究中,得出的结果差异较大,从0.7%到90%[19-21],说明不同的湿生植物之间氮吸收能力差异较大。
与对照相比,接种GM和RE的千屈菜地上部分N含量有所提高,且RE效果更显著,N含量为1.78%。接种RE的千屈菜地下部分N含量(0.73%)稍高于对照(0.722%),而其他2种处理,地下部分N含量都低于对照;从植物TN量来看,只有接种RE的要高于CK,为392.4 mg/pot,较CK提高了24.0%,顺序为:RE>CK >GM >CE。
对于旱伞草,地上部分的3种AM真菌处理均低于对照。地下部分接种GM的 N含量为0.815%,高于CK(0.805%),而其它也都低于对照。植物TN量方面,接种RE和GM均高于对照,接种CE低于对照,其中RE最高(311.89 mg/pot),较CK提高了15.7%,顺序为:RE>GM>CK >CE。
黄花鸢尾接种GM和CE后,地上部分N含量较CK有小幅度的提高。地下部分N含量,接种GM的高于CK,而接种CE和RE的均低于对照。黄花鸢尾的TN量差异较显著,与CK相比,除了RE均有所提高,其中GM最高(399.38 mg/pot),提高了39.0%,顺序依次为:GM >CE >CK > RE。
从结果来看,AM真菌对植物N吸收的促进作用在不同湿生植物间具有较强的特异性,适合的AM真菌-植物搭配才会产生促进N吸收的效应,如千屈菜接种RE后TN量提高了24.0%,而千屈菜接种CE后TN量反而低于对照。不仅如此,AM真菌对植物地上、地下部分的N吸收的影响也不同,如黄花鸢尾接种RE后地上部分TN量较CK减少了29.9%,而地下部分TN量较CK增长了32.9%。
由表6可知,侵染率与植物地上部分TN量、地下部分TN量相关性均不显著。相比地下部分TN量,地上部分TN量与植物TN量的相关性更加显著,因此可以看出植物TN的差异主要表现在植物地上部分TN量的差异,说明植物接种AM真菌后,主要促进了植物地上部分的TN量。
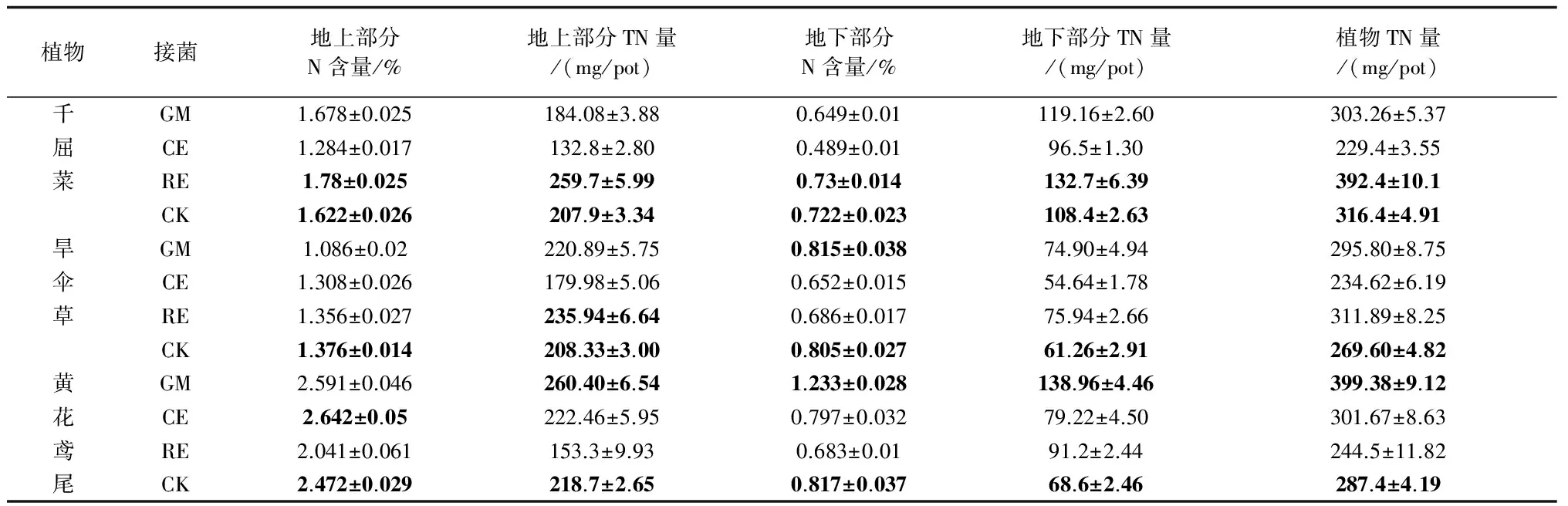
表5 AM真菌对植物N吸收的影响
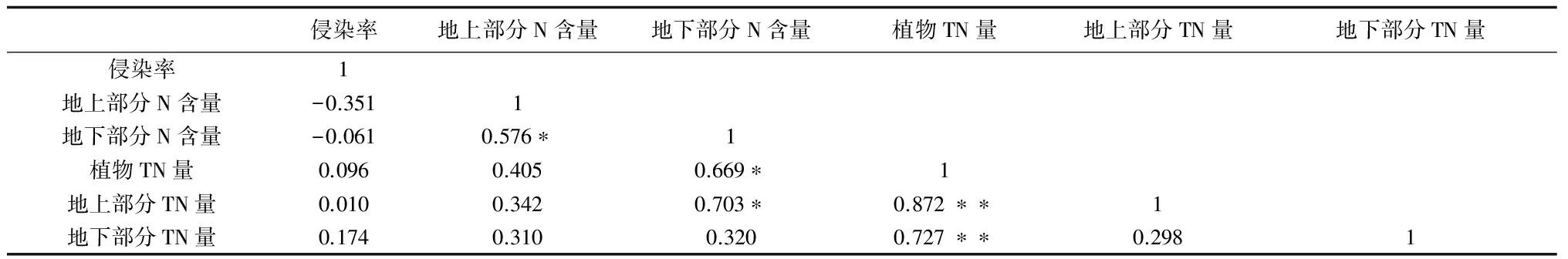
表6 AM真菌侵染率与植物N的相关性分析
**表示相关性在P<0.01水平非常显著;*表示相关性在P<0.05水平显著
2.3 接种AM真菌对湿生植物磷吸收的影响
土壤中磷的减少主要通过植物的吸收作用,因此植物体内磷含量的高低可以间接表征土壤磷的变化[22]。AM真菌根外菌丝吸收磷量最高可达共生植物体内总磷量的90%[23]。Simth等[24]发现低磷胁迫的条件下,菌根植物的吸磷量达到非菌根植物的十倍之多。
接种AM真菌后,千屈菜地上和地下部分的P含量以及植物TP量均显著高于空白对照,接种RE的地上部分P含量最高(3.83 mg/g),比空白CK(2.61 mg/g)高出46.8%。地下部分P含量,RE最高,为3.11 mg/g;植物TP量,依然是接种RE最高,为112.2 mg/pot,较CK提高了62.6%,顺序依次为:RE>CE>GM>CK。
旱伞草地上和地下部分的P含量在接种3种AM真菌后,地上部分P含量均低于未接种处理,而地下部分P含量均高于CK。地上部分TP量只有GM略有增长,地下部分TP量,RE(26.0 mg/pot)远远高于CK(11.6 mg/pot)。总的来看,植物TP量接种GM最高,为74.2 mg/pot,较CK提高了33.5%,顺序依次为:GM>RE>CK>CE。
黄花鸢尾接种AM真菌后,3种处理的地上部分P含量均低于CK,而地下部分P含量以及植物TP量都高于CK。接种CE的植物TP量最高,为39.8 mg/pot,较CK提高了37.2%,顺序依次为:CE>RE>GM>CK。
与N的吸收促进效应类似,接种AM真菌对5种湿生植物既表现出植物品种间的差异,也表现出地上、地下部分的不同。但在地上和地下部分的P含量方面,3种真菌对某种植物接种后会表现大体一致的升降趋势,如千屈菜接种3种AM真菌后地上部分P含量较CK均有上升,而旱伞草接种3种AM真菌后地上部分P含量较CK均有下降。
相较于地上部分P含量的负相关,侵染率与植物地下部分P含量相关性系数为正相关,说明接种AM真菌主要促进了植物根系对P的吸收,P主要富集在植物根系中。植物TP量与地下部分TP量相关性非常显著(P<0.01),且大于与地上部分TP量的,说明接种AM真菌后,对植物地下部分P吸收的促进作用导致了植物TP量的提高,湿生植物地下部分TP量对植物TP量的贡献更大。
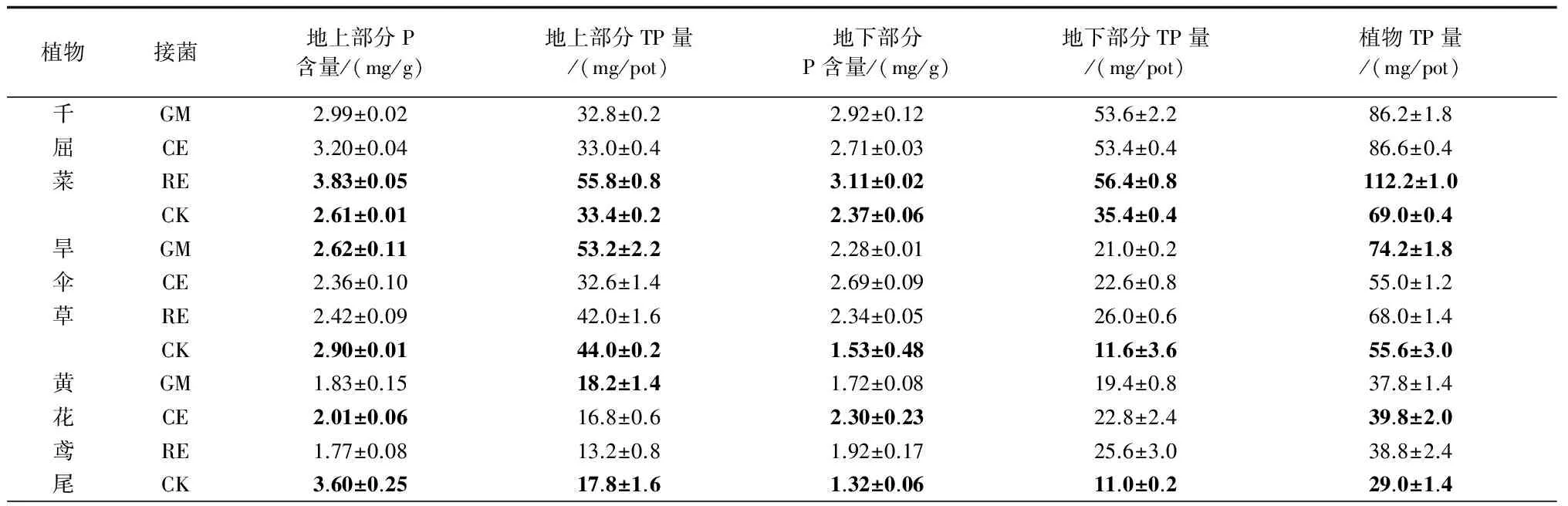
表7 AM真菌对植物P吸收的影响

表8 AM真菌侵染率与植物P的相关性分析
**表示相关性在P<0.01水平非常显著;*表示相关性在P<0.05水平显著
3 结论
(1)AM真菌对植物生长、N吸收和P吸收的影响不仅表现出植物品种之间的差异,而且植物地上和地下部分的差异也比较明显。不同的AM真菌对同一种植物的侵染率及其对植物生长、氮磷吸收同样具有特异性。
(2)综合考虑接种AM真菌对植物生长和N、P吸收的影响,最佳的AM真菌-植物组合为:千屈菜-RE,旱伞草-RE,黄花鸢尾接种-GM。
(3)接种最佳组合的AM真菌后,三种植物的生物量提高了17.7%~29.8%,TN量提高了15.7%~39.0%,TP量提高了22.3%~62.6%。
[1] 马安娜. 北京地区人工湿地优势植物筛选及净化效果研究[学位论文]. 北京:首都师范大学,2007.
[2] 海华, 尚德静, 李庆伟. 真菌发酵生产γ-亚麻酸的研究进展. 工业微生物, 2002, 32(4): 46-50.
[3] Schwarzott D, Walker C, Schüssler A. Glomus, the largest genus of thearhuscularmycorrhizalfungi (Glomales), is nonmonophyletic. Mol Phylogenet Evol, 2001, 21(2):190-197.
[4] Dodd JC, Dougall TA, Clapp JP. The role ofarbuscularmycorrhizalfungi in plant community establishment at Samphire Hoe, Kent, UK-the reclamation platform created during the building of the Channel tunnel between France and the UK. Biodiversity and Conservation, 2002, 11: 39-58.
[5] 石伟琦, 丁效东,张士荣. 丛枝菌根真菌对羊草生物量和氮磷吸收及土壤碳的影响. 西北植物学报,2011,31(2):0357-0362.
[6] AI-Karaki GN, Hammad R, Rusan M. Response of two tomato cultivars differing in salt tolerance to inoculation withmycorrhizalfungi under salt stress. Mycorrhiza, 2001, 11: 43-47.
[7] 钟敏,黄益宗,伍文等.丛枝菌根真菌群落对白三叶草植物生物量磷吸收和土壤磷酸单酯酶活性的影响.农业环境科学学报,2012,3(9):1770-1776.
[8] 傅生杰. AMF对植被混凝土植物生长和截污功能的强化作用[学位论文]. 哈尔滨: 哈尔滨工业大学, 2013.
[9] 王幼珊,张淑彬,张美庆.中国丛枝菌根真菌资源与种质资源. 北京:中国农业出版社,2012. 165-168.
[10] Wang H, Wang L, Zhang YN,etal. The variability and causes of organic carbon retention ability of different agricultural straw types returned to soil, 2016, Environmental Technology, doi: http://dx.doi.org/10.1080/09593330.2016.1201545.
[11] Thomas RL, Sheard RW, Moyer JR. Comparison of conventionaland automated procedures for nitrogen, phosphorous, and potassium analysis of plant material using a single digestion. Agronomy Journal,1967, 57:240-243.
[12] Gange AC, Ayres RL. On the relation betweenArbuscularmycorrhizalcolonization and plant ‘benefit’. Oikos, 1999, 87 (3):615-621.
[13] Klironomos JN. Variation in plant response to native and exoticarbuscularmycorrhizalfungi. Ecology,2003,84(9):2292-2301.
[14] Tawaraya K,Tokairin K,Wagatsuma T. Dependence ofAlliumfistulosumcultivarson thearbuscularmycorrhizalfungus,Glomusfasciculatum. Applied Soil Ecology,2001,17:119-124.
[15] 吉春龙,田萌萌,马继芳等. 丛枝菌根真菌对植物营养代谢与生长影响的研究进展. 浙江师范大学学报(自然科学版),2001, 33(3): 303-309.
[16] 张金池,减廷亮, 曾锋. 岩质海岸防护林树术根系对土壤抗冲性的强化效应.南京林业大学学报,2001,25(1):9-12.
[17] 徐少君,曾波,类淑桐等. 三峡库区几种耐水淹植物根系特征与土壤抗水蚀增强效应. 土壤学报,2011, 28(1):160-166.
[18] 次仁旺珍. 土壤氮素循环及其对土壤氮损失的影响.中国农业信息, 2015, 12: 122-125.
[19] Gottschall N, Boutin C, Crolla A,etal. The role of plants in the removal of nutrients at a constructed wetland treating agricultural (dairy) wastewater, Ontario, Canada. Ecological Engineering, 2007, 29(2):154-163.
[20] Rogers KH, Breen AJ, Chick AJ. Nitrogen removal in experimental wetland treatment systems: evidence for the role of aquatic plants. Research Journal of the Water Pollution Control Federation, 1991, 63(7): 934-941.
[21] 金卫红,付融冰,顾国维.人工湿地种植物生长特性及其对TN和TP的吸收. 环境科学研究,2007,20(3): 75-80.
[22] 尹逊霄,华珞,张振贤等. 土壤中磷素的有效性及其循环转化机制研究.首都师范大学学报(自然科学版), 2005, 26(3):95-101.
[23] 刘进法,夏仁学,王明元等.从枝菌根促进植物根系吸收难溶态磷的研究进展. 亚热带植物科学,2007, 36 (4):62-66.
[24] Smith SE, Read DJ.Mycorrhizalsymbiosis[M]. 2nd ed. San Diego: Academic, 1997.
Effects of Arbuscular mycorrhizal fungi on absorption of nitrogen and phosphorous in aquatic plants
DUAN Hao, WANG Lei, CAO Zhan-bo>
State Key Laboratory of Pollution Control and Resource Reuse,College of Environmental Science andEngineering,Tongji University,Shanghai 200092,China
Arbuscularmycorrhizal(AM) fungi are a class of microorganisms, capable of symbiosis with most terrestrial plants and improving plant growth and adsorption of nitrogen and phosphorus. Wetland plants play a decisive role in the purification process of wetland pollution, but there are few reports on improving the absorption capacity of nitrogen and phosphorus of wet plants by AM fungi. In this study, three kinds of wetland plants were selected, such asLythrumsalicaria,CyperusalternifoliusandIriswilsonii. In the pot culture, they were inoculated withRhizophagusintruradices(RE),Glomusmosseae(GM) andClaroideoglomusetunicatum(CE) fungi, aboveground, underground and whole plant biomass and nitrogen and phosphorus uptake of different plant species were compared with CK. The results showed that the effects of AM fungi on plant growth and adsorption of nitrogen and phosphorus were different between and inside plants, and the promotion and inhibition effects were also different. The best combinations of AM fungi and plant were:Lythrumsalicaria-RE,Cyperusalternifolius-RE,Iriswilsonii-GM. The plant biomass, TN and TP of the three plants were increased by 17.7%~29.8%, 15.7%~39.0% and 22.3%~62.6%, respectively after inoculated with the best AM fungi. This study provided a new alternative for enhancing nitrogen and phosphorus uptake capacity of wetland plants in the future.
AM fungi; wetland plants; colonization rate; plant biomass; nitrogen and phosphorous uptake
10.3969/j.issn.1001-6678.2016.06.001
上海市重大科技攻关项目(14231200404);国家自然科学基金项目(21577101)。
段灏(1991~),男,硕士研究生。E-mail: 14_duanswer@tongji.edu.cn。
*通信作者: 王磊教授。电话:+86 021 65989079,E-mail: celwang@tongji.edu.cn。

