高产洛伐他汀棒曲霉菌株的筛选、鉴定及发酵条件优化
章 婷, Bedelkhan Almagul, 郑婕施, 韩肖飞, 任 浩, 蒋冬花
浙江师范大学 化学与生命科学学院, 浙江 金华 321004
高产洛伐他汀棒曲霉菌株的筛选、鉴定及发酵条件优化
章 婷, Bedelkhan Almagul, 郑婕施, 韩肖飞, 任 浩, 蒋冬花*
浙江师范大学 化学与生命科学学院, 浙江 金华 321004
从不同生境(食品、土壤、空气、有机质等)收集到的自然发酵样品中分离得到150株曲霉属菌株。用高效液相色谱(HPLC)法检测发酵液中洛伐他汀(Lovastatin)含量,筛选获得1株稳定高产Lovastatin的曲霉菌株(编号:Ac-32)。根据菌落形态特征并结合18S rDNA测序,鉴定其为棒曲霉(Aspergillusclavatus)。通过摇瓶发酵单因素实验优化了碳氮源种类、碳氮源含量、碳氮比(C/N)、发酵温度、初始pH、转速、种龄和接种量,确定了棒曲霉菌株Ac-32 摇瓶发酵产Lovastatin的适宜条件为:乳糖为碳源、蛋白胨为氮源、碳源含量为100 g/L、氮源含量为12 g/L、碳氮比(C/N)为15∶1.8、温度28 ℃、转速180 r/min、初始pH 5.2、种龄4 d、接种量6%。采用Minitab 17 软件的P-B实验设计法,筛选对Lovastatin产量有显著影响的因素为:温度、pH、碳源含量和氮源含量。根据P-B实验结果,运用响应面法分析,确定棒曲霉菌株Ac-32产Lovastatin的最优条件为:碳源含量100 g/L,氮源含量11.8 g/L,温度28 ℃,pH 5.2。在此条件下,Lovastatin最高产量为236.221 μg/mL。
棒曲霉; 洛伐他汀; 响应面; 发酵条件
洛伐他汀(Lovastatin)是一种羟甲基戊二酞辅酶A还原酶的强效抑制剂,有强效的降胆固醇、降血脂作用,因在高血脂、动脉粥样硬化及心脑血管疾病的防治中作用机理明确、临床疗效显著,已成为治疗心血管疾病的最畅销药品之一[1,2]。此外,其可通过限制胆固醇和脂肪酸合成而抑制肿瘤细胞增长,还有报道称其可用于抑郁症的治疗[3-6]。
曲霉是重要的工业微生物资源[7,8]。Lovastatin是曲霉(Aspergillus)的次级代谢产物[2,4]。1980年,Alberts等[9]从土曲霉(A.terreus)中提取出Lovastatin。美国Merck公司将其作为降脂药投放市场,成为降血脂药物研究进展的里程碑[9,10]。随后,美国、日本等国家以发酵方法开发出一系列Lovastatin药物。相比之下,我国在利用降脂曲霉产Lovastatin的研发及生产中,普遍存在Lovastatin产量低、生产成本高等问题。因此,选育稳定高产Lovastatin的曲霉菌株对并其发酵工艺条件进行优化[10,11],具有现实意义[12]。
1 材料与方法
1.1 材料
1.1.1 菌株、试剂、及培养基
曲霉属菌株:从不同生境(食品、土壤、有机质等)收集的自然发酵样品,经分离筛选得到曲霉属纯菌株。
色谱级乙腈购自德国Fisher Scientific 公司,色谱级甲醇购自德国Merck公司,分析纯磷酸购自国药集团化学试剂有限公司。
PDA培养基(g/L):马铃薯200、葡萄糖20、琼脂15、水、pH 5.5。
种子培养基(g/L):马铃薯200、葡萄糖20、牛肉膏5、水、pH 5.2。
发酵培养基(g/L):乳糖100、蛋白胨12、MgSO4·7 H2O 1、KH2PO41、NaCl 2、水、pH 5.2。
1.2 方法
1.2.1 曲霉菌株的分离纯化
从食品、土壤、有机质等发酵样品表面挑取少量菌丝接入PDA培养基平板表面,28 ℃培养2 d ~3 d,显微镜观察具有曲霉的典型特征,挑出纯化3次得性状均一的曲霉纯菌株,编号保存于25%的甘油中,放置-40 ℃冰箱中备用。
1.2.2 高产Lovastatin曲霉菌株的筛选
保存的曲霉属各菌株在PDA培养基上28 ℃活化培养3 d后,取2菌饼(直径0.8 cm)接种于种子培养基(装液量50 mL/250 mL三角瓶)中,28 ℃、180 r/min培养2 d,然后按6%接种量转接到发酵培养基中,28 ℃、180 r/min培养7 d,发酵液用于检测Lovastatin的含量[13],从中筛选高产Lovastatin曲霉菌株。
1.2.3 HPLC法检测发酵液中Lovastatin含量
取发酵液0.4 mL,加入甲醇1.6 mL,超声20 min,50 ℃水浴2 h,3 000 r/min离心3 min,取上清液过有机膜,HPLC法检测。色谱条件:Agilent Prep-C18 液相色谱柱,检测波长:λ= 237 nm,柱温28 ℃。
1.2.4 菌株鉴定
显微镜观察菌丝、分生孢子头、分生孢子梗、顶囊、分生孢子等形态特征,并拍照。提取曲霉菌株Ac-32的基因组DNA,扩增18S rDNA基因,送上海生物工程公司测序。根据形态特征、18S rDNA基因序列,参考曲霉属《The GenusAspergillus》分种检索表,确定目的菌株的分类地位。
1.2.5 培养基配方及摇瓶发酵条件优化
菌株活化、种子液和发酵液制备方法同1.2.2。采用单因素实验对培养基配方(碳源种类,氮源种类,碳源含量,氮源含量,碳氮比C/N)和发酵条件(温度、初始pH、摇床转速、接种量、种龄)进行优化(实验做3个平行)。
1.2.6 筛选影响Lovastatin产量的关键因素
采用Minitab 17 软件的Plackett-Burman实验设计法,以温度(X1),pH(X2),碳源含量(X3),氮源含量(X4),转接量(X5),转速(X6),种龄(X7)进行7因子2水平的设计,以Lovastatin产量(Y)为响应值,筛选影响Lovastatin产量的关键因素。各因子的编码水平和取值如表1所示。

表1 Plackett-Burman实验设计
1.2.7 响应面方法优化培养基配方及发酵条件
根据所筛选出的影响显著的关键因素,运用Design Expert软件设计响应面Box-Behnken实验,以Lovastatin产量为响应值,对实验数据进行分析[14-16],建立回归方程并描述各因子对响应值的影响,用响应面图直观呈现分析结果,同时求出响应值最大时各因子的水平[16]。
2 结果与分析
2.1 从不同生境中分离纯化得到的曲霉菌株
从各地不同生境收集的自然发酵样品(食品、土壤、有机质等)中分离纯化得到150株曲霉。编号后加25%甘油保藏于-40 ℃冰箱中。不同曲霉菌株的菌落、分生孢子头、分生孢子梗、顶囊、分生孢子等形态特征各不相同,表明来源于不同生境的曲霉菌株具有丰富的多样性(图1)。
2.2 高产Lovastatin曲霉菌株的筛选
用HPLC法对150株曲霉纯菌株发酵液进行Lovastatin产量检测,其中有46株曲霉菌株检测不到Lovastatin,102株曲霉菌株Lovastatin产量分布在10 μg/mL ~50 μg/mL范围,2株曲霉菌株产量达到70 μg/mL以上,图2为50株代表性曲霉菌株的Lovastatin产量统计分析结果,表明不同曲霉菌株Lovastatin产量存在显著差异。经比较分析32号曲霉菌株的Lovastatin产量最高最稳定,达75.382 μg/mL,并命名为Ac-32,后续以该菌株为实验的出发菌株。
2.3 曲霉菌株Ac-32的鉴定结果
2.3.1 曲霉菌株Ac-32的形态特征
曲霉菌株Ac-32 在PDA平板上培养5 d后,菌落呈灰蓝色,边缘白色,菌落直径约45 mm,质地粉粒状,有环形沟纹(图3A)。显微镜下观察,菌丝光滑,有隔膜,直径6 μm~8 μm分支状;分生孢子头呈棒形,长度达300 μm,直径达200 μm;分生孢子梗茎长短不一,500 μm~ 1 000 μm不等,直径30 μm~50 μm;顶囊膨大成为棍棒形,长度达250 μm,直径50 μm~60 μm;产孢结构单层,瓶梗密集着生于顶囊的全部表面,(8~12) μm×(2~3) μm(图3B、3C);分生孢子暗蓝绿色,椭圆形,表面光滑,(3~4.5) μm×(2.5~3) μm(图3D);未见菌核及有性阶段。


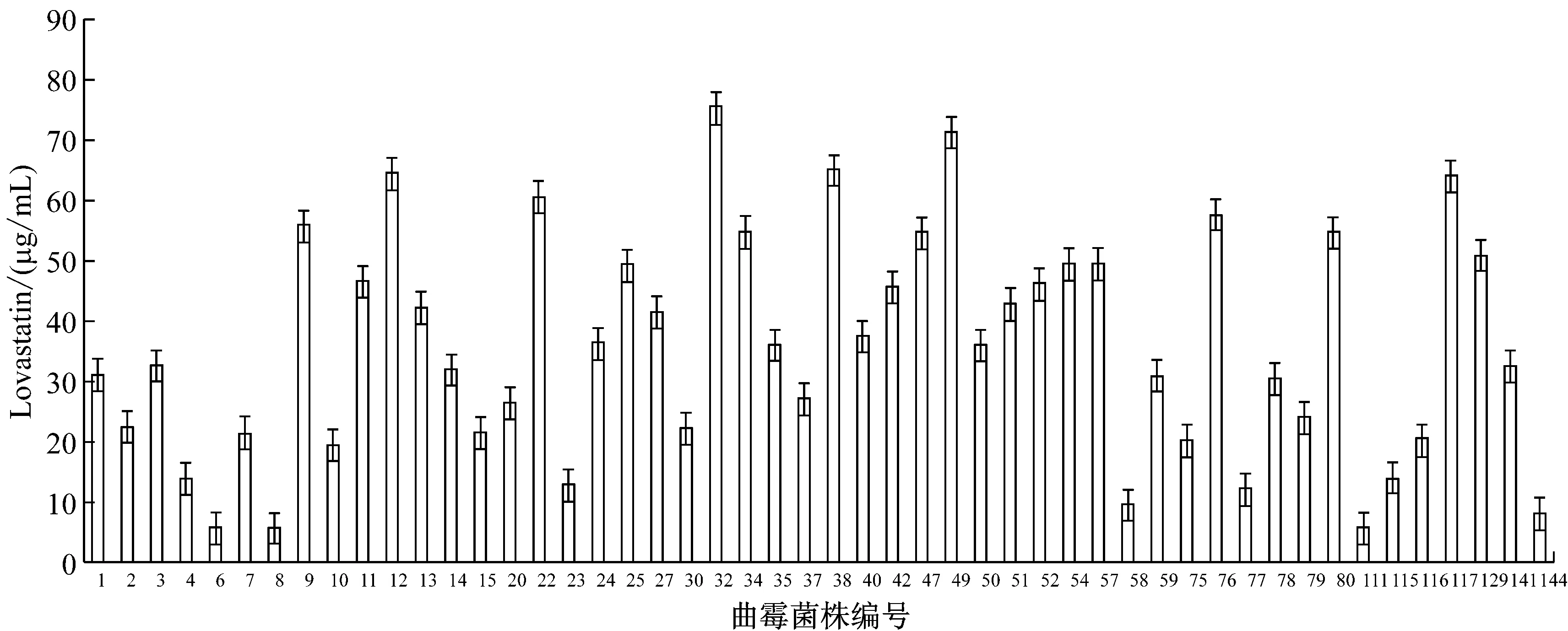
图2 50株代表性曲霉菌株的Lovastatin产量
2.3.2 曲霉菌株Ac-32的18S rDNA序列分析
经上海生工公司测序,曲霉菌株Ac-32的18S rDNA序列长度为1 329 bp(图3E,序列结果未显示),系统发育树分析表明,与棒曲霉(A.clavatus)的相似度最高,达99%(图3F)。
2.3.3 曲霉菌株Ac-32的鉴定结果
根据曲霉菌株Ac-32的形态特征,参考曲霉属分种检索表,鉴定为棒曲霉(A.clavatus)。
2.4 培养基配方及发酵条件优化
以发酵液中Lovastatin含量为指标,经单因素实验优化,曲霉菌株Ac-32产Lovastatin的适宜条件为:以乳糖为碳源、蛋白胨为氮源、碳源含量为100 g/L、氮源含量为12 g/L、C/N为15∶1.8、温度为28 ℃、pH为5.2、摇床转速为180 r/min、种龄为4 d、接种量为6%时,曲霉菌株Ac-32发酵产Lovastatin的水平最高,达144.021 μg/mL,比优化前提高了1.91倍(图4)。


(A) 菌落形态; (B) 分生孢子头自然生长形态; (C) 棒状分生孢子头; (D) 分生孢子; (E) 18S rDNA 的PCR产物; (F) 系统发育树图3 曲霉菌株Ac-32的菌落形态、显微特征、18S rDNA扩增及系统发育树分析
2.5 影响曲霉菌株Ac-32发酵产Lovastatin的关键因素
采用Minitab 17 软件的P-B实验设计法,以温度(X1)、pH(X2)、碳源含量(X3)、氮源含量(X4)、接种量(X5)、转速(X6)和种龄(X7)作为影响因素进行实验设计,Lovastatin产量(Y)为响应值,进行7因子2水平的Plackett-Burman设计,筛选影响曲霉菌株Ac-32发酵产Lovastatin的关键因素。
实验方案及结果如表2所示,用Minitab 17 软件对实验数据进行分析,建立一次回归方程:Y = 72.317 + 5.155 X1+ 5.104 X2+ 3.583 X3+ 0.812 X4-1.389X5-1.117X6-1.283 X7。

表2 Plackett-Burman设计实验方案及结果



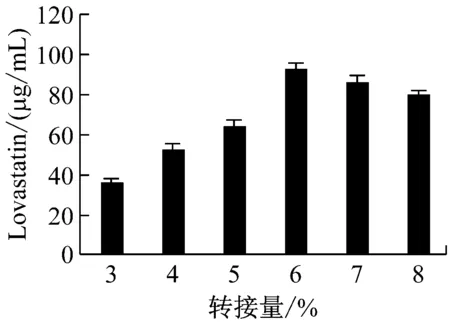
图4 不同培养基配方和发酵条件对曲霉菌株Ac-32产 Lovastatin的影响
表3中温度和pH的P值均小于0.01,差异极显著;碳源含量和氮源含量的P值分别为0.001和0.027(P<0.05),差异显著,确立这4个因素为影响Lovastatin合成的显著因子。校正决定系数R-sq(adj)= 97.16%,表明Lovastatin产量的97.16%的变异分布在方程的七个因子中。相关系数R-sq(pred)= 90.71%,表明该方程的预测值与实际值之间拟合度较好。
除以上4个显著因素外,其他因素的变化对Lovastatin的发酵产量影响不大,所以实验采用同一结合P-B影响Lovastatin产量的单因素实验,选温度、pH、碳源含量、氮源含量 4种显著的关键因素,分别用A、B、C、D来定义,编码水平与取值如表4所示,运用Design Expert软件设计响应面Box-Behnken实验,以Lovastatin产量为响应值,设计4因素3水平共进行27组实验,实验结果如表5所示。

表3 P-B实验设计因素回归方程系数显著性检验
注:R-sq=98.97%,R-sq(adj)= 97.16%,R-sq(pred)= 90.71%。
条件,即:转接量为6%,转速为180 r/min,种龄为4 d。
2.6 响应面法优化培养基配方和发酵条件
2.6.1 响应面回归方程建立与方差分析
由Design Expert软件设计响应面Box-Behnken以Lovastatin为响应值进行分析后,软件给出的回归方程为:Lovastatin=+234.14-7.05A+4.31B-13.41C+11.48D-3.20AB +9.19AC-8.65AD-5.40BC+5.80BD-3.96CD-21.53A2-32.51B2-11.11C2-12.30D2。

表4 响应面设计因子取值表
由表6方差分析表可知:失拟不足(P=0.1975>0.05),而模型P值<0.001,达到极显著,说明该模型对实验分析具有意义。各因子的P值均小于0.05,均有显著性。模型R-Squared=0.9609,表明该方程的预测值与实际值之间拟合度较好,模型的矫正决定系数Adj R-Squared=0.9152,说明该模型可靠性高,能有效预测Lovastatin的总变异。

表5 响应面(RSM)实验项目及结果
注:因子:4,基础次数:27,中心点:3,每次实验设置三个平行组。
2.6.2 响应面分析
由图5可知,当温度在(25,27.5)区间,pH在(4.9,5.2)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当温度在(27.5,30)区间,pH在(5.2,5.5)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。
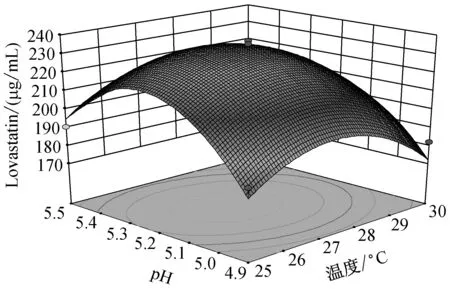
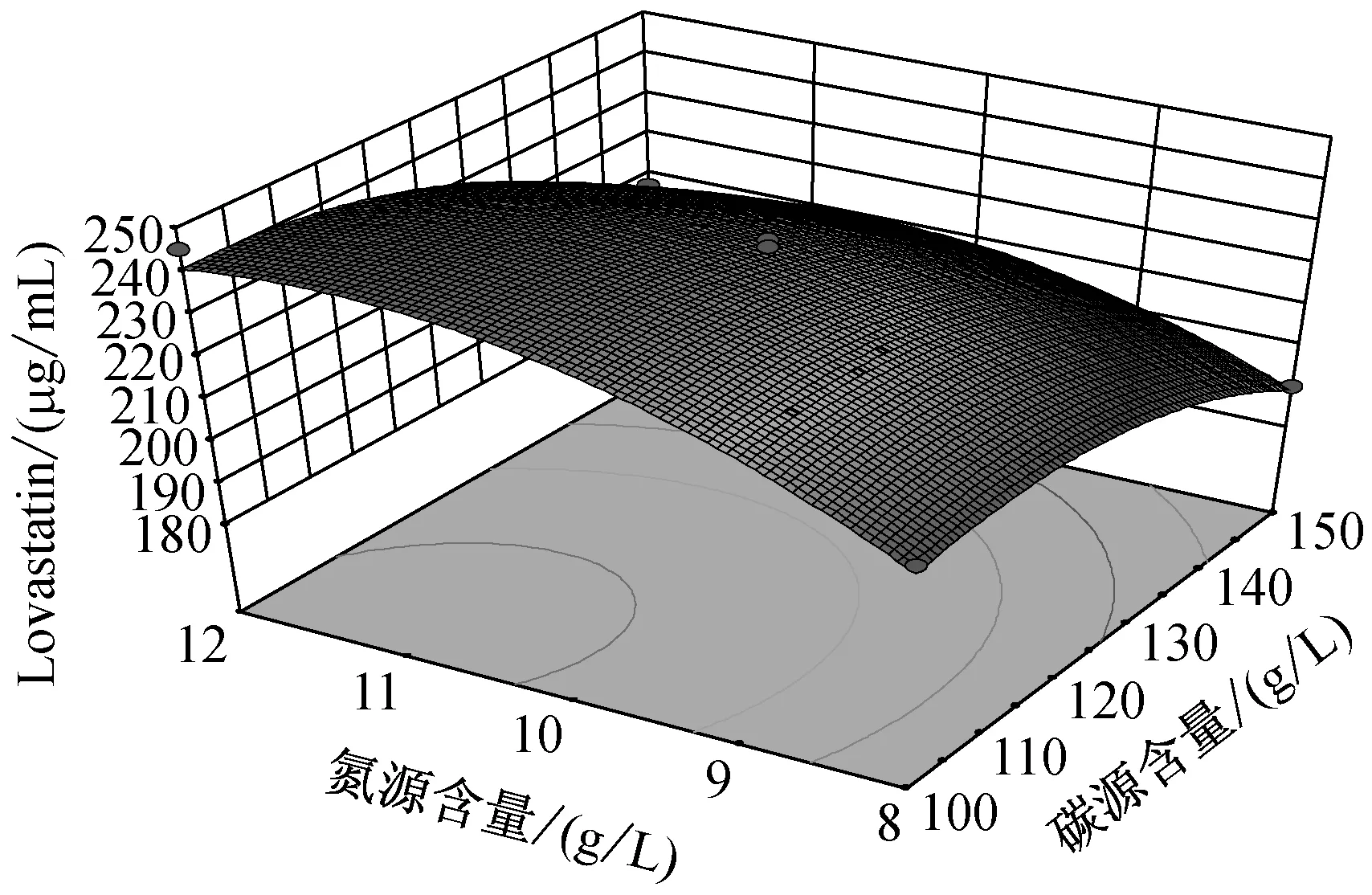
注:**极显著(P<0.01);*显著(0.01 由图6中可知,当温度在(25,27.5)区间,碳源含量在(100,125)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当温度在(27.5,30)区间,碳源含量在(125,150)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。 由图7中可知,当温度在(25,27.5)区间,氮源含量在(8,10)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当温度在(27.5,30)区间,氮源含量在(125,150)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。 由图8中可知,当pH在(4.9,5.5)区间,碳源含量在(100,125)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当温度在(5.2,5.5)区间,碳源含量在(125,150)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。 由图9中可知,当pH在(4.9,5.5)区间,氮源含量在(8,10)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当温度在(5.2,5.5)区间,氮源含量在(10,12)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。 由图10中可知,当碳源含量在(100,125)区间,氮源含量在(8,10)区间内,Lovastatin的单位产量随着两者的升高而升高,呈现正相关。而当碳源含量在(125,150)区间,氮源含量在(10,12)区间内,Lovastatin单位产量随着两者的升高而降低,呈现负相关。 为了更清晰的了解实验的优化结果,利用Box-Behnken软件根据数据分析得出的理论最优条件为:温度28.18 ℃,pH 5.24,碳源含量109.55 g/L,氮源含量11.78 g/L,此时达到最大值236.221 μg/mL。 2.6.3 响应面以及等高线结果验证试验 为验证实验的可靠性,采用上述最优发酵条件进行Lovastatin发酵验证实验,考虑到实际操作的现实性,将最佳条件修正为温度28 ℃,pH 5.2,碳源含量100 g/L,氮源含量11.8 g/L,3次平行实验的Lovastatin产量分别为210.645 μg/mL,233.813 μg/mL,229.421 μg/mL,Lovastatin平均产量为224.626 μg/mL,实际平均值与预测值无显著差别,证明此次实验参数可靠,具有实用价值。 从不同生境(食品、土壤、空气、有机质等)的自然发酵样品中分离筛选到1株高产Lovastatin曲霉菌株Ac-32,经培养基配方和培养条件优化,发酵液中Lovastatin产量可达224.626 μg/mL。目前国内外生产Lovastatin大多用红曲霉和土曲霉,本文筛选到的菌株经鉴定为棒曲霉,丰富了生产Lovastatin的菌种资源。 Plackett-Burman法确定对棒曲霉液态发酵产Lovastatin影响显著的四个因素分别是温度,pH,碳源含量和氮源含量。响应面Box-Behnken法优化后的条件为:温度28 ℃,pH 5.2,碳源含量100 g/L,氮源含量11.8 g/L,转接量为6 %,转速180 r/min,种龄为4 d。优化后的Lovastatin产量比优化前提高了2.98倍。 魏巍[17]确定了红曲霉发酵合成Lovastatin的最优培养基配方和发酵工艺,Lovastatin产量为142.51 μg/mL。刘爱英[18]等用紫外诱变方式处理红曲霉,诱变后菌株摇瓶发酵产Lovastatin水平为219.9 μg/mL。童振宇[19]等对紫色红曲霉液态发酵培养基进行了优化,使Lovastatin产量达到297.4 μg/mL,而利用棒曲霉发酵产Lovastatin尚未见报道,试验数据表明,选用的棒曲霉菌株具有良好的应用前景。 [1] Satoshi K. Lovastatin rescues human and mice cartilage disorders [J]. Journal of Cell Communication and Signaling, 2015, 9 (1): 95-98. [2] Guo CJ, Wang CCC. Recent advances in genome mining of secondary metabolites inAspergillusterreus[J]. Frontiers in Microbiology, 2014, 5(1): 1-13. [3] Guo CJ, Sun WW, Bruno KS,etal. Molecular genetic characterization of terreic acid pathway inAspergillusterreus[J]. Organic Letters, 2014, 16: 5250-5253. [4] Boruta T, and Bizukojc M. Culture-based and sequence-based insights into biosynthesis of secondary metabolites byAspergillusterreus ATCC 20542 [J]. Journal of Biotechnology, 2014, 175: 53-62. [5] Salagre E, Fernandes BS, Dodd S,etal. Statins for the treatment of depression: A meta-analysis of randomized, double-blind, placebo-controlled trials [J]. Journal of Affective Disorders, 2016, 200: 235-242. [6] Notarnicola M, Barone M, Francavilla A,etal. Lovastatin, but not orlistat, reduces intestinal polyp volume in an ApcMin/+ mouse model [J]. Oncology Reports, 2016, 36 (2): 893-900. [7] Robles JE, Suarez IR, Diaz JE,etal. Secondary metabolites isolated from the strainAspergillusterreus[J]. Chemistry of Natural Compounds, 2014, 50 (6): 1101-1102. [8] Krull R, Bley T, Filaments in bioprocesses preface [C]. Advances in Biochemical Engineering Biotechnology, 2015, 149: 5-7. [9] Alberts AW, Chen J, Kuron G,etal. Mevinolin, a highly potent competitive inhibitor of hydroxymethyl -glutaryl-coenzyme a reductase and cholesterol-lowering agent [J]. Proceedings of the National Academy of Sciences, 1980, 77(7): 3957-3961. [10] Huang XN, Lu XF, Li YM,etal. Improving itaconic acid production through genetic engineering of an industrialAspergillusterreusstrain [J]. Microbial Cell Factories, 2014, 13: 1-9. [11] Ahmed A, Mukhtar H, Gohar UF,etal. Production of Lovastatin fromAspergillusterreusthrough submerged fermentation [J]. Pakistan Journal of Botany, 2013, 45(5): 1795-1800. [12] 黄卓, 李东栋. 洛伐他汀最新研究进展[J]. 中国生化药物杂志, 2010(2): 144-147. [13] Abd Rahim MH, Hasan H, Montoya A,etal. Lovastatin and (+)-geodin production byAspergillusterreusfrom crude glycerol [J]. Engineering in Life Sciences, 2015, 15(2): 220-228. [14] El-Naggar NE, Haroun SA, Owis EA,etal. Optimization of beta-glucosidase production byAspergillusterreusstrain EMoo 6-4 using response surface methodology under solid-state fermentation [J]. Preparative Biochemistry and Biotechnology, 2015, 45(6): 568-587. [15] 郑虹. 红曲霉固态发酵产洛伐他汀的响应面优化 [J]. 中国酿造, 2014, 33(10): 76-80. [16] Tepe O, Dursun AY. Exo-pectinase production byBacilluspumilususing different agricultural wastes and optimizing of medium components using response surface methodology [J]. Environmental Science and Pollution Research, 2014, 21(16): 9911-9920. [17] 魏巍. 红曲霉发酵合成洛伐他汀的研究 [D]. 华中科技大学, 2013. [18] 刘爱英, 孙嘉龙, 邹晓等. 提高红曲霉发酵产品Monacolin K含量的研究 [J]. 贵州农业科学, 2007(6): 5-7. [19] 童振宇, 周立平, 陈旭峰. 响应面法优化红曲霉菌株MonascuspurpureusWX液态发酵产Monacolin K工艺条件 [J]. 2007(1): 35-40. Screening and identification of Aspergillus clavatus strain with high-yielding lovastatin and its optimization of fermentation conditions ZHANG Ting, Bedelkhan Almagul, ZHENG Jie-shi, HAN Xiao-fei, REN-Hao, JIANG Dong-hua College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004, China 150Aspergillusstrains were selected from different natural fermentation samples of food, soil, air and so on, and their products of lovastatin were measured by high performance liquid chromatography (HPLC) method. Among them, theAspergillusstrain Ac-32 producing higher-level lovastatin was screened. Based on 18S rDNA sequence and morphology characteristics, the strain Ac-32 was identified asAspergillusclavatus. Through analyzing the influence of C source, N source, C content, N content, C/N, temperature, initial pH and so on, the results indicated that optimal fermentation conditions were as follows: C source lactose, N source peptone, C content 100 g/L, N content 12 g/L, C/N 15∶1.8, temperature 28 ℃, shaking speed 180 r/min, initial pH 5.2, inoculating age 4 d and inoculum size 6%. Using Plackett-Burman (P-B) in Minitab 17, 4 significant effects (C content, N content, temperature and pH) on lovastatin yields were screened out. According to the P-B experiment results and analysis of response surface methodology in Design Expert, the optimum conditions were as follows: C content 100 g/L, N content 11.8 g/L, temperature 28 ℃, pH 5.2. Under the optimized conditions, the maximum lovastatin yield was 236.221 μg/mL. Aspergillusclavatus; Lovastatin; response surface methodology; fermentation conditions 10.3969/j.issn.1001-6678.2016.06.005 国家自然科学基金项目(NO.31270061;NO.31570013)。 章 婷(1991~),女,硕士研究生。研究方向:应用微生物。E-mail:704486377@qq.com。 *通信作者: 蒋冬花(1964~),女,教授。Tel:13566997832,E-mail:jdh@zjnu.cn。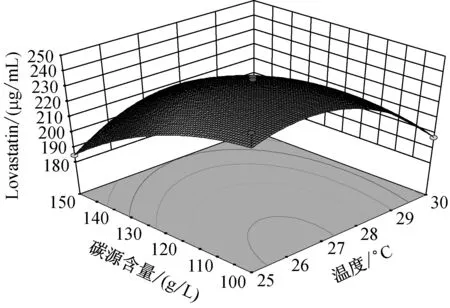



3 讨论

