右美托咪定抑制丙泊酚诱导原代培养皮层神经元凋亡
李建立,尹德云,王蕴欣,吴红海,侯艳宁
(1.河北省人民医院麻醉科,石家庄 050051;2.河北省人民医院心内科,石家庄 050051;3.白求恩国际和平医院药剂科,石家庄 050082)
右美托咪定抑制丙泊酚诱导原代培养皮层神经元凋亡
李建立1,尹德云2,王蕴欣1,吴红海3,侯艳宁3
(1.河北省人民医院麻醉科,石家庄 050051;2.河北省人民医院心内科,石家庄 050051;3.白求恩国际和平医院药剂科,石家庄 050082)
目的 探讨右美托咪定抑制丙泊酚诱导原代培养皮层神经元凋亡的机制。方法 体外原代培养7d的大鼠皮层神经元,给予500μmol/L丙泊酚和(或)不同浓度右美托咪定处理12h后,分为丙泊酚组、右美托咪定+丙泊酚组,对照组给予同溶剂的20%脂肪乳,用四甲基噻唑蓝(MTT)法检测各组神经元存活率的变化,Hoechst33258核染色法检测神经元调亡,蛋白质印迹法(Westernblotting)测定神经元磷酸化cAMP反应元件结合蛋白(pCREB)和细胞色素C(Cyt-C)蛋白水平。结果 与对照组比较,丙泊酚组神经元存活率明显下降,神经元凋亡率明显增加,pCREB蛋白水平明显降低,Cyt-C蛋白水平明显增加,差异均有统计学意义(P<0.01)。与丙泊酚组比较,右美托咪定+丙泊酚组神经元存活率明显增加,神经元凋亡率明显下降,pCREB蛋白水平明显增加,Cyt-C蛋白水平明显下降,差异均有统计学意义(P<0.01)。结论 右美托咪定可对抗丙泊酚引起的原代培养皮层神经元凋亡,其机制可能与增加pCREB蛋白水平,降低Cyt-C蛋白水平有关。
丙泊酚;右美托咪定;原代培养皮层神经元;凋亡;磷酸化cAMP反应元件结合蛋白;细胞色素C
丙泊酚通过激动γ氨基丁酸A型受体(gamma amino acid type A receptor,GABAR)和抑制N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)发挥麻醉作用,被广泛用于麻醉诱导和维持。药典显示3岁以下患儿慎用丙泊酚,但在临床工作中丙泊酚被广泛用于婴幼儿麻醉。丙泊酚是否对发育期大脑产生神经损伤目前观点不一。最近研究表明,丙泊酚可引起发育期动物大脑广泛脑区神经细胞和原代培养神经元凋亡[1-4]。因此,寻找药物抑制丙泊酚发育期神经毒性已成为婴幼儿麻醉的重要研究内容。右美托咪定是高选择性α2肾上腺素受体激动药,具有镇静、镇痛和拮抗交感神经活性的作用,可对抗丙泊酚引起的原代培养神经元凋亡和发育期大鼠大脑神经损伤,但具体机制还不清楚[5-6]。本文利用原代培养皮层神经元研究右美托咪定对抗丙泊酚诱导原代培养皮层神经元凋亡的机制。
1 材料与方法
1.1 药物与试剂 丙泊酚(Diprivan,意大利AstraZeneca公司,批号:KW814),右美托咪定(江苏恒瑞医药股份有限公司,批号14102132);20%脂肪乳购自广州百特公司,DMEM培养液、胎牛血清、Neurobasal培养液、B27促生长剂购自美国Gibco公司,LY294002、二甲基亚砜(DMSO)、噻唑蓝(MTT)购自美国Sigma公司,Hoechst33258荧光染料和胰蛋白酶购自北京索来宝公司,磷酸化cAMP反应元件结合蛋白(phosphorylated cAMP response-element binding protein,pCREB)和细胞色素C(cytochrome C,Cyt-C)抗体购自美国Cell Signal Technology公司。
1.2 方法
1.2.1 皮层神经元原代培养 按文献[7]进行原代皮层神经元培养。体外培养7 d的神经元用于实验。
1.2.2 实验分组 观察右美托咪定对神经元的保护作用时,分为对照组(给予同溶剂的20%脂肪乳)、丙泊酚组(丙泊酚终浓度为500 μmol/L)、右美托咪定+丙泊酚组(右美托咪定终浓度分别为0.001、0.010、0.100、1.000 μmol/L,丙泊酚终浓度为500 μmol/L)。检测各种处理对神经元凋亡的影响时,分为对照组(给予同溶剂的20%脂肪乳)、丙泊酚组(终浓度为500 μmol/L)、右美托咪定+丙泊酚组(右美托咪定终浓度为0.1 μmol/L,丙泊酚终浓度为500 μmol/L)。
1.2.3 四甲基噻唑蓝(MTT)法检测神经元存活率 将细胞接种于96孔板,体外培养至第7天分别给予不同的药物处理12 h后,按文献[7]应用MTT法检测神经元存活率。
1.2.4 Hoechst33258核染色法检测神经元凋亡 将神经元接种于6孔培养板中,按上述方法培养,分别给予不同药物处理后,按文献[7]应用Hoechst33258核染色法检测神经元凋亡。
1.2.5 蛋白质印迹法(Western blotting)测定pCREB和Cyt-C蛋白水平 细胞经不同药物处理后,收集细胞,裂解细胞提取总蛋白,BCA法检测样品蛋白水平。取待测蛋白质50 μg加上样缓冲液煮沸变性,于10%十二烷基硫酸钠-聚丙烯酰胺凝胶中100 V电泳l.5 h,转膜1 h,加入pCREB和Cyt-C抗体(1∶2 000),4 ℃过夜,常规洗涤,加羊抗鼠二抗(1∶5 000)37 ℃孵育60 min,洗涤,电化学法发光、显影、扫描,用凝胶图像处理系统分析目标条带与内参条带吸光度的比值。实验重复3次,设β-actin蛋白为内参。

2 结 果
2.1 不同处理对原代培养皮层神经元存活率的影响 与对照组比较,丙泊酚组神经元存活率明显下降,差异有统计学意义(P<0.01);与丙泊酚组比较,右美托咪定可浓度依赖性提高神经元存活率,差异有统计学意义(P<0.01),见图1。
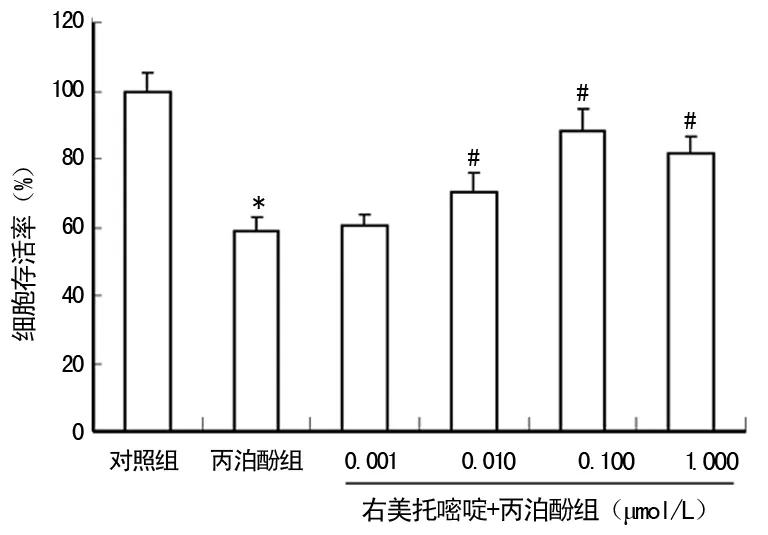
*:P<0.01,与对照组比较;#:P<0.01,与丙泊酚组比较。
图1 不同处理对神经元存活率的影响
2.2 不同处理对原代培养皮层神经元凋亡的影响 与对照组比较,丙泊酚组神经元凋亡率明显增加,差异有统计学意义(P<0.01);与丙泊酚组比较,右美托咪定+丙泊酚组皮层神经元凋亡率明显下降,差异有统计学意义(P<0.01),见图2。
2.3 不同处理对原代培养皮层神经元pCREB蛋白水平的影响 与对照组比较,丙泊酚组pCREB蛋白水平明显降低,差异有统计学意义(P<0.01);与丙泊酚组比较,右美托咪定+丙泊酚组pCREB蛋白水平明显增加,差异有统计学意义(P<0.01),见图3。
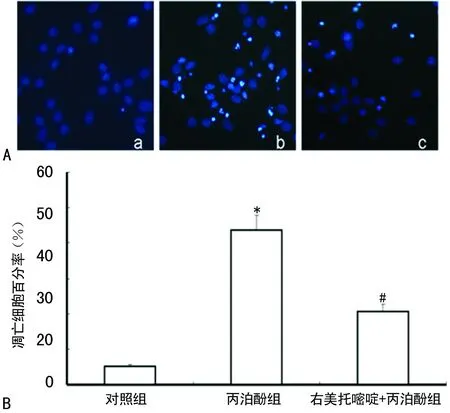
A:Hoechst33258核染色法(×200);a:对照组;b:丙泊酚组;c:右美托嘧喧+丙泊酚组;*:P<0.01,与对照组比较;#:P<0.01,与丙泊酚组比较。
图2 不同处理对神经元凋亡的影响

*:P<0.01,与对照组比较;#:P<0.01,与丙泊酚组比较。
图3 不同处理对神经元pCREB蛋白水平的影响
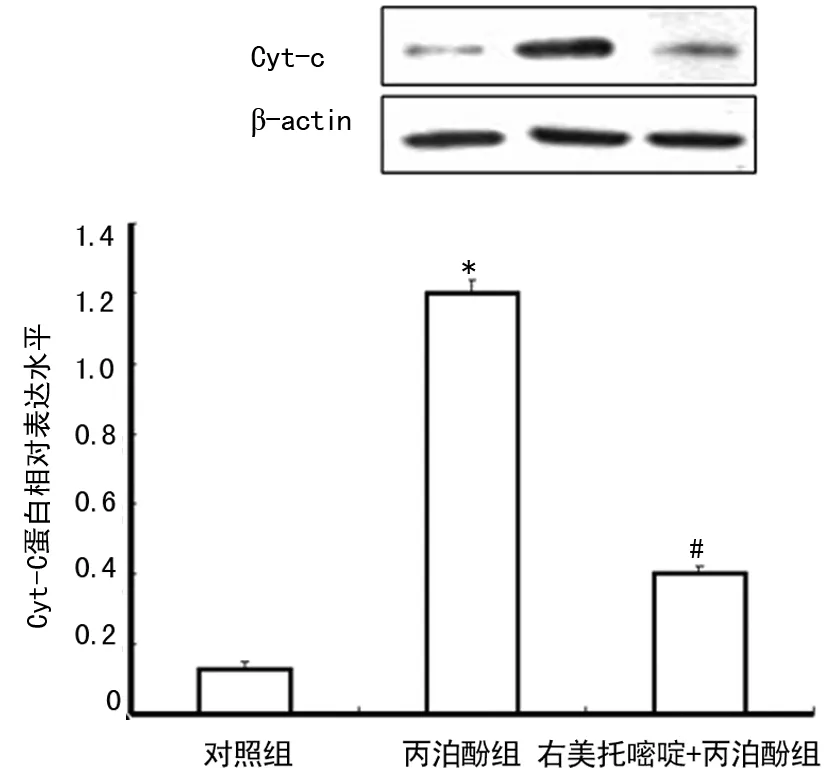
*:P<0.01,与对照组比较;#:P<0.01,与丙泊酚组比较。
图4 不同处理对神经元Cyt-C蛋白水平的影响
2.4 不同处理对原代培养皮层神经元Cyt-C蛋白水平的影响 与对照组比较,丙泊酚组Cyt-C蛋白水平明显增加,差异有统计学意义(P<0.01);与丙泊酚组比较,右美托咪定+丙泊酚组Cyt-C蛋白水平明显降低,差异有统计学意义(P<0.01),见图4。
3 讨 论
全世界每年有众多患儿因各种原因接受全身麻醉。近年来多项研究报道丙泊酚具有发育期神经毒性,可对发育期动物大脑和原代培养神经元产生损伤[1-4],因此,丙泊酚的发育期神经毒性引起了学者的广泛关注,同时寻找安全有效防治丙泊酚发育期神经毒性的药物具有十分重要的临床意义。
右美托咪定是临床上常用的高选择性的α2肾上腺素受体激动药,具有抑制交感神经,镇静镇痛和减少麻醉药用量等作用,作为麻醉辅助药物被广泛用于临床麻醉中。目前研究发现,右美托咪定可对多种神经损伤模型产生保护作用,如对抗缺血再灌注损伤[8],高氧诱导的发育期大脑损伤[9]。另有研究发现,右美托咪定可抑制丙泊酚引起的原代培养海马神经元存活率的下降,其机制尚不清楚[6]。另有研究表明,右美托咪定不会对发育期大脑产生神经损伤[10]。本文利用原代培养皮层神经元研究右美托咪定对抗丙泊酚引起原代培养皮层神经元损伤的机制。MTT结果显示,与对照组比较,丙泊酚组神经元存活率明显降低,右美托咪定可浓度依赖性地提高神经元的存活率。Hoechst33258核染色结果显示,与对照组比较,丙泊酚组神经元凋亡率明显增加,与丙泊酚组比较,右美托咪定+丙泊酚组神经元凋亡率明显降低。
CREB为神经保护的中枢调节因子,参与细胞内多种信号通路的传导,其磷酸化在调控转录起始过程中发挥着关键作用,另外磷酸化CREBser-133位点可介导神经元存活及突触的形成,通过调控大量促神经元存活基因如Bcl-2和脑源性神经营养因子(BDNF)的表达,进而发挥神经保护作用[11]。研究发现,丙泊酚通过抑制CREB的磷酸化水平引起神经细胞损伤[12-13],右美托咪定可通过提高原代培养海马神经元pCREB蛋白水平,进而抑制海马神经元凋亡[14]。本文Westernblotting结果显示,与对照组比较,丙泊酚组pCREB蛋白水平明显降低,与丙泊酚组比较,右美托咪定+丙泊酚组pCREB蛋白水平明显增加,提示丙泊酚通过降低皮层神经元pCREB蛋白水平引起皮层神经元凋亡,而右美托咪定可通过提高pCREB蛋白水平对抗丙泊酚诱导的原代培养皮层神经元凋亡。Cyt-C在线粒体凋亡信号转导途径中发挥着重要的作用,Cyt-C释放入细胞质是细胞凋亡发生的关键步骤。Cyt-C是线粒体呼吸链上的重要组成成分,生理状态下Cyt-C存在于线粒体内,当刺激因子作用于细胞后线粒体通过多种离子转运机制,导致内膜两侧离子浓度差的变化,引起线粒体膜电位的下降,使线粒体膜电位通透性增加,Cyt-C释放入细胞质,进而激活天冬氨酸特异性半胱氨酸蛋白酶-3(caspase-3),引起细胞凋亡。本文Westernblotting结果显示,与对照组比较,丙泊酚组Cyt-C蛋白水平明显增加,与丙泊酚组比较,右美托咪定+丙泊酚组Cyt-C蛋白水平明显下降,提示丙泊酚通过增加皮层神经元Cyt-C蛋白水平引起皮层神经元凋亡,而右美托咪定可通过降低Cyt-C蛋白水平对抗丙泊酚诱导的原代培养皮层神经元凋亡。
综上所述,右美托咪定通过抑制丙泊酚引起的神经元pCREB蛋白水平的下降,降低Cyt-C蛋白水平,抑制丙泊酚诱导的原代培养皮层神经元凋亡。本研究为围术期应用右美托咪定预防丙泊酚引起的发育期大脑损伤提供了初步的实验依据和理论依据。
[1]HuangJ,JingS,ChenX,etal.Propofoladministrationduringearlypostnatallifesuppresseshippocampalneurogenesis[J],MolNeurobiol,2016,53(2):1031-1044.
[2]KarenT,SchlagerGW,BendixI,etal.Effectofpropofolintheimmatureratbrainonshort-andlong-termneurodevelopmentaloutcome[J].PLoSOne,2013,8(5):e64480.
[3]ZhongY,LiangY,ChenJ,etal.PropofolinhibitsproliferationandinducesneuroapoptosisofhippocampalneuronsinvitroviadownregulationofNF-κBp65andBcl-2andupregulationofcaspase-3[J].CellBiochemFunct,2014,32 (8):720-729.
[4]BernsM,SeebergL,SchmidtM,etal.High-dosepropofoltriggersshort-termneuroprotectionandlong-termneurodegenerationinprimaryneuronalculturesfromratembryos[J].JIntMedRes,2009,37(3):680-688.
[5]LiJ,XiongM,NadavaluruPR,etal.Dexmedetomidineattenuatesneurotoxicityinducedbyprenatalpropofolexposure[J].JNeurosurgAnesthesiol,2016,28(1):51-64.
[6]扈俊华,,梁羽冰,覃怡,等.右美托咪定预处理对丙泊酚孵育的大鼠海马神经元细胞活力的影响[J].临床麻醉学杂志,2013,29(5):488-490.
[7]LiJ,WuH,XueG,etal.17β-oestradiolprotectsprimary-culturedratcorticalneuronsfromketamine-inducedapoptosisbyactivatingPI3K/Akt/Bcl-2signalling[J].BasicClinPharmacolToxicol,2013,113(6):411-418.
[8]张晓青,贾建丽,冯明静,等.右美托咪定减轻大鼠全脑缺血再灌注损伤[J].基础医学与临床,2013,33(1):117-118.
[9]SifringerM,vonHaefenC,KrainM,etal.Neuroprotectiveeffectofdexmedetomidineonhyperoxia-inducedtoxicityintheneonatalratbrain[J].OxidMedCellLongev,2015(2015):530371.
[10]KooE,OshodiT,MeschterC,etal.Neurotoxiceffectsofdexmedetomidineinfetalcynomolgusmonkeybrain[J].JToxicolSci,2014,39(2):251-262.
[11]FanM,JinW,ZhaoH,etal.Lithiumchlorideadministrationpreventsspatiallearningandmemoryimpairmentinrepeatedcerebralischemia-reperfusionmicebydepressingapoptosisandincreasingBDNFexpressioninhippocampus[J].BehavBrainRes,2015(291):399-406.
[12]张英,吴新海,郑利民.丙泊酚对大鼠海马cAMP效应元件结合蛋白磷酸化和cAMP效应元件结合蛋白mRNA表达水平的影响[J].国际麻醉学与复苏杂志,2011,32(3):303-307.
[13]梁羽冰,利莉,陈静,等.丙泊酚或依托咪酯对大鼠海马胶质纤维酸性蛋白表达的影响[J].广东医学,2012,33(3):303-305.
[14]韦祎,扈俊华,梁羽冰,等.右美托嘧啶对胎鼠离体海马神经元CREB磷酸化表达的影响[J].中华麻醉学杂志,2014,34(11):1309-1311.
Dexmedetomidine inhibits propofol-induced apoptosis in primary cultured cortical neurons*
LiJianli1,YinDeyun2,WangYunxin1,WuHonghai3,HouYanning3
(1.DepartmentofAnesthesiology,HebeiGeneralHospital,Shijiazhuang,Hebei050051,China; 2.DepartmentofCardiology,HebeiGeneralHospital,Shijiazhuang,Hebei050051,China; 3.DepartmentofPharmacy,BethuneInternationalPeaceHospitalofChinesePLA,Shijiazhuang,Hebei050082,China)
Objective To investigate the mechanisms of the protective effects of dexmedetomidine against the propofol-induced neuroapoptosis in primary cultured cortical neurons.Methods The neurons were cultured for 7 days and treated with 500 μmol/L propofol and(or) different concentrations of dexmedetomidine,then were divided into the propofol treatment group,propofol+dexmedetomidine treatment group.The neurons in the control group were treated with 20% fat emulsion dissolved in the same solvent.12 hours after different treatments,neuron viability was measured by using MTT assay,neuroapoptosis was detected by using Hoechst33258 staining,and the levels of pCREB and Cyt-C protein were detected by using Western blotting.Results Compared with the control group,propofol inhibited neuron viability greatly,the neuroapoptosis increased greatly,the level of pCREB decreased greatly and the level of Cyt-C increased greatly,there were statistically significant differences(P<0.01).Compared with propofol treatment group,dexmedetomidine increased neuron viability greatly,the neuroapoptosis decreased greatly,the level of pCREB increased greatly and the level of Cyt-C decreased greatly,there were statistically significant differences.Conclusion Dexmedetomidine exerts the neuroprotective effects against propofol-induced neuroapoptosis,which may be associated with the increase of pCREB level and the decrease of Cyt-C level.
propofol;dexmedetomidine;primary cultured cortical neurons;apoptosis;phosphorylated cAMP response-element binding protein;cytochrome C
河北省卫生厅指令性课题资助项目(ZL20140095);2015年政府资助临床医学优秀人才培养和基础课题研究项目(361003-6)。 作者简介:李建立(1976-),副教授,博士,主要从事麻醉药理学研究。
��·基础研究
10.3969/j.issn.1671-8348.2016.35.005
R
A
1671-8348(2016)35-4911-03
2016-05-19
2016-08-07)

