干旱胁迫对糜子生理及产量的影响
刘紫娟,李萍,宗毓铮,董琪,郝兴宇
(山西农业大学农学院,山西太谷030801)
干旱胁迫对糜子生理及产量的影响
刘紫娟,李萍,宗毓铮,董琪,郝兴宇
(山西农业大学农学院,山西太谷030801)
开展北方干旱胁迫对糜子生理及产量的研究,将为北方干旱地区杂粮生产提供参考。通过盆栽试验进行干旱条件下糜子的光合指标、抗逆生理指标、形态指标和产量的变化研究,以探索干旱对糜子生理和产量的影响。结果表明,干旱胁迫使糜子在孕穗期光合速率(Pn)下降50.9%、气孔导度(Gs)降低60.9%,蒸腾速率(Tr)下降60.1%、水分利用率(WUE)升高22.5%。灌浆期,干旱对光合作用无显著影响,气孔导度、蒸腾速率下降,水分利用率升高;糜子受干旱胁迫时,叶片MDA(丙二醛)含量上升21.6%,POD(过氧化物酶)活性降低20.5%,可溶性糖含量升高87.4%;干旱使糜子的株高、穗长、茎粗、节数和穗质量分别下降23.1%,19.1%,21.1%,8.1%,50.8%,并使粒质量和地上部生物量降低55.8%和54.9%。糜子作为耐旱作物,对干旱有一定的适应与耐受能力,灌浆期净光合速率下降不显著,叶绿素a、叶绿素b和类胡萝卜素含量分别升高11.1%,11.0%和49.1%,这可能有利用于其光合能力的提高,但膜脂过氧化的破坏仍然会影响植株的生长发育和产量。
干旱胁迫;糜子;光合作用;抗氧化酶;产量
近年来,由于全球气候变暖、水资源配置矛盾,导致干旱在全球大部分地区广泛发生,原本干旱地区会受到更大的影响[1]。山西地处中纬度,位于中温带半干旱、暖湿带亚湿润气候区,年降水量较低,日照充足,导致水资源不足,在气候变暖影响下,干旱发生的概率将增加,这对农业生产有很大的制约作用[2]。糜子(Panicum miliaceum L.)是黄土高原地区主要的杂粮作物,具有一定的抗旱能力,在食用、药用、饲用等方面都有一定的经济效用[3]。
干旱胁迫是植物生长遭遇的最主要、也是黄土高原地区作物生产遭受最广泛的逆境胁迫[4]。国内外学者对干旱胁迫下大豆、小麦、玉米等作物的生长情况已经进行了大量研究,结果表明,干旱会使作物光合作用受到影响,进而影响作物的生长和产量[5-7],但有关糜子的研究还比较少,张美俊等[8]、冯晓敏等[9-10]、张萌等[11]研究了干旱胁迫下糜子幼苗的生理及光合特性,徐学选等[12]研究了在不同程度的干旱胁迫下糜子产量的变化,李翠[13]研究了干旱胁迫对糜子灌浆的影响,但对糜子的光合生理、逆境生理及产量的综合研究则少有报道。
本试验拟进行干旱胁迫对糜子光合指标、抗逆生理指标及植株生长形态等方面影响的研究,旨在为揭示糜子生理代谢对干旱胁迫的响应机制,为今后糜子的栽培育种提供依据。
1 材料和方法
1.1 试验地点
试验在山西农业大学基地旱棚内进行,该基地位于山西省晋中市太谷县(37.42°N,112.58°E)。
1.2 试验材料
供试材料为华池软红糜子,由山西农业大学杂粮研究所提供。
1.3 试验设计
糜子于6月20日播种于16个塑料归置箱中,箱子长60 cm,宽40 cm,高35 cm,底部打5个孔用于排水,在箱子内依次铺沙土、壤土共28 cm深。每个箱子播种10穴,每穴播种3粒种子,幼苗长出后留最健壮的1株。试验分为湿润(CK)和干旱2个处理,每组处理8个重复,干旱处理的8盆保持土壤含水量在田间最大持水量的40%~50%,湿润处理的土壤含水量保持在田间最大持水量的80%~100%,在每天8:00—9:00用便携式土壤水分测定仪(型号TZS-1,浙江托普仪器有限公司生产)测定土壤含水量,通过适当灌溉将土壤含水量控制在目标范围内。
1.4 生育期(Developmental stage)确定
2015年6月20日播种,2015年9月25日收获,全生育期共98 d。与本试验生理指标测定有关的生育期标准如下。
播种55 d后,糜子旗叶展开并开始生殖生长,有孕苞形成,全田有75%的植株旗叶展开为孕穗期。播种70 d后,糜子经开花受精,子房膨大,籽粒形成,叶片积累的有机物转入籽粒中,全田75%的植株落花后进入灌浆期。播种98 d后,糜子籽粒饱满,穗下垂,叶片变黄,全田75%的植株达到此标准即为收获期。
1.5 测定指标及方法
1.5.1 光合指标的测定在孕穗期(播种后55 d)与灌浆期(播种后70 d)于每天9:00—11:00,使用便携式光合气体分析系统(Li6400,Li-CorInc,Lincoln NE,USA)分别对2个处理的糜子进行光合测定,每个处理选取8株进行测定,每箱选取长势较好的一株测定其倒数第2片新叶,在光量子通量密度(PPFD)为1 400 μmol/(m2·s)的光强下,在设定室温28℃下,测定净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),并计算水分利用效率(WUE=Pn/Tr[14])。
1.5.2 光合色素含量的测定在灌浆期(播种后70 d),选取3盆糜子,将这3盆旗叶全部采集,低温保存用于测定光合色素含量与抗逆生理指标。光合色素采用丙酮提取法,提取后利用分光光度计(722S,上海)对糜子叶片中叶绿素a、叶绿素b和类胡萝卜素的含量进行测定[15]。
1.5.3 抗逆生理指标的测定利用灌浆期选取的叶片进行测定,采用联苯胺比色法测定过氧化物酶(POD)活性,采用硫代巴比妥酸法测定丙二醛(MDA)含量,采用蒽酮比色法对可溶性糖的含量进行测定[16]。
1.5.4 形态指标及生物量的测定糜子成熟后(播种后98 d),将剩余5盆(旗叶用于生理指标测定的3盆除外)所有植株地上部分收获,测量每株的株高、穗长、茎粗、节数、穗质量。脱粒,测量计算糜子的总生物量、粒质量、千粒质量。
1.6 数据处理
采用Excel软件处理各组数据并作图;采用SPSS软件进行处理间的差异显著性分析;各处理的比较采用最小显著差数法,即LSD法,其中,小于LSD0.05水平的视为显著,小于LSD0.01水平的视为极显著。
2 结果与分析
2.1 干旱胁迫对糜子光合指标的影响
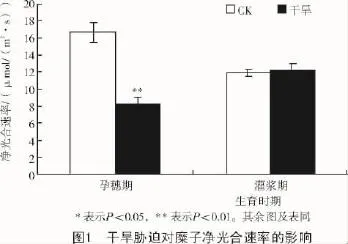
2.1.1 干旱胁迫对糜子净光合速率的影响从图1可以看出,在孕穗期(播种后55 d),干旱胁迫下糜子的净光合速率受到了一定的影响,比CK净光合速率降低了50.9%,并且差异达到了极显著水平;在灌浆期(播种后70 d),干旱胁迫对糜子的光合速率没有显著影响。
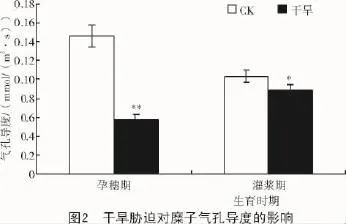
2.1.2 干旱胁迫对糜子气孔导度的影响在孕穗期和灌浆期,干旱胁迫使糜子的气孔导度均降低,其中,与CK相比,孕穗期极显著降低60.9%,灌浆期显著降低14.6%,灌浆期降幅较小(图2)。
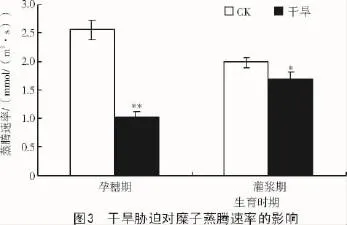
2.1.3 干旱胁迫对糜子蒸腾速率的影响干旱胁迫对糜子的蒸腾速率在孕穗期和灌浆期均有不同程度的影响,其中,孕穗期比CK降低了60.1%,达到极显著水平;灌浆期比CK降低14.7%,达到显著水平(图3)。
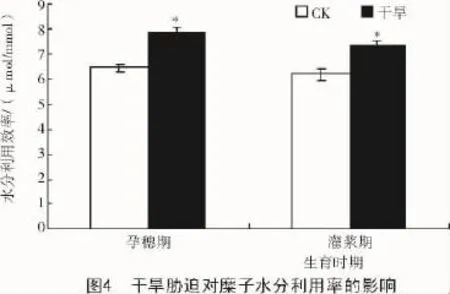
2.1.4干旱胁迫对糜子水分利用率的影响干旱胁迫使孕穗期和灌浆期糜子的水分利用率增加,分别显著增加22.5%和19.3%(图4)。
2.2 干旱胁迫对糜子光合色素含量的影响
从表1可以看出,在干旱胁迫下,糜子的叶绿素a、叶绿素a+b和类胡萝卜素的含量显著增加,分别比CK增加11.1%,11.3%和49.1%;叶绿素b的含量与CK相比增幅不显著。
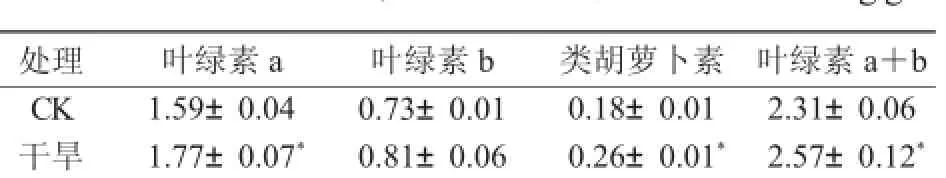
表1 干旱胁迫对糜子光合色素含量的影响mg/g
2.3 干旱胁迫对糜子抗逆生理指标的影响
干旱胁迫下,糜子过氧化物酶(POD)的活性无明显变化;而丙二醛(MDA)的含量增加了21.6%,且达到了显著水平;可溶性糖含量提高87.4%,且达到了极显著水平(表2)。
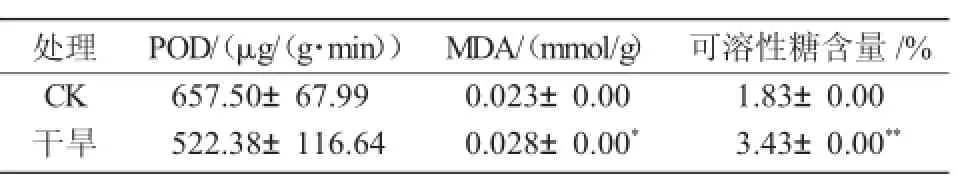
表2 干旱对糜子抗逆生理指标的影响
2.4 干旱胁迫对糜子形态指标的影响
从表3可以看出,干旱胁迫影响了糜子的生长发育,使糜子株高、穗长、茎粗、穗质量显著降低,与CK相比,分别降低23.1%,19.1%,21.1%,50.8%;干旱对糜子节数没有影响。

表3 干旱对糜子形态指标的影响
2.5干旱胁迫对糜子粒质量和地上部分生物量的影响
干旱胁迫下,糜子的产量和地上部生物量都有很大程度的降低,粒质量为123.58 g/m2,较CK降低了55.8%;地上部生物量为313.86 g/m2,较CK降低了54.9%,二者都达到了极显著水平(图5)。
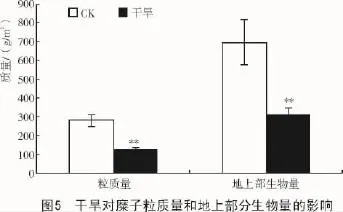
3 讨论
作物受到干旱胁迫后,各生理代谢都会受到影响,其中,光合作用受到的影响最为显著[17]。因此,干旱胁迫导致光合作用的减弱是影响干旱条件下农作物产量的主要因素[18-19]。有学者研究表明,谷子在拔节期受到干旱胁迫,对其光合速率的影响最大;在灌浆期受到干旱胁迫对其光合速率的影响较小[20]。冯晓敏等[10]研究表明,糜子在拔节期受到干旱胁迫,使其净光合速率、气孔导度等较大程度地降低。这与本研究结果基本符合,在拔节期后的孕穗期,干旱胁迫使净光合速率、气孔导度、蒸腾速率等均显著降低,但在灌浆期,这些光合指标降低幅度明显减小,净光合速率与对照差别不大,这可能是因为糜子属于抗旱作物,前期的干旱使其植株变矮,整体的耗水量下降,对干旱产生一定的适应性,这些可以由气孔导度的降幅变小及POD活性的下降证明,加之光合色素含量提高,因此,净光合速率没有显著下降。干旱胁迫使植物体内水分很大程度上降低,植物为减少蒸腾作用会减少叶片的伸展,促使气孔关闭,导致CO2的摄取量减少[21],同时植物体内水分降低也会使叶绿体变形且片层破坏,导致叶绿体活性和色素含量降低,破坏相关酶活性,从而使光合作用减弱,光合速率下降[22]。研究表明,植物在受到轻度胁迫时,主要受到光合作用的气孔限制,即影响光合速率的主要因素是气孔导度的降低,从而引起CO2亏缺;而在中度或重度干旱胁迫中,植物主要受到光合作用的非气孔限制,即对光合速率的影响主要是由叶肉细胞或叶绿体活性下降、叶绿素含量降低和羧化酶活性受抑制等非气孔因素造成的[23-25]。在本研究中,气孔导度、蒸腾速率与净光合速率变化一致,可见,在孕穗期影响糜子光合速率的主要因素是气孔。糜子在生长后期(灌浆期),产生对干旱的适应,这种适应也体现在气孔的适应(气孔导度降幅减小),保证了光合作用的正常进行。
干旱胁迫会打破植物体内自由基产生和消除的平衡状态,更利于自由基的产生,自由基的积累会引发膜脂的过氧化作用,膜脂过氧化作用的最终产物是丙二醛,它可以严重破坏生物膜系统[26-27]。同时,植物体内的酶促防御系统中的超氧物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等可清除活性氧,但酶促防御系统在干旱胁迫的条件下,清除活性氧的能力也会有所下降[28]。本研究表明,干旱胁迫下,膜脂过氧化的产物MDA的含量显著增加,干旱会破坏糜子膜脂系统,但酶促防御系统中POD的活性并未升高。光合作用的直接产物是可溶性糖,在逆境胁迫下,植物可以通过对可溶性糖和脯氨酸的积累,增加其体内水分含量,进而提高在逆境中的适应性[29]。干旱条件下糜子叶片可溶性糖的含量显著提高,有利于提高其抗旱性。
植物在水分胁迫的条件下,其生长形态会发生变化,表现在细胞、组织、器官、个体、群落等不同水平[21]。一般认为,水分胁迫使茎叶生长受到抑制,株高和叶面积系数也会降低[10]。已有研究表明,谷子在受到干旱胁迫后株高和茎质量明显下降,茎节数、茎粗、穗长、千粒质量和单穗粒质量也有不同程度的下降,同时,干旱也增加了秕谷的比例[20]。王永丽等[30-31]研究发现,拔节期、孕穗期和灌浆期干旱胁迫主要影响穗粒质量、千粒质量和籽粒灌浆,是谷类作物干旱条件下产量降低的主要原因。本研究显示,在糜子生长的全生育期,干旱胁迫会降低光合作用,同时破坏膜脂过氧化,从而使其株高、穗长、茎粗、节数、穗质量等形态指标显著下降。灌浆期干旱虽然对糜子的光合作用没有显著影响,但由于对膜脂过氧化的破坏,影响籽粒灌浆,使千粒质量和粒质量显著降低,糜子产量也随之降低。
综上所述,与CK相比,干旱胁迫会影响糜子的光合作用,虽然糜子在灌浆期有一些抗逆效应净光合速率未显著下降,但干旱会破坏糜子细胞膜结构,从而影响糜子的生长发育,最终使糜子产量降低。
4 结论
本研究结果表明,与CK相比,干旱胁迫使糜子在孕穗期光合速率下降50.9%、气孔导度降低60.9%、蒸腾速率下降60.1%,使水分利用率升高22.5%;但灌浆期干旱对光合作用影响不大。灌浆期,干旱使糜子叶片中叶绿素a,叶绿素b和类胡萝卜素含量比CK分别升高11.1%,11.0%和49.1%,MDA含量比CK分别增加21.6%,POD活性比CK降低20.5%,可溶性糖含量比CK增加87.4%。干旱使糜子的株高、穗长、茎粗、节数和穗质量比CK分别降低23.1%,19.1%,21.1%,8.1%,50.8%,并使粒质量和地上部生物量分别比CK降低55.8%和54.9%。糜子是抗旱作物,有一定的抗逆效应,生长后期(灌浆期)表现出较高的干旱适应性,但产量仍显著下降。
[1]王雪梅.气候变暖导致全球干旱[J].科学新闻,2011(6):56-59.
[2]朱敏嘉,茅彧,王涛,等.山西主要气候资源探析[J].山西农业科学,2010,38(7):77-79.
[3]乔治军.糜子产业发展现状与思路[J].作物杂志,2013(5):25-27.
[4]李凤民,赵松岭.黄土高原半干旱区作物水分利用研究新途径[J].应用生态学报,1997,8(1):104-109.
[5]Desclaux D,Roumet P.Impact of drought stress on the phenology of twosoybean cultivars[J].Field Crop Res,1996,46:61-70.
[6]Li L,Staden van J.Effects of plant growth regulators on the antioxidant system in callus of maize cultivars subject to water stress[J]. Plant Growth Regulation,1998,24(1):55-56.
[7]山仑,吴玫君,谢其明,等.小麦灌浆期生理特性和土壤水分条件对灌浆影响的研究[J].植物生理学通讯,1980(3):41-46.
[8]张美俊,杨武德,乔治军,等.不同糜子品种萌发期对干旱胁迫的响应及抗旱性评价[J].草地学报,2013,21(2):302-307.
[9]冯晓敏,张永清,李鹏,等.糜子幼苗对不同强度干旱胁迫的形态与生理响应[J].干旱地区农业研究,2013,31(2):176-181.
[10]冯晓敏,张永清.水分胁迫对糜子植株苗期生长和光合特性的影响[J].作物学报,2012,38(8):1513-1521.
[11]张萌,张永清.不同品种糜子幼苗根系对干旱胁迫的生物学响应[J].作物杂志,2013(5):98-103.
[12]徐学选,陈国良,穆兴民.不同干旱强度对糜子产量的影响及其在估产中的应用[J].水土保持通报,1994,14(6):41-47.
[13]李翠.水分亏缺对糜子生育及籽粒灌浆特性的影响[D].杨凌:西北农林科技大学,2014.
[14]胡晓雪,杜维俊,杨珍平,等.大气CO2浓度和气温升高对野生大豆光合作用的影响[J].山西农业科学,2015,43(7):798-801,853.
[15]郝兴宇,邸少华,王晨光,等.大气CO2浓度升高对夏大豆光合生理及产量的影响[C]//中国气象学会.S5全球典型干旱半干旱地区气候变化及其影响.北京:中国气象学会,2012.
[16]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2003.
[17]许大全.光合作用测定及研究中一些值得注意的问题[J].植物生理学通讯,2006,42(6):1163-1167.
[18]张红萍,李明达.干旱胁迫对作物生理特性影响的研究进展[J].农业科技与信息,2010(23):6-7.
[19]Chves MM,Pereira J S,MarocoJ,et al.Howplants cope with water stress in the field photosynthesis and growth[J].Field Crops Research,2003,31(1/2):173-184.
[20]张文英,智慧,柳斌辉,等.谷子全生育期抗旱性鉴定及抗旱指标筛选[J].植物遗传资源学报,2010,11(5):560-565.
[21]闫志利,牛俊义.作物对干旱胁迫的响应机制研究进展[J].河北农业科学,2009,13(4):6-10.
[22]Mann C J,Wetzel R.Photosynthesis and stomatal conductance of Juncus effuses in a temperate wetland ecosystem[J].Aquatic Botany,1999,63:127-144.
[23]汪本福,黄金鹏,杨晓龙,等.干旱胁迫抑制作物光合作用机理研究进展[J].湖北农业科学,2014,53(23):5628-5632.
[24]Farguar GD,SharkeyTD.Stomatal conductance and photosynthesis[J].Ann RevPlant Physiol,1982,33:317-345.
[25]Schulze E D.Soil water deficit and atmospheric humidity as environmental signals[M].Oxford:Bios Scientific Publisher,1993:129-145.
[26]陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989,6(4):211-217.
[27]邸少华,谢立勇,郝兴宇.大气CO2浓度升高对夏大豆叶片生理生化性状的影响[J].华北农学报,2012,27(2):165-169.
[28]孙梅霞,祖朝龙,徐经年.干旱对植物影响的研究进展[J].安徽农业科学,2004,32(2):365-367,384.
[29]代惠萍.糜子植株衰老与活性氧代谢研究[D].杨凌:西北农林科技大学,2008.
[30]王永丽,王珏,杜金哲,等.不同时期干旱胁迫对谷子农艺性状的影响[J].华北农学报,2012,27(6):125-129.
[31]王纶,温琪汾,曹厉萍,等.黍稷抗旱种质筛选及抗旱机理研究[J].山西农业科学,2007,35(4):31-34.
Effects of Drought on Physiology and Yield in Broomcorn Millet
LIUZijuan,LI Ping,ZONGYuzheng,DONGQi,HAOXingyu
(College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China)
The study of drought stress on the physiology and yield of broomcorn millet will help us learn about the production of coarse cereals in arid area of North China.In this paper,we use pot experiment to explore changes of the photosynthetic index,stress physiological index,morphological index and yield in broomcorn millet under drought conditions,and focus on exploring the effect of drought on physiological and yield in millet.The results showthat at the booting stage,the drought causes decrease of photosynthetic rate(Pn),stomatal conductance(Gs)and transpiration rate(Tr)in broomcorn millet by50.9%,60.9%and 60.1%,respectively,the water use efficiency(WUE)increases by 22.5%.The drought has no effect on photosynthesis at filling seed stage,drought increases MDA(malondialdehyde)content and soluble sugar content at filling seed stage by 21.6%and 87.4%,respectively,but decreases POD(peroxidase)activity by 20.5%.The height,spike length,stem diameter,pitch number,spike quality and above-ground biomass and grain qualityofbroomcorn millet decrease by23.1%,19.1%,21.1%,8.1%,50.8%,54.9%and 55.8%,respectively.As a drought tolerant crop,broomcorn millet has a certain ability of adaptation and tolerance to drought.At the filling stage,net photosynthetic rate has no significant change in drought.The content of chlorophyll a,chlorophyll b and carotenoid pigment increase 11.1%,11.0%and 49.1%, respectively,which may help to improve the ability of photosynthesis.But the damage of membrane lipid peroxidation can affect the growth and yield ofthe plant.
drought;broomcorn millet;photosynthesis;antioxidant enzymes;yield
S516
A
1002-2481(2016)09-1279-05
10.3969/j.issn.1002-2481.2016.09.12
2016-05-12
国家“973”计划课题(2012CB955904);国家科技支撑计划项目(2013BAD11B03-8);现代农业产业技术体系建设专项(CARS-03-01-24);国家自然科学基金项目(31501276);山西省科技攻关计划项目(20150311006-2);山西农业大学博士引进人才项目(2013YT05)
刘紫娟(1993-),女,山西晋城人,在读硕士,研究方向:植物生理生态。郝兴宇为通信作者。

