皂角的组织培养
陈迪,袁媛,杨晓晶,王萍,张笠,田双梅
(1.山西农业大学生命科学学院,山西太谷030801;2.佳县农业技术推广中心,陕西佳县719200)
皂角的组织培养
陈迪1,袁媛1,杨晓晶1,王萍1,张笠1,田双梅2
(1.山西农业大学生命科学学院,山西太谷030801;2.佳县农业技术推广中心,陕西佳县719200)
为建立皂角的快繁体系,以皂角幼嫩叶片为外植体进行组织培养,研究不同激素配比对愈伤组织诱导、芽的增殖、壮苗及生根的影响。结果表明,诱导愈伤组织分化的最适培养基为MS+2 mg/L 6-BA+0.2 mg/L NAA+0.8 %琼脂+3%蔗糖;发芽生长的最适培养基为MS+1.0 mg/L6-BA+1.5 mg/LNAA+0.8%琼脂+3%蔗糖;但皂角生根的最适培养基不明显。皂角幼苗生长一段时间后,叶片及根部逐渐干枯甚至死亡,未能移栽成功,故皂角幼苗的大量繁殖未能完成。今后可以从改变生根培养基中激素浓度配比、抑制生根培养过程中有害物质的释放或去除有害物质等方面进一步研究。
皂角;组织培养;愈伤组织;激素配比
皂角(Gleditsia sinensis Lam.),又名皂荚树、皂荚等,属蔷薇目豆科落叶乔木[1]。皂角性喜光而稍耐阴,喜温暖湿润的气候及深厚肥沃适当的湿润土壤,在石灰质及盐碱甚至黏土或砂土上均能正常生长。皂角有祛痰止咳、开窍通闭、杀虫散结的功效,主治痰咳喘满、中风口噤、痰涎壅盛、神昏不语、癫痫、喉痹、二便不通、痈肿疥癣等[2]。皂角果是医药食品、保健品、化妆品及洗涤用品的天然原料。皂角种子可消积化食开胃,并含有瓜尔豆胶;皂角刺(皂针)含有黄酮、酚类、氨基酸,也具有很高的经济价值。皂角不仅具有较高的绿化和观赏功能,而且药用价值和经济价值极高。所以,皂角树的种植是促进农村产业结构调整、增加农民收入的一项重要措施,其发展前景十分广阔。皂角的寿命很长,但生长速度慢,需要6~8 a的营养生长才能开花结果[1,3]。
本试验通过对皂角组织的培养探索,以加速皂角的培育,从而建立皂角的快繁体系[4-5]。
1 材料和方法
1.1 试剂和仪器
MS培养基的母液,生长素和细胞分裂素,70%~75%酒精,20%次氯酸钠,无菌水等。无菌操作台,高压灭菌锅,酸度计,酒精灯,镊子,手术刀,培养皿,三角瓶,烧杯,量筒等。
1.2 材料灭菌
2014年4月将山西农业大学植物园里的皂角幼嫩叶片采集回来,先用自来水清洗,再到超净工作台进行外植体的灭菌,即可获得无菌外植体。皂角叶片小且薄,灭菌时间要比其他普通外植体叶片短[6]。于75%乙醇溶液灭菌15 s,20%NaClO+吐温-20灭菌15 min。通过预试验发现,皂角极易感菌,为降低感菌率,外植体用青链霉素抗生素(100 mL无菌水中400 μL青链霉素)灭菌15 min[7-8],效果最佳。
1.3 培养条件
以MS,1/2 MS,1/3 MS培养基为基本培养基,添加不同浓度的细胞分裂素6-BA和生长素NAA,IBA,2,4-D。以MS为基本培养基时,加蔗糖30 g;以1/2 MS为基本培养基时,加蔗糖15 g;以1/3 MS为基本培养基时,加蔗糖10g。调节pH值为5.6~5.8,温度20~26℃,光照12 h/d,光照强度为2 000 lx左右[9-10]。
1.4 试验方法
1.4.1 愈伤组织的诱导培养将处理好的无菌外植体的叶片,四周切出伤口后分别接种到不同质量浓度激素配比的MS培养基[11]中,进行愈伤组织的诱导培养,在无菌培养室内培养40 d进行统计观察[12-13]。每种培养基接种100个材料,设4个重复[14]。
1.4.2愈伤组织分化培养将1.4.1继代培养的愈伤组织分散成小团块后,接种到不同种类不同浓度激素配比的MS培养基中,在光照下进行愈伤组织的分化培养[15-16]。设4个重复,每种培养基接种100个材料,培养50 d进行统计观察。
1.4.3 试管苗生根培养将继代培养生长旺盛的不定芽从基部剪下,分别接种到以MS,1/2MS,1/3MS为基本培养基,添加0.4 mg/LIAA+0.1 mg/LNAA培养基中进行生根培养[8]。培养30 d进行统计观察。1.4.4壮苗培养基的筛选以MS+0.8%琼脂+3%蔗糖为基础培养基,加入不同质量浓度的6-BA和NAA。6-BA设置1.0,1.5,2.0 mg/L等3个水平,NAA设置0.1,0.15,0.2 mg/L等3个水平。选择长势较好的基础苗进行壮苗,每个水平15瓶,每瓶插1~2株。接种后放置于光照培养室中,20 d后观察壮苗结果[17-18]。
2 结果与分析
2.1 诱导皂角愈伤组织培养基的筛选
设置不同激素浓度配比的愈伤培养基,将皂角叶片在不同组织培养基中培养40 d后,观察统计皂角在不同培养基中的愈伤情况。由表1可知,诱导皂角愈伤组织生长的最适培养基为MS+2 mg/L 6-BA+0.2 mg/LNAA+0.8%琼脂+3%蔗糖。
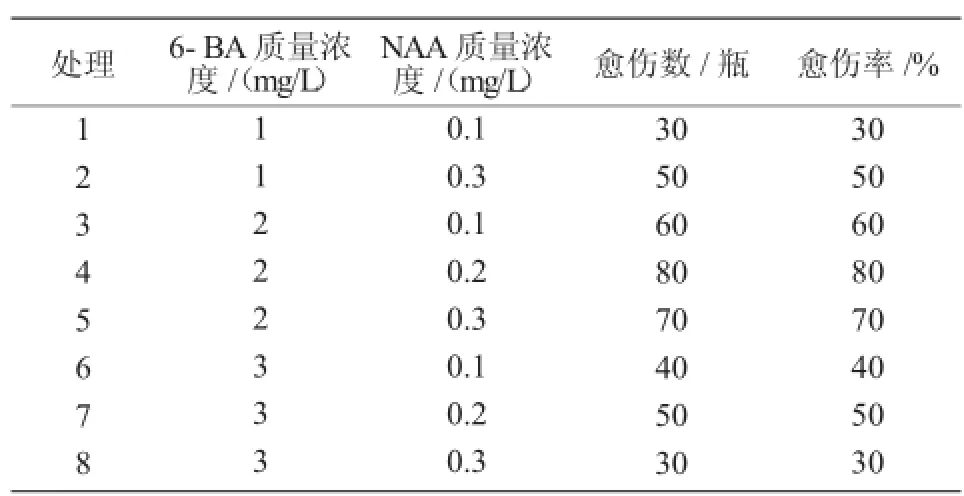
表1 不同培养基诱导皂角愈伤组织的效果(培养40 d后)
2.2 诱导皂角发芽生根培养基的筛选
设置不同激素浓度配比的分化生根培养基,将培养长好的愈伤组织,进行切割分装在不同分化培养基上进行培养[18]。从表2可以看出,皂角发芽生长的最适培养基为MS+1.0 mg/L 6-BA+1.5 mg/L NAA+0.8%琼脂+3%蔗糖。培养过程中从诱导皂角愈伤组织到发芽生根阶段,由于发芽和生根几乎同时进行,且对皂角进行了多个激素及培养基等密度梯度组织培养,并未发现皂角生根的最适培养基。
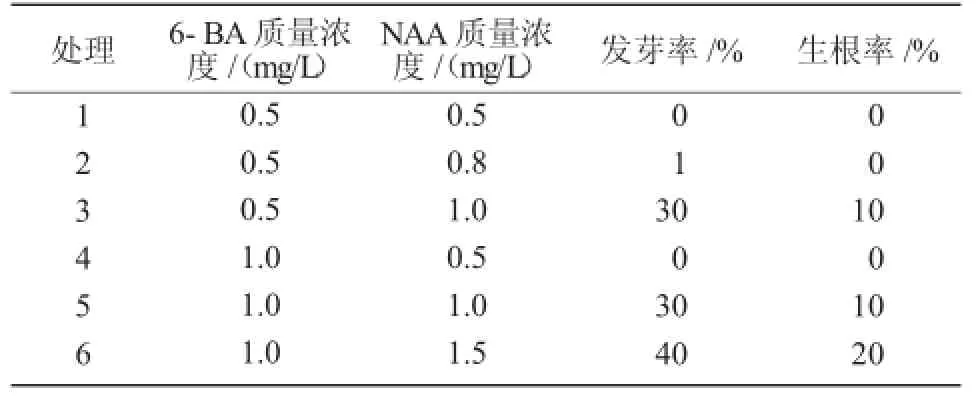
表2 不同培养基对诱导皂角发芽生根的影响(培养50 d)
2.3 皂角壮苗培养情况
设置不同激素质量浓度培养基筛选最适壮苗培养基,接种后放置于光照培养室中,20 d后观察壮苗结果。结果表明,皂角幼苗生长一段时间后,叶片及根部逐渐干枯甚至死亡,幼苗的大量繁殖未能完成。
3 讨论
无菌材料和无菌条件是植物进行组织培养的前提,要使植株能够在培养基中正常生长,必须对皂角叶片进行多次消毒,消毒时要考虑消毒液的浓度和时间,避免破坏原材料的生长活力,并且培养时在超净台里进行操作,一定要正确操作,保证植株不受污染[19]。
本试验皂角组织培养到了生根阶段便不能继续往下生长。其原因可能为:(1)生根培养基里生长素和细胞分裂素的浓度或二者比例,不适合皂角继续生根生长。(2)皂角在生根培养过程中,可能产生某种有害或抑制其生长的物质[20],导致其生根后不再生长,最后根部腐烂死亡。(3)琼脂和蔗糖的浓度可能影响培养植株的生长和发育,进而导致植株生长周期过长或者抑制了植株的生长。由于时间所限且进行琼脂和蔗糖最适浓度研究所需步骤较多较繁琐,因此,未能得到好的结果。
[1]中国科学院植物研究所.中国高等植物图鉴:第二册[M].北京:科学出版社,1980:442.
[2]江苏新医学院.中草药大辞典:上册[M].上海:上海人民出版社,2006:1293-1294.
[3]王晓萍.田皂角组织培养及无性系建立的研究[J].天津农业科学,2010,16(2):32-35.
[4]安利佳,姜长阳.植物组织培养导论[M].大连:辽宁师范大学出版社,2003:115-117.
[5]曹帮华,宋丽红,刘欣玲.光叶楮组织培养和快速繁殖技术的研究[J].山东科学,2006,19(2):29-32.
[6]张敏劳,陈佰鸿,赵长增,等.骆驼刺叶片再生体系的建立[J].中国沙漠,2009,29(2):316-320.
[7]邓百万,张兆清,刘世贵.几种豆科牧草植物组织培养体细胞诱变研究[J].汉中师范学院学报,2000,18(1):71-76.
[8]顾蔚.蚕豆组织培养中植物激素对愈伤组织单倍体和四倍体细胞的诱导[J].西北植物学报,1999,19(6):161-164.
[9]安利佳,李凤霞,张俊敏.豆科植物组织培养研究[J].植物学报,1992(10):734-752.
[10]王素卿.川桂组织培养体系建立初探[J].新农村,2011(9):39.
[11]姜长阳.培养基琼脂用量的商榷[J].植物生理学通讯,1990,16(2):53-54.
[12]舒文华,耿华珠,张男如,等.紫花苜蓿原生质体培养与植株再生[J].草地学报,1994,2(1):40-44.
[13]王冰洁,李厚华,阙怡,等.‘雪球’海棠组织培养体系的建立与优化[J].西北农林科技大学学报:自然科学版,2015,43(3):77-82.
[14]赵金梅,李芳,周禾,等.紫花苜蓿组织培养体系的建立[J].核农学报,2010,24(3):507-512.
[15]李厚华,阙怡,费昭雪,等.红果肉苹果组织培养及转基因体系的建立与优化[J].北方园艺,2011(15):175-179.
[16]郝红梅,田义,丛佩华,等.苹果离体叶片植株再生研究进展[J].中国果树,2011(1):55-60.
[17]阙怡,李厚华,付婉艺,等.西府海棠组织培养体系的建立与优化[J].东北林业大学学报,2013,41(5):86-89.
[18]师尚礼.不同培养基对三种豆科牧草花药培养影响的研究[J].甘肃农业大学学报,2000,35(1):43-46.
[19]Alika C,Deepak P.Regeneration and genetic tranformation of grain legumes:an overview[J].Current Secience,2003,84:381-387.
[20]Judit D,Jaime A.Micropropagation of apple:a review[J].Biotechnological Advances,2010,28:462-488.
Study on the Tissue Culture of Saponin
CHENDi1,YUANYuan1,YANGXiaojing1,WANGPing1,ZHANGLi1,TIANShuangmei2
(1.College ofLife Sciences,Shanxi Agricultural University,Taigu 030801,China;2.Jiaxian Agro-technologyExtension Center,Jiaxian 719200,China)
To establish the rapid propagation system,saponin young leaves as explants for tissue culture,the paper studied the effect of different hormone combinations on callus induction,shoot proliferation and seeding and rooting.The results showed that the optimal mediumfor callus induction was MS+2 mg/L6-BA+0.2 mg/LNAA+0.8%agar+3%sugar;optimum medium for germination and growth was MS+1.0 mg/L 6-BA+1.5 mg/L NAA+0.8%agar+3%sugar.However,the optimum rooting medium of saponin was not obvious.Saponins seedlings growing after a period of time,leaves and roots gradually dried up and even death,failed to transplant success,so a large number of the saponins seedling could not complete.To explore the tissue culture of saponin culture conditions,we may change the hormone concentration ratio of rooting culture medium and inhibite rooting culture in the process of harmful substances released or continue toexplore and studywith the removal ofhazardous substances.
saponin;tissue culture;callus;harmone combination
S792.99
A
1002-2481(2016)09-1247-03
10.3969/j.issn.1002-2481.2016.09.03
2016-05-08
山西省大学生科技创新项目(J1001160)
陈迪(1993-),女,山东菏泽人,在校学生,研究方向:生物科学。

