气相色谱-质谱法测定食用油中3-氯丙醇酯
苗雨田 杨悠悠 王 浩 刘 佟 杨永坛
气相色谱-质谱法测定食用油中3-氯丙醇酯
苗雨田 杨悠悠 王 浩 刘 佟 杨永坛
(中粮营养健康研究院北京市营养健康与食品安全重点实验室,北京 102209)
采用碱水解方式,基于苯基硼酸(PBA)衍生化方法并结合气相色谱-质谱(GC-MS)联用仪测定了食用油中3-氯丙醇(3-MCPD)酯的含量。经试验可知,水解时间是碱水解样品前处理方法的关键因素,经优化,大豆油等不同品类的食用油的最佳水解时间为1~6 min。另外,以大豆油为基质,考察了基于碱水解方式的分离分析方法的回收率、重复性以及检出限。其中,在150~1 500μg/kg范围内进行3水平加标回收试验,回收率为94%~105%、RSD 为3.7%~10.8%、检出限为15 μg/kg,定量限为50 μg/kg。本方法能够满足日常样品中3-氯丙醇(3-MCPD)酯的检测。
3-氯丙醇(3-MCPD)酯 食用油 碱水解 水解时间 气相色谱-质谱
3-氯丙醇(3-MCPD)酯是由甘油酯中1号或者3号位的羟基被氯原子取代而形成的一氯取代物,无色,具有愉快性香味。易溶于乙醇,水,乙醚,丙酮[1]。1980 年Davidek 等[1]在酸水解植物蛋白(HVP)中发现3-氯丙醇(3-MCPD)酯,此后陆续有研究者在各类热加工食品中发现不同水平的3-MCPD酯[2-6]。3-MCPD酯主要形成于食品的加工过程中,尤其是热加工过程,如油脂的精炼、氢化、脱臭等[7]。3-MCPD酯目前引起人们的广泛关注主要是由于3-MCPD酯被人体摄入后,会被脂肪酸酶水解成游离的3-MCPD,3-MCPD具有潜在的致癌性,并且能抑制雄性激素的分泌,使精子数减少,精子活性降低,生殖能力减弱,甚至不育[8]。
3-MCPD酯测定方法的研究已经成为食品安全检测的热点之一[9],目前对油脂中3-MCPD的测定主要有间接测定和直接测定的方法,间接测定的原理是将3-MCPD酯水解形成游离的3-MCPD,再将3-MCPD进行衍生,使用GC-MS进行测定,而直接测定是将样品净化后经液相色谱分离再使用质谱测定[10]。直接分析的方法比较难获得所需要的标准品且费用较高。间接法经济,所需标准品种类少,且灵敏度较高。间接法测定过程中,衍生化试剂有丙酮、全氟酰基咪唑(HFBI)和苯基硼酸(PBA)等[11]。丙酮在衍生时,需要利用甲苯-4-磺酸进行催化[12];HFBI可与许多氯丙醇作用,在羟基上引入七氟丁酰基,HFBI法衍生前需要确保溶液经过充分的脱水,此外还要采用硅藻土基质固相分散萃取法净化,操作复杂、繁琐,并且HFBI试剂价格很高[13];PBA只能与二醇类发生专一性化学反应,可直接在水溶液中与3-MCPD反应[14],所需前处理步骤较少,成本较低,在3-MCPD酯检测中较为常用。目前间接法测定3-MCPD酯的检出限为27 ~1 000 μg/kg[15]。
本研究采用间接测定方式,利用碱水解对样品进行样品前处理,优化了不同食用油的水解时间;使用PBA作为衍生化试剂,评价了衍生化时间对测定结果的影响;最后,使用GC-MS进行了目标化合物的测定。
1 材料与方法
1.1 原料与试剂
大豆油、花生油、菜籽油等9种食用油:市售;3-MCPD酯标准品(纯度98%、氘代同位素3-MCPD-d5酯(3-MCPD-1,2-dilaurate-d5)标准品(纯度98%):加拿大Toronto Research Chemicals公司;甲基叔丁基醚(MTBE,色谱纯)、苯基硼酸(PBA,分析纯):德国Sigma-Aldrich公司。
1.2 仪器与设备
安捷伦GC 7890B-5977MS气相色谱-质谱联用仪、HP-5MS色谱柱(30 m ×0.25 mm ×0.25 μm):安捷伦科技有限公司;TTL-DCⅡ氮吹仪:北京同泰联科技发展有限公司。
1.3 试验方法
1.3.1 碱水解
分别称取(100±5)mg大豆油等9种食用油样品,加入氘代同位素内标3-MCPD-d5酯标准品溶液和100μL甲基叔丁基醚(MTBE),漩涡使其充分溶解并混匀。向其中加入200μL 25 g/L NaOH甲醇溶液(25 g NaOH溶解到1 L甲醇中,现用现配),漩涡震荡0.5、1、1.5、2、2.5、3、5、7、10 min 后立即加入600 μL NaBr-H2SO4混合溶液(3.5 mL 25%H2SO4溶解在100 mL 600 g/L的NaBr溶液),涡旋充分混匀。其后加入600μL正己烷,充分涡旋后静置至少5 min,待溶液分层后,弃去上层正己烷溶液,重复萃取2次。最后加入600μL乙醚-乙酸乙酯混合溶液(3∶2),充分涡旋后静置,将上层溶液转移至10 mL装有少量无水MgSO4玻璃试管中,重复萃取3次。合并萃取液待用。
1.3.2 衍生化
向碱水解萃取液中加入100μL饱和苯基硼酸(PBA)溶液(溶剂为乙醚),涡旋混匀,反应时间为1~12 min。
1.3.3 纯化
将衍生液用氮气缓慢吹干,用1 mL正己烷复溶,涡旋1 min,静置1 min。将上清液过膜转移至2 mL小瓶中,GC-MS分析。
1.3.4 GC-MS 分析
色谱条件:进样口温度:280℃;程序升温条件:初始温度85℃,保持12 min,以20℃/min升至165℃,保持10 min,然后再以20℃/min升至300℃,保持8 min;载气:高纯氦气,流速为1 mL/min;进样方式:脉冲不分流;进样体积:1μL。
质谱条件:电子轰击离子源(EI),离子源温度230℃;四级杆温度150℃;溶剂延迟6 min;扫描方式:选择离子监测(SIM)模式。
2 结果与讨论
2.1 3-MCPD和3-MCPD-d5衍生物定性离子与定量离子的确定
样品中的3-MCPD酯在水解后会生成游离的3-MCPD,经过PBA衍生后形成相应的衍生物。m/z=196,198分别为3-MCPD衍生物氯35和氯37的分子离子峰,m/z=201,203分别是3-MCPD-d5衍生物氯35和氯37的分子离子峰。m/z=147,150分别是3-MCPD衍生物和3-MCPD-d5衍生物分子离子峰失去-CH2Cl和-CD2Cl后形成的基峰[16]。因此,选用m/z=147 和m/z=150 分别作为3-MCPD衍生物和3-MCPD-d5衍生物的定量离子,具有干扰小,灵敏度高等优点。定性离子则分别为:m/z=91、147、196、198 和m/z 149、150、201、203。另外,如图1所示,采用SIM模式时,3-MCPD衍生物和3-MCPD-d5衍生物的分离情况较好,且互不干扰,满足高灵敏度高准确度的要求。
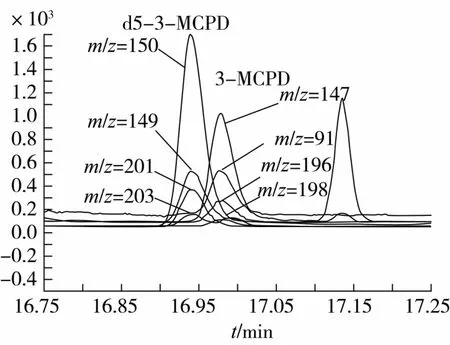
图1 3-MCPD和3-MCPD-d5选择离子图
2.2 碱水解样品前处理条件优化
2.2.1 水解时间
水解时间过短,可能会造成水解反应不彻底,不能得到全部的游离3-MCPD,若水解时间过长,3-MCPD酯已经被完全水解,在强碱性条件下,3-MCPD会进一步发生反应,影响测定结果的准确度。因此,衍生化时间的优化至关重要。
图2结果显示,不同食用油最佳水解时间不相同。以棕榈油为例,当水解时间为2 min时,响应值为最大响应值的78.6%。当水解时间为2.5 min时,响应值达到最大,相应值为12 402。水解时间延长后,响应值逐渐降低,当水解时间为10 min时,响应值仅为最大响应值的41.9%。因此在0.5~2.5 min,3-MCPD 酯处于水解阶段,而在2.5~10 min是3-MCPD的消除阶段。因此水解时间选择为2.5 min。由图2可知,大豆油的最佳水解时间为1 min。花生油在水解时间为1.5 min时,响应值达到最大。芝麻油和橄榄油的最佳水解时间分别为2.5 min和1.5 min,而玉米油、葵花籽油和葡萄籽油的最佳水解时间都为2 min。本研究中菜籽油在水解时间为2.5 min时,响应值达到最大,而傅武胜等[17]对菜籽油的水解时间进行优化,结果为1 min,与本试验结果的2.5 min不相同,这是由于NaOH甲醇溶液的用量或NaOH浓度不同造成。
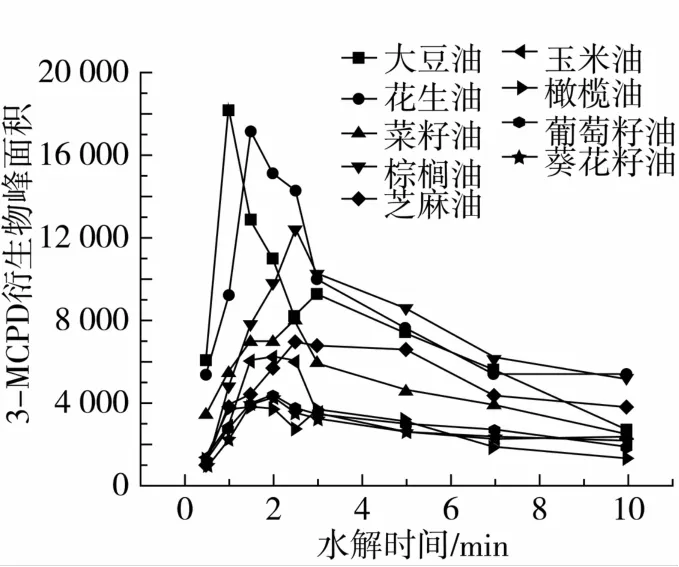
图2 水解时间对9种食用油3-MCPD衍生物响应值的影响
2.2.2 衍生化时间
3-MCPD是含有2个醇羟基,极性较大,容易造成衬管内的吸附。另外,分离时会造成色谱峰的拖尾。因此,测定时需要先将3-MCPD衍生化,本研究采用PBA为衍生化试剂,可与3-氯丙醇反应为极性较小的苯基硼酸3-氯丙二醇酯。
以棕榈油为研究对象,分别衍生1~12 min,重复试验3次(图3)。结果显示,3-MCPD衍生物的响应与衍生时间并无线性关系,随着衍生时间的变化,衍生物响应值无明显变化,因此本试验衍生时间选用1 min。

图3 衍生时间对3-MCPD酯衍生物响应的影响
2.3 方法学验证
2.3.1 回归方程、检出限和定量限
以内标3-MCPD-d5衍生物和3-MCPD衍生物面积比值Y和折算后样品中3-MCPD酯的浓度X(μg/kg)(以3-MCPD 浓度计)计算线性回归方程。以3倍信噪比(S/N=3)作为检出限,10倍信噪比(S/N=10)作为定量限。在最优条件下,线性回归方程、检出限和定量限的结果见表1。

表1 碱水解方法回归方程
2.3.2 精密度和回收率
以大豆油为基质,进行3个水平的3-MCPD酯的加标回收试验,各加标水平重复6次,碱水解方法下,3-MCPD的加标回收率为94%~105%,3-MCPD酯测定结果的相对标准偏差(RSD)为3.7%~10.8%。结果见表2。
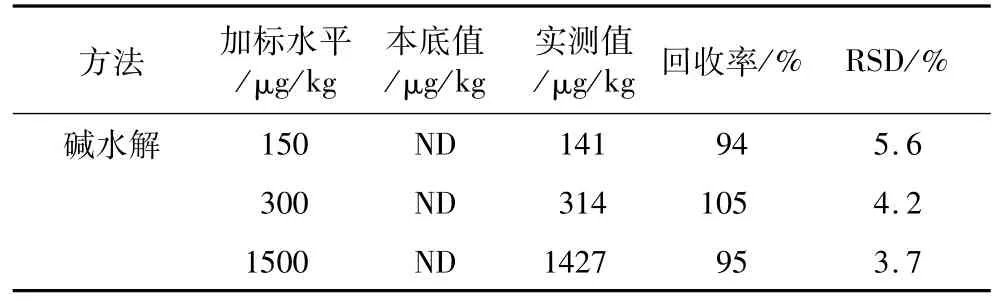
表2 3-MCPD酯碱水解前处理方法回收率
通过回归方程、检出限、定量限、精密度及回收率等方法学参数可知,回收率和精密度均符合GB/T 27404—2008的要求。本方法对食用油中3-MCPD酯的测定具有灵敏度高,特异性好,精密度高的特点,能够满足日常检测的需求。
2.4 实际样品检测
采用碱水解样品前处理方法建立的食用油中3-MCPD酯的气相色谱-质谱检测方法对市场中常见9种植物油中的3-MCPD酯含量进行了检测分析,如表3所示,大豆油和橄榄油中未检出3-MCPD酯。而花生油等食用油中3-MCPD酯均有检出。其中,葵花籽油含量最低,棕榈油中含量最高,应进一步加强对食用油中3-MCPD酯的监测和管理。植物油脂中3-MCPD酯的形成尚未完全清晰,多数研究表明是以酰基甘油为前体生成3-MCPD酯[18]。可能是在油脂脱臭过程中甘油三酯直接被氯化生成3-MCPD酯[18-20],或者甘油三酯先生成了环酰氧鎓离子再与氯离子反应生成3-MCPD酯[21]。
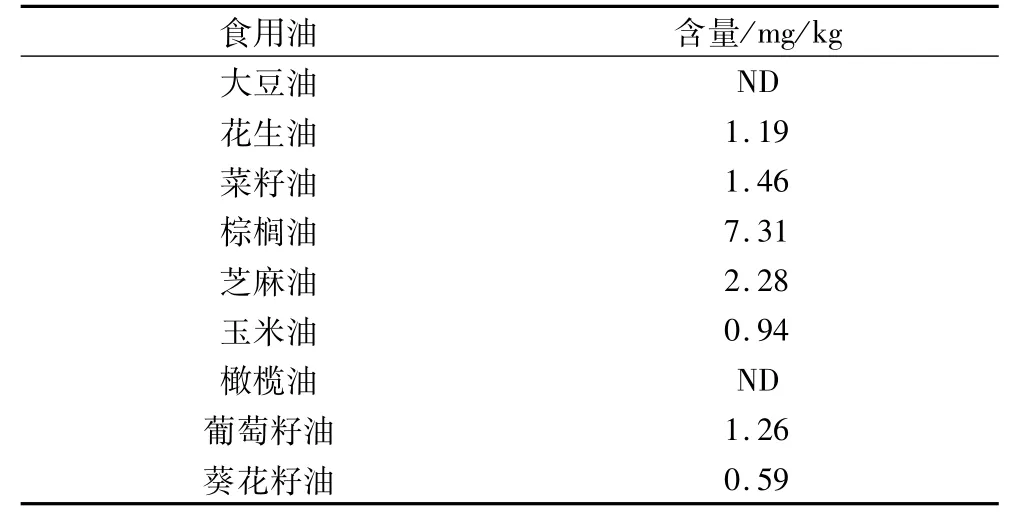
表3 9种食用油中3-MCPD酯的含量(以3-MCPD计)
研究显示,当温度超过200℃时,3-MCPD酯的形成急剧增加,尤其是超过240℃[22]。在大豆油精炼过程中采用的是水化脱胶,在脱臭过程中酸性物质较少,与氯离子的反应较少。而在棕榈油等植物油的精炼过程中采用的是磷酸脱胶和活化白土脱色的工艺[23],高温脱臭过程中酸性条件较强,加大了氯离子的取代反应,增加了3-MCPD酯的生成。因此,大豆油中未检测到3-MCPD酯,而在棕榈油中3-MCPD 酯的含量较高,为7.31 mg/kg。从国内外近年来的相关报道可以知道,油脂精炼过程是产生3-MCPD酯的主要途径,因此,在油脂精炼工序中,要加强对一些工艺因素如加水量、酸用量、酸种类、脱臭温度、脱臭时间等的控制和优化。
3 结论
本方法针对不同食用油对碱水解中所需水解时间进行了优化,方法学考察结果显示,经优化的碱水解方法具有定性准确,精密度高,灵敏度高等特点,能满足对食用油中3-MCPD酯分析的要求。采用本方法对市场中9种食用油的分析结果显示,除大豆油、橄榄油外,均含有不同含量的3-MCPD酯,其中,棕榈油含量最高,因此应加强对食用油中3-MCPD酯的监管。
[1]Davidek J,Velisek J,Kubelka V,et al.Glycerol chlorohydrins and their ester as products of the hydrolysis of tripalmitin,tristearin and triolein with hydrochloric acid[J].Lebensmittel-Untersuchung und-Forschung,1980,171:14-17
[2]Svejkovska B,Novotny O,Divinova V,et al.Esters of 3-chloropropane-1,2-diol in foodstuffs[J].Czech Journal of Food Sciences,2004,22:190-196
[3]Dolezal M,Chaloupska M,Divinova V,et al.Occurrence of 3-chloropropane-1,2-diol fatty acid esters in coffee[J].European Food Research Technology,2005,221:221-225
[4]Zelinkova Z,Svejkovska B,Velisek J,et al.Fatty acid esters of 3-chloropropane-1,2-diol in edible oils[J].Food Additives and Contaminants,2006,23:1290-1298
[5]Kuntzer J,Weisshaar R.3-MCPD-The smoking process-Apotent source for 3-chloropropane-1,2-diol(3-MCPD)in meat products[J].Deut Lebensm Rundsch,2006,102:397-400
[6]Larsen J C.3-MCPD esters in food products[M].Brussels:ILSI Europe,2009:1-25
[7]Hamlety CG,Sadd PA,Crews C.Occurrence of 3-chloropropane-1,2-diol(3-MCPD)and related compounds in foods:a review [J].Food Additives and Contaminants,2002,19:619-631
[8]赵丹宇.氯丙醇安全性的最新评价[J].中国食品法典通讯,2001(4):19-21
Zhao Danyu.A new evaluation of the safety of chloropropanols[J].Chinese Food Code Communication,2001,4:19-21
[9]张蕊,谢刚,张艳,等.食用油中3-氯-1,2-丙二醇酯检测方法的研究进展[J].中国粮油学报,2012(12):122-128
Zhang Rui,Xie Gang,Zhang Yan,et al.Research progress on the detection method of 3-chloropropane-1,2-diol(3-MCPD)[J].Journal of China National Cereals and Oils,2012,12:122-128
[10]王力清,陈洪涛,黄翠莉,等.食用油脂中3-MCPD脂肪酸酯和缩水甘油脂肪酸酯分析方法研究进展[J].粮食与油脂,2014(4):6-9
Wang Liqing,Chen Hongtao,Huang Cuili,et al.Research progress on the analysis method of 3-MCPD esters and glycerol ester fatty in edible oils [J].Food and Oil,2014(4):6-9
[11]Wenzl T,Ulberth F.Proficiency test on the determination of 3-MCPD esters in edible oil[EB/OL].JRCScientific and Technical Reports,2010,EUR 24356 EN.http://irmm.jrc.ec.quropa.eu/html/interlaboratory-comparisons/3-mcpd/index.htm
[12]Weisshaar R.Determination of total 3-chloropropane-1,2-diol in edible oil by GC-MS after ester cleavage with sodium methoxide[J].European Journal of Lipid Science and Technology,2008,110:183-186
[13]Zelinkova Z,Svejkovska B,Velisek J.Fatty acid esters of 3-chloropropane-1,2-diol in edible oils[J].Food Additives and Contminants,2006,23:1290-1298
[14]Kuhlmann J.Determination of bound 2,3-epoxy-1-propanol (glycidol) and bound monochloropropanediol(MCPD)in refined oils[J].Eur J Lipid Sci Technol,2011,113:335-344
[15]王卫华,徐锐锋,刘军,等.5种食品中氯丙醇测定方法研究进展[J].化学分析计量,2007,16:74-76
Wang Weihua,Xu Ruifeng,Liu Jun,et al.Research progress on determination method of the chlorine alcohol[J].Chemical Analysis Measurement,2007,16:74-76
[16]严小波,吴少明,里南,等.油脂性食品中脂肪酸氯丙醇酯检测方法的研究进展[J].色谱,2013,2:95-101
Yan Xiaobo,Wu Shaoming,Li Nan,et al.Research progress of detection method of chloride isopropyl ester in oils and fats [J].Chromatography,2013,2:95-101
[17]傅武胜,严小波,吕华东.气相色谱-质谱法测定植物油中脂肪酸氯丙醇酯[J].分析化学,2012,40:1329-1335
Fu Wusheng,Yan Xiaobo,Lü Huadong.Determination of chloride isopropyl ester in vegetable oils by gas chromatography /mass spectrometry [J].Analytical Chemistry,2012,40:1329-1335
[18]Rahn A K K,Yaylayan V A.What do we know about the molecular mechanism of 3-MCPD ester form action?[J].European Journal of Lipid Science and Technology,2011,113:323-329
[19]Svejkovska B,Dolezal M,Velisek J.Form action and decom position of 3-chloropropane-1,2-diol esters in models simulating processed foods[J].Czech J Food Science and Technology,2006,24:172-179
[20]Yaylayan V A.Molecular mechanism of 3-MCPD esters form action:facts and hypothesis[R].Belgium:ILSIWorkshop on 3-MCPD Esters,2009
[21]Hemlet C G,Sadd P A,Gray D A.Generation of mono chloropropaned iol(MCPDs)in model dough systems L.leavened doughs[J].Agriculture and Food Chemistry,2004,52:2059-2066
[22]杨娇,金青哲.食用植物油中3-氯丙醇酯的研究进展[J].中国油脂,2011(9):1-4
Yang Jiao,Jin Jin.Research progress of 3-MCPD esters in edible vegetable oil[J].China Oils and Fats,2011(9):1-4
[23]Ramli M R,Siew W L,Ibrahim N A,et al.Effects of degumming and bleaching on 3MCPD esters formation during physical refining [J].J Am Oil Chem Soc,2011,88(11):1839-1844.
Determination of 3-chloropropanol-1,2-diol(3-MCPD)Esters in Edible Oil by Gas Chromatography and Mass Spectrometry
Miao Yutian Yang Youyou Wang Hao Liu Tong Yang Yongtan
(China Oil Nutrition and Health Research Institution,Beijing Nutrition Health and Food Safety Key Laboratory,Beijing 102209)
3-chloropropanol-1,2-diol(3-MCPD)esters in edible oil was determined by alkaline hydrolysis method and gas chromatography/mass spectrometry (GC-MS)based on derivatization with phenylboronic acid(PBA).The experiment shows that the hydrolysis time was a critical factor in alkaline hydrolysis sample pretreatment procedures.The optimum hydrolysis time of different edible oils ranges from 1min to 6 min upon optimization.The recovery,repeatability and detection limit of the separation and analysis method based on alkaline hydrolysis method were evaluated with soybean oils as the research model.Based on the three levels marking recovery experiment in the range of 150~1 500 μg/kg,the recovery was between 94%and 105%,while the relative standard deviation ranges from 3.7%~10.8%.In addition,the limit of detection (LOD)and the limit of quantification were 15 μg/kg and 50 μg/kg,respectively.This method could meet with requirements of the routine detection of 3-chloropropanol-1,2-diol(3-MCPD)esters in edible oil.
3-chloropropanol-1,2-diol esters,edible oil,alkaline hydrolysis,hydrolysis time,gas chromatography/mass spectrometry
TQ646.4
A
1003-0174(2016)11-0135-05
中粮集团应用基础项目(2013-C2-F007)
2015-03-24
苗雨田,女,1988年出生,硕士,食品质量与安全
杨永坛,男,1971年出生,研究员,食品质量与安全

