纳米免疫传感器法快速测定粮油食品中的黄曲霉毒素B1
王瑞鑫 李书国
纳米免疫传感器法快速测定粮油食品中的黄曲霉毒素B1
王瑞鑫 李书国
(河北科技大学生物科学与工程学院,石家庄 050018)
以改性壳聚糖为固定化材料,包埋固定纳米金胶微粒及黄曲霉毒素B1抗体制备信号放大型纳米免疫传感器,建立了免疫传感器测定黄曲霉毒素B1的方法;优化了纳米免疫传感器的制备条件及检测参数;基于AFB1抗体与抗原之间的特异性免疫反应,以K3[Fe(CN)6]为探针,利用循环伏安法和差分脉冲伏安法研究了其免疫反应对传感器响应电流的影响,结果表明免疫响应电流与底液中AFB1的浓度在0.1~1.1 ng/g范围内成线性关系,其校正曲线方程为IP= -4.927 4x+15.108(R2=0.991 2),其最低检测限为0.05 ng/g(S/N =3);该免疫传感器的稳定性和重现性较好。利用该法对花生油、玉米油等实际样品中的AFB1进行了检测,其回收率为在87.8~98.2%,检测精确度优于ELISA试剂盒法,用于粮油食品中黄曲霉毒素的快速检测是可行的。
黄曲霉毒素B1免疫传感器 纳米金 快速检测 食品安全
黄曲霉毒素是一种具有强烈生物毒性和强致癌性的化合物,是由黄曲霉、寄生曲霉和特曲霉产生的次级代谢产物,常存在于发霉的粮油食品与饲料中,其中以花生和玉米最为严重[1]。黄曲霉毒素在其结构上共同的特征是含有一个双呋喃环和一个氧杂萘邻酮。迄今为止,已经发现B1、B2、G1、G2、M1、M2等十几种。其中,黄曲霉毒素B1被世界卫生组织癌症研究机构列为I类致癌物[2]。世界各国对农产品和食品中AFB1的含量进行严格的控制。欧盟国家出台了最为严格的限量标准为2.0μg/kg(在花生、坚果、干果和谷物中)。GB 2761—2011规定谷物、油脂及其制品中最大限量标准都是20μg/kg,婴幼儿配方及辅助食品中限量标准为0.5μg/kg。因此建立检测时间短、准确性高和灵敏度好的AFB1分析方法意义重大。
目前,检测AFB1的方法主要有色谱法[3]、层析法[4]、生物传感器法[5-6]、快速检测卡法[7]等,这些方法各有优缺点,色谱法和层析法灵敏度高、精确度好,但存在仪器昂贵、步骤繁琐等缺点。快速检测卡法操作简便、检测快速,但检测精度不足。电化学免疫传感器通过将抗原/抗体间特异性免疫反应信号转换为电信号,依据被测物不同浓度的信号变化构建相应数据模型,进行检测。随着特异性抗体不断地被研发出来,免疫传感器法正在迅速发展,电化学免疫传感器法凭借其检测灵敏度高和特异性好的优势,也成为该毒素检测的一种方法。
本研究以AFB1为研究对象,采用壳聚糖-金溶胶(CS-GNPs)复合膜修饰玻碳电极,将AFB1抗体与具有高比表面积、表面能和活性的金溶胶结合,制备了一种无标记的电流型免疫传感器。利用该免疫传感器成膜性极好且具有大比表面积的壳聚糖与具有良好生物兼容性的金溶胶有效固定抗体,利用小尺寸的金胶纳米粒子(约20 nm)能给抗体蛋白质分子提供更自由取向的特点,增加抗体蛋白与金胶纳米粒子的结合量,利用传感器界面的电流变化与黄曲霉毒素的浓度成线性关系测定AFB1的浓度。本研究构建的免疫传感器具有制备过程简单,灵敏度高、检出限低、稳定性好等优点,可应用于谷物食品、油脂中黄曲霉毒素B1的检测。
1 试验材料与方法
1.1 仪器与设备
LK98BⅡ型微机电化学分析系统:天津兰力科化学电子高技术有限公司;三电极系统(3 mm玻碳圆盘电极为工作电极、铂丝电极为对电极、Ag/AgCl电极为参比电极)、电解杯:上海CHI仪器公司;Multi-skan FC酶标仪:热电公司。
1.2 材料与试剂
黄曲霉毒素B1标准溶液、抗体、黄曲霉毒素B1试剂盒:深圳芬德生物技术有限公司;柠檬酸三钠(分析纯):北京精华耀邦医药科技有限公司;K3[Fe(CN)6](分析纯):天津市永大化学试剂有限公司;花生油、玉米油、花生、玉米:市售。
1.3 方法
1.3.1 CS-GNPs复合膜的制备
准确称取45 mg壳聚糖,溶解在4.5 mL体积分数为1%的醋酸溶液中,持续搅拌至无气泡,制得1%壳聚糖储备液,于4℃储存。50 mL 1.0×10-4g/mL的氯金酸在100 r/min磁力搅拌下,加热至沸腾,迅速加入0.01 g/mL 柠檬酸钠水溶液2 mL,煮沸5 min,溶液颜色由灰-蓝-紫,最后为酒红色,移去热源,搅拌10 min,冷却到室温,于4℃储存。在制备金溶胶之前,所有的玻璃仪器都需要用新鲜的王水即HCl/HNO3=3∶1 浸泡24 h,再用二次蒸馏水充分清洗干净。将壳聚糖溶液和金溶胶溶液等体积的混合后,于4℃冰箱过夜后待用。
1.3.2 电化学免疫传感器的制备
玻碳电极(GCE,直径3 mm)用0.05μm的氧化铝粉末仔细打磨抛光成镜面,并先后于1∶1硝酸溶液,无水乙醇和去离子水中超声1 min,最后将电极用氮气吹干待用。将电极置于0.2 mol/L硫酸溶液用速度为50 mV/s、电压为-1.0~1.0 V 的循环伏安法扫面约10 min,得到稳定的循环伏安图后,取出,用去离子水洗净,氮气干燥后备用。
免疫传感器的制备过程见图1。取5μL的CS-GNPs溶液滴于GCE表面,在25℃室温下自然晾干。之后将电极放入AFB1抗体中4℃孵育2 h。最后将电极于4℃下在1%的BSA/PBS(pH 7.4)溶液中浸泡30 min,已封闭活性基团,得到CS-GNPs修饰的电化学免疫传感器,于4℃保存待用。
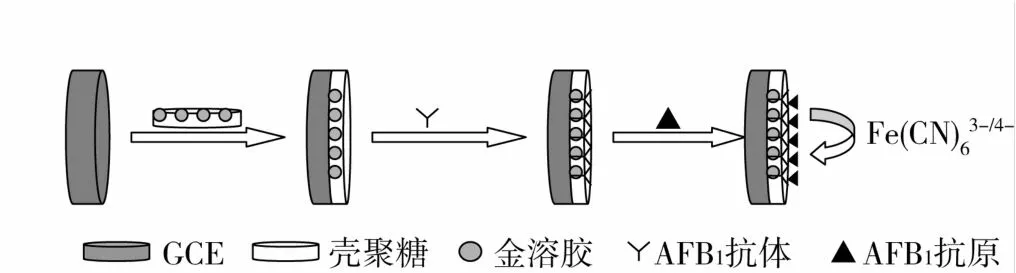
图1 免疫传感器的制备及免疫过程
1.4 电化学方法
电化学免疫传感器在不同浓度的AFB1标准溶液中于37℃下孵育25 min后,采用三电极体系(裸玻碳电极、免疫传感器或抗体-抗原复合电极为工作电极,Ag/AgCl标准电极为参比电极,铂丝电极为辅助电极),以1.0 mmol/L 的K3[Fe(CN)6]+0.1 mol/L 的KCl+0.2 mol/L 的PBS(pH 7.0)为测试底液,利用循环伏安法(电压:-0.2~0.6 V,扫描速度:50 mV/s)表征电极在修饰过程中不同阶段的电化学特征,利用差分脉冲伏安法(初始电位0.6 V,终止电位-0.2 V,电位增量0.005 V,脉冲幅度0.05 V,脉冲宽度0.05 s,脉冲间隔0.3 s,)记录峰电流值,并根据峰电流减量值与黄曲霉毒素B1浓度之间的关系建立数学模型关系。
1.5 样品的处理方法
称取2 g粉碎样品或液体于50 mL离心管中,加8 mL正己烷和10 mL样品提取液(70%甲醇,即甲醇∶去离子水= 7∶3(V/V),振荡5 min,室温4 000 r/min离心10 min;去除上层液体,取0.5 mL 下层液体加入0.5 mL去离子水混匀;取50μL进行分析。
2 结果与讨论
2.1 金溶胶溶液的表征
为了探索本试验所用纳米金溶胶的特性,利用紫外-可见光分光光度计对金溶胶溶液进行多波长扫描,获得金溶胶紫外-可见光吸收光谱,测定其最大吸收波长,吸收峰值和峰宽,如图2所示。纳米金溶胶对于光的吸收属于等离子共振吸收,球状粒子的等离子共振吸收是由高于费米能级的导带中自由电子在交变磁场的偶极震荡引起的,不同的偶极震荡与粒子的粒径大小有一定的关系。根据文献报道[8-10],当最大吸收波长稳定在520 nm左右,金溶胶颗粒的平均直径为10 nm左右,颗粒形状规则,分散性较好。

图2 金纳米粒子的紫外可见光谱
2.2 CS-GNPs/GCE修饰电极的电化学表征
在1.0 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.2 mol/L PBS(pH 7.0)的测试底液中,采用循环伏安法对裸玻碳(a)、CS/GCE(b)和CS-GNPs/GCE(c)3种电极的电化学性质进行了表征(图3)。如图所示,Fe(CN)63-/4-在裸玻碳电极上出现1对较好的氧化还原峰。当电极的表面修饰了壳聚糖后,修饰电极的氧化还原峰电流减少,这是由于壳聚糖的导电性不好,对电子在电极表面上传递起阻碍的作用。然而,金溶胶的引入明显提高了电极的电化学响应,使CS-GNPs/GCE的氧化还原峰电流均增加,这是由于金胶纳米粒子通过壳聚糖固定在电极的表面,即形成电子与电极之间电子传递的活性中心,金纳米粒子相当于纳米尺寸的微电极,可作为电子与裸电极之间的传输通道。3种电极根据Randles-Sevcik方程[11],电极的电活性面积由公式求出。

式中:A为有效电极面积/cm2,Ip阳极峰电流(μA),D 为扩散系数(7.6 ×10-6cm2/s),n 为参与氧化还原反应的电子数(n=1),γ为电位变化速率(0.05 V/s),C 为K3[Fe(CN)6]的浓度(1 mmol/L)。根据计算得,裸玻碳电极、CS/GCE和CS-GNPs/GCE 的电活性面积分别为0.076、0.053、0.083 cm2。可知,金溶胶的加入明显地增加了电极的表面电活性面积,从而提高了免疫传感器的灵敏度。
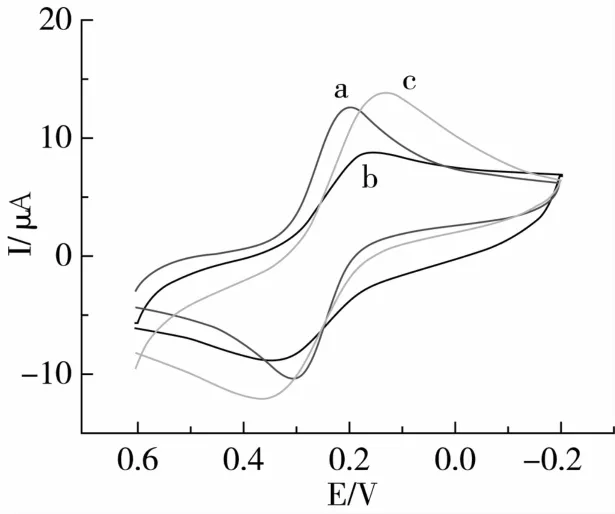
图3 不同修饰电极的循环伏安图
当修饰电极浸泡于AFB1抗体后,氧化还原峰的电流减少(图4中a和b),这是由于带正电荷的抗体蛋白通过静电相互作用牢固的吸附在带负电荷的的金胶纳米粒子表面上,抗体的绝缘性阻碍了电极表面的电子传递,说明AFB1抗体已经成功固定在电极表面上。将此修饰电极继续放入AFB1溶液中,anti-AFB1和AFB1发生了特异性结合生成免疫复合物,增加了电极表面的空间位阻,使探针Fe(CN的氧化还原峰电流进一步降低(如图4中的b与c线),这表明anti-AFB1和AFB1的特异性免疫反应成功。
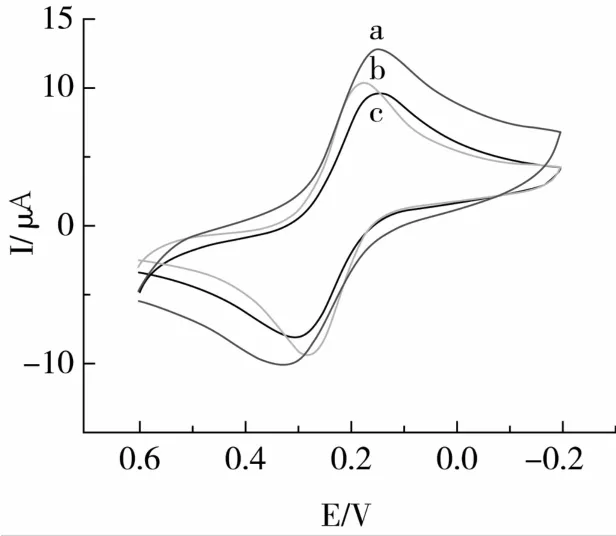
图4 修饰电极免疫前后的循环伏安图
将CS-GNPs/GCE修饰电极在不同扫描速率(20~120 mV/s)下做循环伏安扫描,如图5所示,随着扫描速度的增加,氧化还原峰的电流均增加,扫描得到的氧化峰和还原峰的电流值都分别与扫描速率的平方根成线性关系:氧化峰y=-2.584 7x-1.617 3,线性相关系数R2= 0.994 0;还原峰y =3.626 4x-0.443 4,线性相关系数R2=0.994 1。说明该电极反应受扩散过程控制。
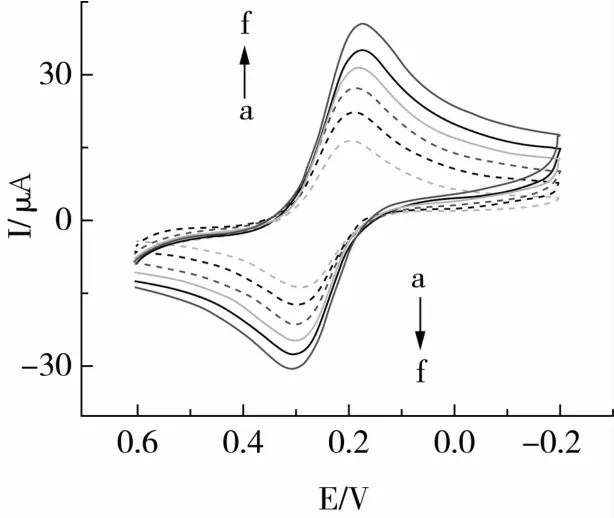
图5 电化学免疫传感器在不同扫描速度下的循环伏安图
2.3 试验条件的优化
2.3.1 修饰膜的厚度
壳聚糖-金溶胶膜的不同厚度可能影响电子的传递,本试验分别用2、5、8、12μL的修饰液滴涂在玻碳电极上,然后检测电子在其表面上电流的大小。结果表明,电流一开始是逐渐增大的,当修饰膜材料的用量为5μL时,电流最大。然后随着膜厚度的增加电流逐渐减少,可能由于修饰膜厚度过大影响了电子的传递速率,所以选择修饰膜材料的用量为5μL。
2.3.2 温育时间与温度对免疫传感器的影响
抗体与抗原温育时间和温度对免疫反应有重要的影响。为了选择最佳的温育时间,将电化学免疫传感器放入1.0×10-9g/L AFB1溶液中,反应不同的时间,利用差分脉冲伏安法测定其响应电流的变化,如图6中曲线a所示。在5~20 min范围内电流的变化随温育时间的增大而减少,这也说明了抗原与抗体需要一定的时间才能形成稳定的免疫复合物。当反应达到25 min后,电流变化值不明显,这表明固定的抗体与游离的抗原的结合达到一个饱和的状态。通常温度的升高可以加速免疫复合物的形成,但升高温度的同时可能会使具有蛋白性质的抗原与抗体失活。所以在上述最佳温育时间的条件下,研究温育温度在15~40℃范围内对免疫反应的影响,如图6中曲线b所示。在15~35℃范围内,响应电流随温度升高而增大。在35℃时达到最大值,但当温度高于35℃后,响应电流的值反而减少,原因是免疫复合层受到高温的破坏,影响了免疫传感器的性能。所以试验选取35℃为最佳温育温度。
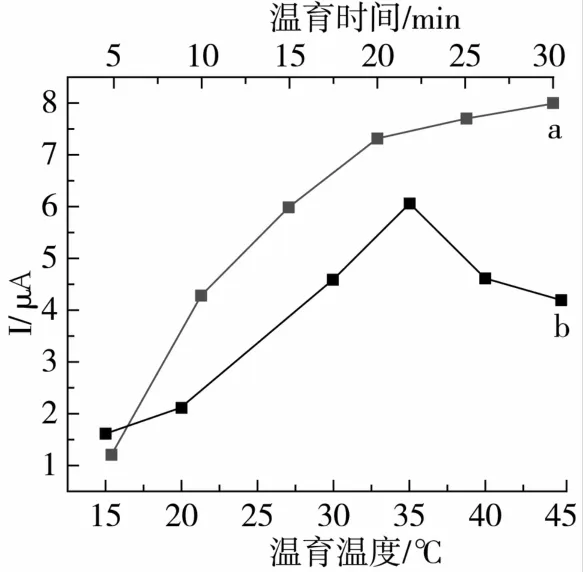
图6 温育时间和温度对免疫传感器DPV峰电流的影响
2.3.3 介质pH对免疫反应的影响
检测底液的pH对检测信号的峰电流有着重要的影响。不同的底液pH,将会导致相同条件下扫描的峰电流不同。当溶液的pH为7.0时,所得的检测信号峰电流IP最大,表明在pH为7.0时,检测体系能够达到最高灵敏度,这可能是因为酸度过高或过低,抗体中部分基团的质子化或解离导致抗体活性下降所致。所以试验选择pH 7.0的PBS配制检测体系溶液。
2.4 免疫传感器对AFB1的差分脉冲响应检测
配制系列浓度的AFB1标准溶液,按照1.5节的方法测得传感器在不同浓度标准溶液中的差分脉冲响应电流值,以抗体与抗原结合前后电流差值为纵坐标,抗原浓度大小为横坐标,以此来做标准曲线,如图7所示。在0.1~1.1 ng/g之间时免疫反应电流IP值随AFB1浓度的增大而减小,且IP值与CAFB1之间的关系满足线性关系方程:IP=-4.927 4x+15.108 ,线性相关系数R2=0.991 2,其最低检测限为0.05 ng/g(S/N =3)。

图7 AFB1的浓度对免疫传感器响应电流的影响
2.5 免疫传感器的稳定性与重现性
将制备好的电化学免疫传感器连续扫描20次,免疫响应电流响应仅下降3.5%。然后将其置于4℃密闭保存,用来检测AFB1溶液,30天后检测信号为第1天的87%,表明传感器的寿命较好,可以保持一定的使用周期。
2.6 样品中痕量AFB1的测定及加标回收试验
按1.5方法处理,得到提取液,按照前面优化好的试验条件,分别采用免疫传感器法和酶联免疫法(ELISA)为检测方法检测花生油、玉米油、花生和玉米4种样品中AFB1的含量,2种方法的实测值分别为2.67、1.80、6.31、4.16 和2.55、1.73、6.25、4.11 ng/g。加标回收试验的结果如表1所示,由表1可见2种检测方法的结果基本一致,但免疫传感器法检测灵敏度优于ELISA法。
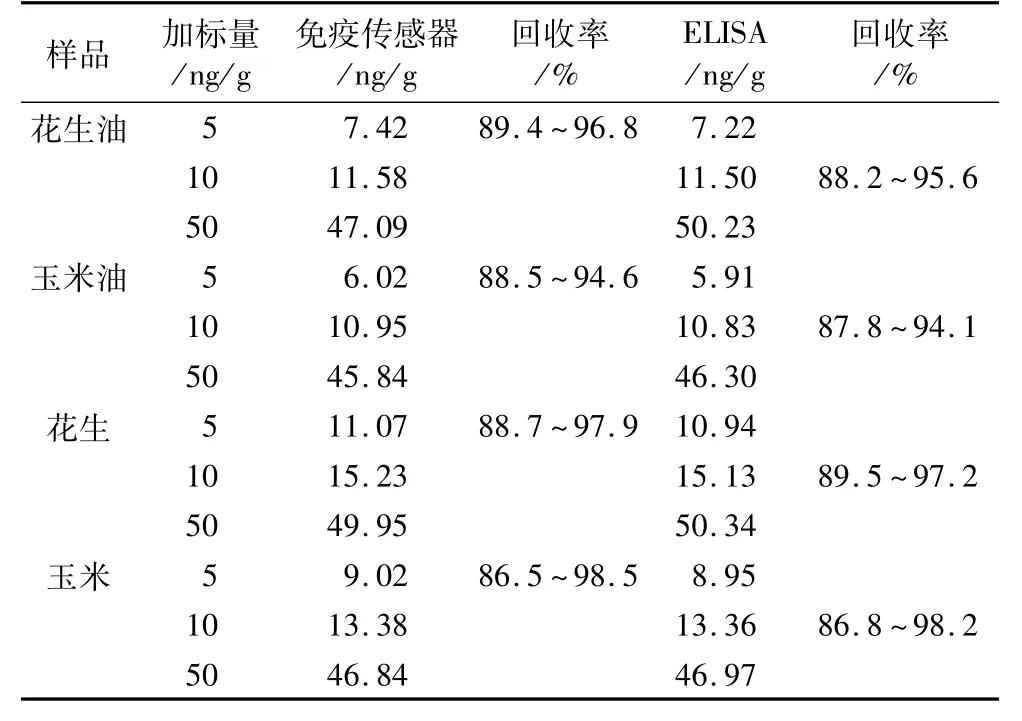
表1 样品中AFB1含量的测定结果
3 结论
利用壳聚糖-金溶胶复合膜修饰玻碳电极,采用表面带负电荷的金纳米粒子的导电高分子膜以静电相互作用使抗体蛋白牢固的吸附在电极的表面,制备了一种信号放大型的安培型黄曲霉毒素B1免疫传感器,提高了AFB1检测的灵敏度。该纳米免疫传感器利用成膜性极好的壳聚糖分散金胶纳米粒子来固定抗体,金纳米粒子相当于纳米尺寸的微电极,可作为氧化还原蛋白质与裸电极之间的传输通道,提高了免疫传感器的信号响应灵敏度;用壳聚糖分散金胶纳米离子,不仅增大了黄曲霉毒素B1抗体在电化学免疫传感器上的固载量,并且保证了免疫传感器的稳定性。此外,该传感器制作过程简单、灵敏度高、稳定性好、特异性强、可以用于粮油食品中AFB1的快速、简便、灵敏检测。
[1]Mishra H N,Das C.A review on biological control and metabolism of aflatoxin[J].Critical Reviews in Food Science and Nutrition,2003,43(3):245-264
[2]李力,曹以诚,区镜深,等.黄曲霉毒素B1致癌毒性相关基因的生物信息学分析[J].现代食品科技,2013,29(8):1994-1998
Li Li,Cao Yicheng,Ou Jingshen,et al.Bioinformatic analysis of genes relative to the carcinogenic toxicity of aflatoxin B1[J].Modern Food Science and Technology,2013,29(8):1994-1998
[3]Kandpal L M,Lee S,Kim M S,et al.Short wave infrared(SWIR)hyperspectral imaging technique for examination of aflatoxin B1(AFB1)on corn kernels[J].Food Control,2015,51:171-176
[4]Liu Binghui,Hsu Yutien,Lu Chuanchen,et al.Detecting aflatoxin B1in foods and feeds by using sensitive rapid enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip [J].Food Control,2013,30:184-189
[5]Castillo G,Spinella K,Poturnayova A,et al.Detection of aflatoxin B1by aptamer-based biosensor using PAMAM dendrimers as immobilization platform[J].Food Control,2014,12(16):1-44
[6]Ammida N H S,Micheli L,Palleschi G.Electrochemical immunosensor for determination of aflatoxin B1in barley[J].Analytica Chimica Acta,2004,520(1):159-164
[7]Shim WonBo,Kim MinJin,Mun Hyoyoung,et al.An aptamer-based dipstick assay for the rapid and simple detection of aflatoxin B1[J].Biosensors and Bioelectronics,2014,62:288-294
[8]孙秀兰,赵晓联,汤坚.纳米金溶液形成过程的可见光吸收光谱研究[J].无锡轻工大学学报,2004,23(4):86-89
Sun Xiulan,Zhao Xiaolian,Tang Jian.The UV-Visible spectrum studies on formation process of colloidal gold particles[J].Journal of Wuxi University of Light Industry,2004,23(4):86-89
[9]陈亭汝,张玮,孟祥英,等.纳米金溶液的合成及紫外-可见吸收光谱的研究[J].应用化工,2009,38(9):1273-1275
Chen Tingru,Zhang Wei,Meng Xiangying,et al.Synthesis of goldnanosol and study on ultraviolet-visible absorption spectra [J].Applied Chemical Industry,2009,38(9):1273-1275
[10]彭菊村,卢强华,吴波英.试剂的浓度和加入顺序对水相合成金纳米颗粒的影响[J].稀有金属,2006,30(4):552-555
Peng Jucun,Lu Qianghua,Wu Boying.Effects of reagent concentrations and mixing procedure on Au nanoparticles prepared in aqueous solution [J].Chinese Journal of Raremetals,2006,30(4):552-555
[11]Bard Allen J,Faulkner Larry R.Electrochemical methods fundamentals and applications[M].New York:Wiley,2000:620-621.
A Nano Immunosensor for Rapid Determination of Aflatoxin B1in Grain and Oil Food
Wang Ruixin Li Shuguo
(Hebei University of Science and Technology,Shijiazhuang 050018)
Using modified chitosan as immobilizing materials,gold nano particles and aflatoxin B1antibody were embedded and immobilized to prepare signal-enlarging Nano immunosensor to establish the method of immunosensor
to determine aflatoxin B1in grain and oil food.Preparation conditions and determination parameters of Nano immunosensors were optimized;Based on the Specific immune reaction between antibody and antigen of AFB1,the effects of immune response on the immunosensor response current were investigated by cyclic voltammetry and differential pulse voltammetry using K3[Fe(CN)6]as the probe.The results showed that the immune response currents formed a linearl relationship with the concentration of aflatoxin B1in the range of 0.1 ~1.1 ng/g,its calibration curve equation was y = -4.927 4x+15.108,R2=0.991 2 with the lowest detection limit of 0.05 ng/g(S/N =3);Excellent stability and reproducibility of the immunosensor were observed in the selected condition.The developed method was applied to the determination of aflatoxin B1in peanut oil,maize and maize oil samples,and the recovery rate was 87.8~98.2%.Being more precise and accurate than ELISA method,it was practicable for rapid determination of aflatoxin B1in grain and oil food with simple pretreatment.
aflatoxin B1,nano immunosensor,gold nanoparticles (GNPs),rapid determination,food safety
TS21
A
1003-0174(2016)11-0145-06
国家自然科学基金(20876165),河北省食品药品安全科技项目计划(PT2014027)
2015-03-23
王瑞鑫,男,1992年出生,硕士,食品科学与安全
李书国,男,1969年出生,教授,粮油食品安全技术

