以脑梗死为首发症状的脑血管淀粉样变性1例
李青云,来青伟,李昕昱,袁蕊,胡朋,樊红彬
·个案报道·
以脑梗死为首发症状的脑血管淀粉样变性1例
李青云1,来青伟2,李昕昱1,袁蕊1,胡朋2,樊红彬2
脑血管淀粉样变性;脑梗死;脑出血;抗栓治疗
脑血管淀粉样变性(cerebral amyloid angiopathy,CAA)是一种常见的小血管疾病,主要由于β样淀粉蛋白沉积在血管壁内造成,是颅内自发性出血的主要原因[1]。除出血性脑损伤以外,CAA也和广泛的脑缺血损伤有关[2,3]。本文报道1例以脑梗死为首发症状的CAA患者,并结合文献进行复习。
1 临床资料
患者,男,64岁,因“突发右侧肢体麻木无力伴有言语不清1 d”于2015年8月2日入院,患者既往体健,无原发性。高血压、糖尿病、心脏病史。体格检查:体温36.2 ,心率70次/分,血压135/80 mmHg(1 mmHg=0.133 kPa),心肺腹检查未见异常。神经系统检查:神志清楚,运动性失语,颅神经未见异常,右上肢肌力3级,右下肢肌力4-级,左侧肢体肌力5级,右侧肢体肌张力增高,右侧巴氏征阳性,脑膜刺激征阴性。深浅感觉及共济运动未见异常。入院后查头颅MRI示左侧额顶叶多发急性梗死(图1A)。初步诊断:脑梗死。予以抗血小板、改善循环、营养神经等综合治疗。完善各项辅助检查:血尿粪常规、肝肾功能、电解质、凝血功能、HCY均于正常值范围。甘油三脂1.97 mmol/L(参考值0.56~ 1.70 mmol/L),梅毒螺旋体抗体呈阴性,自身免疫相关指标均未见异常。头颈部CTA示右侧大脑后动脉P1段狭窄,颅脑及颈部血管轻度动脉粥样硬化性改变(图1B)。未发现梗死相关责任血管狭窄。患者经过治疗后,症状有所好转。8月14日,突发右侧肢体无力加重,查体见意识清晰,双侧瞳孔等大等圆,瞳孔直径3.0 mm,对光反射灵敏。右上肢肌力2级,右下肢肌力3级,急查头颅CT示多发性脑梗死,部分软化灶形成,左侧额顶叶脑梗死伴出血性转化(图1C),停止抗血小板药物的使用,予以脱水降颅压治疗,患者症状有所好转。查体示右上肢肌力4级,右下肢肌力5-级。9月5日,患者再次诉右侧肢体无力加重,查体:右上肢肌力3级,右下肢肌力4级,余体格检查无明显变化。急查头颅CT示较前片左侧顶叶高密度灶有所吸收,提示患者颅内无出血量增多或新出血灶形成,考虑有急性梗死(图1DE)。9月6日,患者右侧肢体无力症状进行性加重,复查头颅CT较前无明显变化。于9月12日复查头颅MRI示左侧额顶叶大面积脑梗死伴出血性转化,内部出血稍增多(图1F-G)。9月16日复查头颅CT示多发性脑梗死,较9月6日新增左侧顶叶出血灶(图1H)。患者反复出现梗死、出血,且并未发现和责任病灶相关的血管狭窄,考虑并非单纯的脑梗死伴出血转化,于9月18日完善颅脑磁敏感加权成像(usceptibility weighted imaging,SWI)示左侧额顶颞叶较广泛出血灶(左侧额顶颞叶出血性梗死?),两侧基底核区陈旧性或慢性出血灶征象(图1I)。结合患者症状,诊断考虑可能CAA。予以脱水、降颅压,改善循环及营养神经治疗,患者病情未再反复,偏瘫及言语不清症状有所好转,可自主行走,查体可见右上肢肌力3级,右下肢肌力4+级。于10月2日出院。随访2月,患者一般情况可,病情平稳,11月23日复查头颅CT示多发性脑梗死伴左侧额顶叶出血性转化治疗后(图1J)。
2 讨论
CAA是老年人常见的病理改变。国外有尸检发现,在70岁以上的老年人中,CAA发病率大约可达25%,在痴呆患者中,其患病率更高达50%~80%[4]。CAA是以淀粉样蛋白在皮质小血管和软脑膜血管的血管壁中沉积为特点的病变,较少出现在皮质的毛细血管中。轻度CAA主要为少量淀粉样蛋白沉积于皮质下小血管及软脑膜中。中~重度CAA,大部分动脉及小动脉都会有淀粉样蛋白沉积,严重时,动脉中层弹力层完全被淀粉样蛋白所代替,导致中层薄弱,血管脆性增加,继而出现血管扩张、微动脉瘤形成甚至破裂出血[5]。近年来研究发现多种CAA相关血管病变,包括双腔样改变、微动脉瘤形成、纤维素坏死、葱皮样血管,淋巴细胞浸润,微小动脉以及血管内膜玻璃样变等,常见于重度CAA患者,可引起严重管腔狭窄,使CAA及其相关疾病的发生率均增加[6]。CAA临床表现较复杂,缺乏特异性。轻度CAA常存在于正常老年人脑中而不表现出任何症状,重度CAA可表现为反复和/或多发的脑叶出血、快速进展性痴呆,短暂性神经缺损,亚急性认知功能减退以及癫痫发作等[7]。
脑叶出血是CAA最常见临床表现,与其他形式的脑叶出血表现类似。与脑深部出血相比,典型的脑叶出血常导致急性痫样发作。首次由CAA引发的脑出血,临床症状可相对缓和,但提示有再出血的高风险。其特点是出血通常聚集在相对较短的时间内(一般是几周之内)。复发的出血通常为典型的脑叶出血,且经常出现在与首次出血部位相同的脑叶[8]。多个脑叶同时出血也是CAA相关脑出血的特点。本例患者两次脑出血间隔大约1月,虽然在治疗过程中有服用抗血小板药物,不能排除脑出血和服用血小板药物相关,但两次出血均发生在左侧额顶叶,较符合CAA相关脑出血的特点。
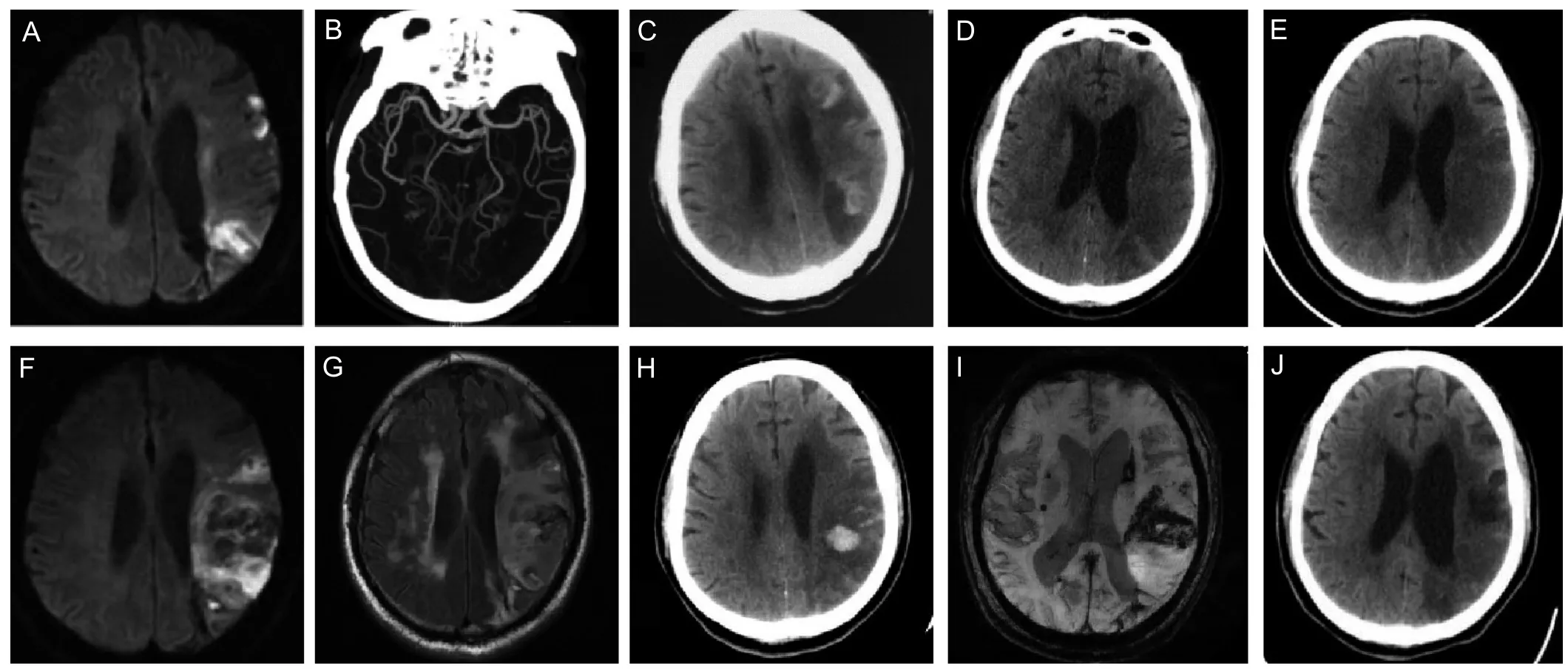
图1 患者头颅影像学检查
短暂性神经功能缺损是CAA临床表现之一,并且是散发型CAA除脑出血外最常见的表现[9],常反复发作,有刻板性,发作较短暂(常<30 min),并且临床症状较为宽泛。CAA相关的短暂性神经功能缺损症状并非是一个良性病程,均与症状性脑叶出血的早期高风险相关(大约50%在2~3月内)[10]。
CAA常与脑内广泛的缺血性损伤有关,主要是微梗死和脑白质病变。微梗死主要出现在皮质和皮质下脑叶,常在重度CAA中出现。脑白质病变在头颅MRI T2像或Flair像上可表现为高信号,相对于健康老年人甚至是阿尔茨海默病患者,CAA患者的脑白质病变可表现更为严重[11]。进展中的CAA,白质高信号的体积会随着时间增加较迅速,可在1~2年中,增加约18%[12]。其可能的机制是由于淀粉样蛋白的负荷较多导致血管闭塞和脑灌注减低造成。本例患者的头颅MRI-Flair像显示两侧侧脑室旁多发高信号。患者以脑梗死为首发症状,在治疗过程中反复有出血与梗死出现,这较为罕见。Gregoire等[13]发现在急性脑出血后,颅内常继发急性的、临床症状不明显的缺血病灶,且这种病灶在CAA相关脑出血中出现的概率为其他自发性出血后出现概率的3倍。在没有明确的血管疾病危险因素的情况下,CAA中同时出现出血和缺血性脑损伤,可认为是CAA同时导致出血和缺血性脑损伤。确切的病理生理学机制尚不明确,可能有如下两个方面:①由于CAA对血管结构及功能的损害,增加脑梗死的易感性[9,14]。淀粉样蛋白在血管内的过度沉积导致血管自身调节功能的受损、内皮机能障碍、血脑屏障破坏、血管壁增厚,甚至血管闭塞[14,15]。②局部缺血可能是由于脑出血后血压的急速下降造成[16],且继发的局部缺血与出血后产物的清除相关[17]。总之,这些可能的机制都提示一个复杂、潜在的自我强化循环的过程,使淀粉样物质沉积和血管功能障碍互相加剧。
CAA的金标准是病理检验,在临床上较难做到。然而,在临床工作中,可参照波士顿标准作为CAA的诊断依据,其特异性可达88%~92%[18]。MRI-SWI能敏感地识别各个时期的出血灶,发现微出血的分布范围。大量的脑叶微出血,尤其是在排除深部微出血和可造成微出血的其他病因存在的情况下,如高血压、CADASIL,被看做是CAA影像学的一个典型特征[19]。因此SWI在识别和诊断可能的CAA中发挥重要作用。本例患者的一系列影像学图像(额颞叶广泛出血伴两侧基底核陈旧性出血灶),和波士顿诊断标准中的可能CAA相符合,其标准是年龄≥55岁;临床表现和MRI或CT检查发现局限于脑叶、皮质或皮质下(包括小脑)多灶性出血;排除其他引起出血的原因。
目前,尚无有效的治疗可阻止或逆转淀粉样蛋白的沉积。因此临床上治疗CAA的重点是预防CAA引起的其他症状,例如反复发作的出血。对于新诊断的CAA相关出血,在治疗上,与其他原因脑出血的内科治疗大体相似。许多老年患者合并血管闭塞和颅内出血的风险,判断在脑出血后使用抗血栓形成相关治疗的获益和风险已成为临床上面临的主要挑战。目前可获得的相关研究证据较少。一项关于自发性脑出血的前瞻性研究结果显示,排除其他可导致颅内出血的因素后,阿司匹林与脑出血的复发有一定的相关性。且再出血的风险与枕叶微出血的数量和脑白质病变程度有关,这也可看做是可能的CAA及其严重程度的标志[20]。Gregoire等[21]发现脑叶微出血和抗血小板相关脑出血有相关性,提示在CAA与抗血小板相关脑出血中间有一定的联系。由此,笔者认为对于CAA患者,应尽量避免抗血栓形成药物的使用,除非有比复发脑出血更严重的风险存在。如肺栓塞和心脏瓣膜机械瓣置换后等。本例患者在服用抗血小板药物后反复出血,颅内血管虽然存在狭窄,但并未出现与之相关的梗死,综合考虑,建议患者慎用抗血小板药物。
综上所述,CAA临床症状不典型,容易造成漏诊、误诊,对于年龄较大的患者,同时有梗死、出血存在的情况,或无明显血管危险因素出现类似于TIA症状的情况,可进一步完善头颅MRI-SWI的检查,以明确是否为可能的CAA,对于这样的患者,需考虑梗死与出血的风险比率,来决定是否使用抗血小板及抗凝药物。
[1]Finelli PF,Kessimian N,Bernstein PW.Cerebral amyloid angiopathy manifesting as recurrent intracerebral hemorrhage[J].Arch Neurol,1984, 41:330-333.
[2]Gurol ME,Viswanathan A,Gidicsin C,et al.Cerebral amyloid angiopathy burden associated with leukoaraiosis:a positron emission tomography/ magnetic resonance imaging study[J].Ann Neurol,2013,73:529-536.
[3]Kövari E,Herrmann FR,Hof PR,et al.The relationship between cerebral amyloid angiopathy and cortical microinfarcts in brain ageing and Alzheimer's disease[J].Neuropathol Appl Neurobiol,2013,39:498-509.
[4]Jellinger KA.Vascular-ischemic dementia:an update[M].Springer Vienna,2002.
[5]Yamaguchi H,Yamazaki T,Lemere CA,et al.Beta amyloid is focally deposited within the outer basement membrane in the amyloid angiopathy of Alzheimer's disease.An immunoelectron microscopic study[J].Am J Pathol,1992,141:249-259.
[6]曾玮,胡全忠.脑血管淀粉样变[J].世界最新医学信息文摘(电子版),2015,15:19-22.
[7]Pezzini A,Del Zotto E,Volonghi I,et al.Cerebral amyloid angiopathy:a common cause of cerebral hemorrhage[J].Curr Med Chem,2009,16:2498-2513.
[8]Passero S,Burgalassi L,D’Andrea P,et al.Recurrence of bleeding in patients with primary intracerebral hemorrhage[J].Stroke,1995,26:1189-1192.
[9]Charidimou A,Gang Q,Werring DJ.Sporadic cerebral amyloid angiopathy revisited:recent insights into pathophysiology and clinical spectrum [J].J Neurol Neurosurg Psychiatry,2012,83:124-137.
[10]CharidimouA,PeetersA,Fox Z,et al.Spectrum of transient focal neurological episodes in cerebral amyloid angiopathy multicentre magnetic resonance imaging cohort study and meta-analysis[J].Stroke,2012,43:2324-2330.
[11]Wardlaw JM,Smith EE,Biessels GJ,et al.Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J].Lancet Neurol,2013,12:822-838.
[12]Chen YW,Gurol ME,Rosand J,et al.Progression of white matter lesions and hemorrhages in cerebral amyloid angiopathy[J].Neurology, 2006,67:83-87.
[13]Gregoire SM,Charidimou A,Gadapa N,et al.Acute ischaemic brain lesions in intracerebral haemorrhage:multicentre cross-sectional magnetic resonance imaging study[J].Brain,2011,134:2376-2386.
[14]Milner E,Zhou ML,Johnson AW,et al.Cerebral Amyloid Angiopathy Increases Susceptibility to Infarction After Focal Cerebral Ischemia in Tg2576 Mice[J].Stroke,2014,45:3064-3069.
[15]Hartz AMS,Bauer B,Soldner ELB,et al.Amyloid-β contributes to blood-brain barrier leakage in transgenic human amyloid precursor protein mice and in humans with cerebral amyloid angiopathy[J].Stroke, 2012,43:514-523.
[16]Menon RS,Kidwell CS.Neuroimaging demonstration of evolving small vessel ischemic injury in cerebral amyloid angiopathy[J].Stroke, 2009,40:e675-e677.
[17]Schrag M,McAuley G,Pomakian J,et al.Correlation of hypointensities in susceptibility-weighted images to tissue histology in dementia patients with cerebral amyloid angiopathy:a postmortem MRI study[J].Acta Neuropathol,2010,119:291-302.
[18]Knudsen KA,Rosand J,Karluk D,et al.Clinical diagnosis of cerebral amyloid angiopathy:validation of the Boston criteria[J].Neurology,2001, 56:537-539.
[19]Vernooij MW,van der Lugt A,Ikram MA,et al.Prevalence and risk factors of cerebral microbleeds The Rotterdam Scan Study[J].Neurology, 2008,70:1208-1214.
[20]Biffi A,Halpin A,Towfighi A,et al.Aspirin and recurrent intracerebral hemorrhage in cerebral amyloid angiopathy[J].Neurology,2010,75:693-698.
[21]Gregoire SM,Jäger HR,Yousry TA,et al.Brain microbleeds as a potential risk factor for antiplatelet-related intracerebral haemorrhage:hospital-based,case-control study[J].J Neurol Neurosurg Psychiatry,2010,81:679-684.
(本文编辑:王晶)
R741;R743
ADOI10.16780/j.cnki.sjssgncj.2016.05.030
1.徐州医学院研究生学院江苏 徐州 221000 2.徐州医学院附属医院神经内科江苏 徐州 221000
2016-01-11
樊红彬fandoc@163.com

