术前射频热疗联合FOLFOX辅助治疗对结肠癌组织中MVD以及凋亡相关分子表达的影响
付全航
术前射频热疗联合FOLFOX辅助治疗对结肠癌组织中MVD以及凋亡相关分子表达的影响
付全航
目的 研究术前射频热疗联合FOLFOX辅助治疗对结肠癌组织中微血管密度(MVD)以及凋亡相关分子表达的影响。方法 将2013年1月至2014年6月的120例结肠癌患者纳入研究,依据辅助治疗不同分为两组,观察组患者术前接受射频热疗联合FOLFOX化疗,对照组仅接受FOLFOX化疗。采用免疫组化染色的方法检测肿瘤组织中的MVD,Real-time PCR和Western blot检测肿瘤组织中凋亡相关分子的表达情况。结果 观察组患者肿瘤组织中MVD低于对照组(P<0.05);观察组患者肿瘤组织中Caspase-3、p16、Bax的mRNA和蛋白含量均高于对照组(均P<0.05);观察组患者肿瘤组织中突变型p53基因以及CDC25A、Bcl-2的mRNA和蛋白含量均低于对照组(均P<0.05)。结论 术前射频热疗联合FOLFOX辅助治疗有助于降低结肠癌组织中的MVD,同时上调促凋亡分子、抑制抗凋亡分子的表达。
结肠癌 射频热疗 微血管密度 细胞凋亡 凋亡调控基因
结肠癌是我国常见的消化道恶性肿瘤,当疾病发展至进展期后,需要在手术前进行辅助化疗。FOLFOX是临床上常用的结肠癌化疗方案,通过铂类药物、亚叶酸钙和5-氟尿嘧啶的联合应用来发挥杀灭肿瘤细胞、缩小肿瘤体积的作用,同时也能使手术治疗时病灶清除更加彻底[1]。但是,近年来的研究发现,术前单独采用FOLFOX进行化疗虽然可以有效地缩小肿瘤体积,却无法清除较小的病灶;术后微小病灶的残留成为了远期复发和转移的病理基础[2]。基于以上情况,学者们致力于探寻能够有效清除微小病灶的治疗方法。射频热疗是通过局部加温来诱导肿瘤细胞凋亡的治疗方法,近年来被广泛应用于实体肿瘤的治疗。本研究中,笔者探讨了术前射频热疗联合FOLFOX辅助治疗对结肠癌组织中微血管密度(MVD)以及凋亡相关分子表达的影响,现将结报道如下。
1 对象和方法
1.1 对象 将2013年1月至2014年6月我院收治的120例结肠癌患者纳入研究,均经结肠镜病理活检确诊,符合结肠癌TNMⅢ期的诊断标准。手术前均进行辅助治疗,根据辅助治疗方法不同分为两组,每组各60例。观察组患者术前接受射频热疗联合FOLFOX化疗,其中男38例,女22例,年龄55~74(65.96±7.69)岁;Ⅲa期患者28例,Ⅲb期患者17例,Ⅲc期患者15例;管状腺癌48例,黏液腺癌10例,印戒细胞癌2例。对照组仅接受FOLFOX化疗,其中男34例,女26例,年龄56~76(66.10±7.86)岁;Ⅲa期患者27例,Ⅲb期患者17例,Ⅲc期患者16例;管状腺癌50例,黏液腺癌9例,印戒细胞癌1例。两组患者一般资料比较均无统计学差异(均P>0.05)。
1.2 方法
1.2.1 治疗方法 两组患者均进行FOLFOX化疗,共治疗2个周期,方法如下:奥沙利铂130mg/m2静脉滴注,第1天;亚叶酸钙200mg/m2静脉滴注,第1~5天;5-氟尿嘧啶300mg/m2静脉滴注,第1~5天。观察组患者在此基础上给予射频热疗,方法如下:采用UHR-2000大功率射频治疗仪对腹部大血管周围进行加热,并实时监测肛温;当肛温达到39℃时开始静脉滴注化疗药物,并保证肛温由39℃升高到41.8℃耗时1~2h;静脉滴注完成后,维持肛温在41.3~41.8℃,持续2h。
1.2.2 样本采集方法 所有患者治疗前均留取结肠镜病理活检标本。手术中再次收集肿瘤组织样本并分为两份,一份立即投入液氮中冷冻,10min后取出并保存于-80℃冰箱,用于下一步检测;另一份投入4%多聚甲醛固定液,固定后用于石蜡包埋。
1.2.3 MVD检测 连续切片后进行CD31免疫组化染色,染色后先在低倍镜(40×)下选取癌组织间质中微血管较为集中的部位,而后转为高倍镜(100×)观察,由2位高年资病理科医师分别对视野内血管数目进行计数,每例标本计数5个视野,最后计算平均值作为MVD。
1.2.4 Real-time PCR检测凋亡相关分子 mRNA表达情况 取肿瘤组织约60mg,采用Trizol法提取总RNA,反转录合成cDNA第一链后保存于-80℃;检测mRNA含量时采用天根生化公司的荧光定量PCR试剂盒分别扩增突变型p53、CDC25A、Bcl-2、Caspase-3、p16、Bax基因,以β-actin为内参照,通过软件读取目的基因和看家基因的起跳循环数(Ct值),按照ΔΔCt法计算目的基因的mRNA含量。设置对照组肿瘤组织中目的基因的mRNA含量为100,计算观察组肿瘤组织中目的基因的mRNA含量。
1.2.5 Western blot检测凋亡相关分子的蛋白表达情况 取肿瘤组织约60mg,加入蛋白裂解液500μl后充分匀浆,于4℃、12 000r/min离心20min,取上清液加入loading buffer,100℃变性后进行下一步检测。按照配方配置4%的浓缩胶和10%的分离胶,点样后加入样本并进行垂直电泳和电转膜;取出硝酸纤维素膜置于5%脱脂牛奶中封闭2h,而后在4℃条件下孵育突变型p53、CDC25A、Bcl-2、Caspase-3、p16、Bax、β-actin第一抗体;第2天取出NC膜并孵育辣根过氧化物酶标记的第二抗体2h,TBST液体洗涤3遍后进行显影。用Image J软件分析蛋白条带灰度值,按照目的基因灰度值与βactin灰度值的比值作为蛋白含量,设置对照组肿瘤组织中目的基因的蛋白含量为100,计算观察组肿瘤组织中目的基因的蛋白含量。
1.3 统计学处理 应用SPSS 18.0统计软件。计量资料采用表示,两组间比较采用t检验。
2 结果
2.1 治疗前后两组患者肿瘤组织MVD比较 治疗前观察组患者肿瘤组织MVD为(45.29±5.03)/HP、对照组为(44.17±4.34)/HP,两组比较无统计学差异(P>0.05)。治疗后观察组患者肿瘤组织MVD为(26.69± 3.95)/HP,与治疗前相比明显下降(t=22.527,P<0.05),也明显低于对照组(t=6.797,P<0.05);治疗后对照组患者肿瘤组织MVD为(42.45±6.14)/HP,与治疗前相比无统计学差异(P>0.05)。
2.2 治疗前后两组患者肿瘤组织中抗凋亡基因及相关蛋白的表达情况 治疗后观察组患者肿瘤组织中突变型p53基因以及CDC25A、Bcl-2基因的mRNA及相关蛋白的含量均低于治疗前,均有统计学差异(均P<0.05)。治疗后对照组患者肿瘤组织中以上基因的mRNA含量及相关蛋白含量与治疗前相比均无统计学差异(均P>0.05)。治疗前观察组患者肿瘤组织中以上基因的mRNA含量及相关蛋白含量与对照组相比均无统计学差异(均P>0.05);治疗后观察组则均低于对照组(均P<0.05),见表1。
2.3 治疗前后两组患者肿瘤组织促凋亡基因及相关蛋白的表达情况 治疗后观察组患者肿瘤组织中Caspase-3、p16、Bax基因的mRNA含量及相关蛋白含量均高于治疗前(均P<0.05)。治疗后对照组患者肿瘤组织中以上基因的mRNA含量及相关蛋白含量与治疗前相比均无统计学差异(均P>0.05)。
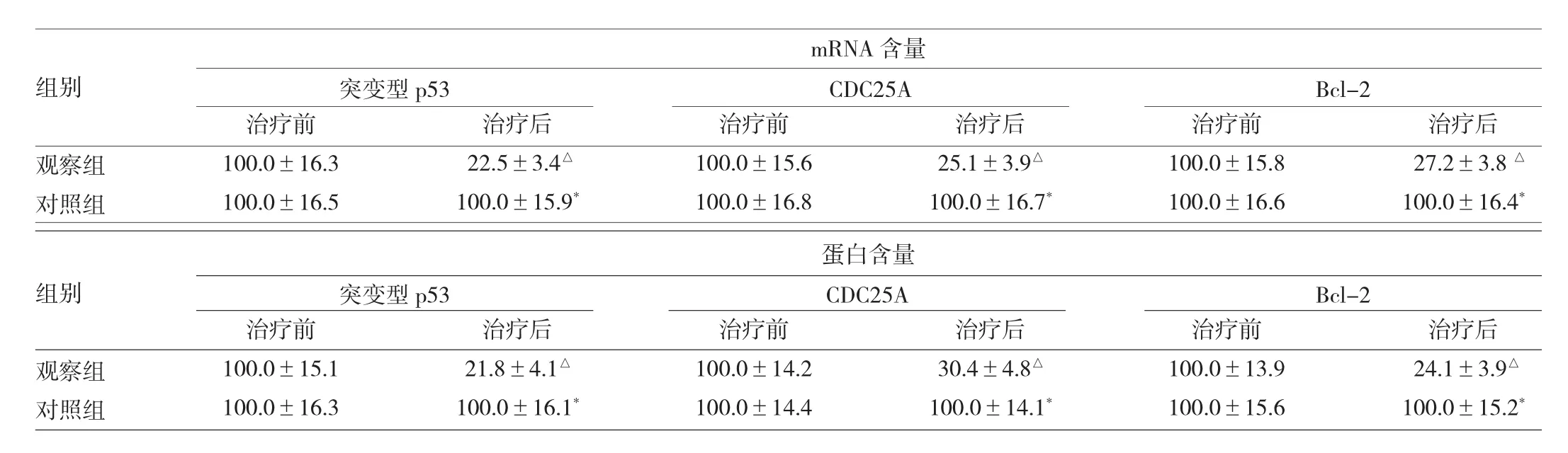
表1 治疗前后两组患者肿瘤组织中抗凋亡基因及相关蛋白的表达情况
治疗前观察组患者肿瘤组织中Caspase-3、p16、Bax基因的mRNA含量及相关蛋白含量与对照组比较均无统计学差异(均P>0.05);治疗后观察组则均高于对照组(均P<0.05),见表2。
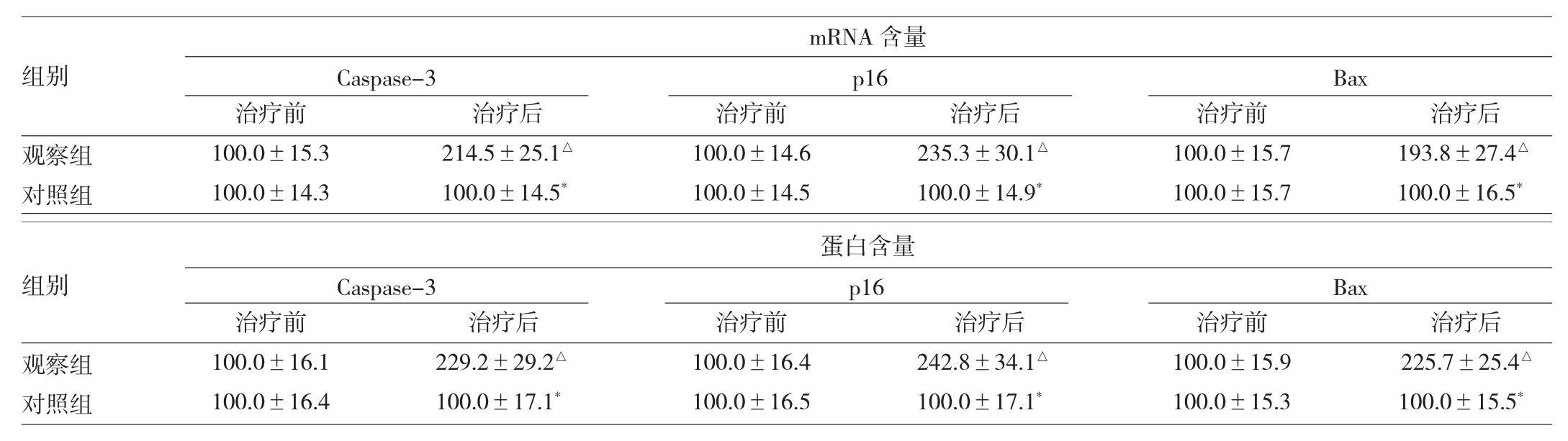
表2 治疗前后两组患者肿瘤组织促凋亡基因及相关蛋白的表达情况
3 讨论
热疗是新近发展起来的大肠癌治疗方式,通过提高局部组织的温度来杀灭肿瘤细胞。与正常组织相比较,肿瘤组织的血管形态和结构均存在差异,且局部温度也存在5~10℃的温差[3];同时,肿瘤组织局部乳酸堆积、pH值较低,对于热能较为敏感。这就使得局部组织加温到40~46℃时,肿瘤细胞能够被杀死,而正常组织和细胞不发生损伤[4]。热疗可以针对不同体积病灶发挥相同的作用,同时杀灭肿瘤组织较大病灶和微小病灶内的肿瘤细胞,最大限度的预防术后复发。国内外学者的研究已经证实,术前射频热疗能够诱导肿瘤细胞的凋亡,但具体分子机制仍未阐明[5-6]。肿瘤局部微血管网极为丰富,可以为细胞的增殖提供充分的养分;而且肿瘤病灶本身可以通过分泌大量细胞因子来直接介导局部新生血管的形成,这也是结肠癌术后复发最重要的原因。本研究对结肠癌患者治疗后的MVD进行了分析,结果显示观察组患者肿瘤组织中MVD低于对照组,这就说明术前射频热疗有助于降低肿瘤组织局部的MVD,进而诱导细胞凋亡。
在血供充足的前提条件下,细胞增殖和凋亡的过程受到一系列基因的调控。野生型p53基因是体内十分重要的凋亡调控基因,可以抑制细胞的增殖过程;在恶性肿瘤的发生过程中,野生型p53基因发生突变并导致抑制细胞增殖能力的丧失,进而造成细胞恶性增殖的发生[7]。现有研究已发现多种恶性肿瘤中p53基因均存在突变,突变型p53基因也被视作抗凋亡基因,该基因表达量越高、肿瘤细胞的恶性增殖能力越强[8]。Bcl-2是一类定位于线粒体和粗面内质网上的凋亡调节基因,受到PI3K/AKT信号通路的调控,通过形成同源二聚体的形式发挥延长细胞生命周期、拮抗凋亡诱导因素的功能[9]。CDC25A是双重特异性磷酸酶家族的成员之一,能够作用于细胞周期蛋白依赖性激酶(CDK)并使之发生去磷酸化,进而促进细胞周期由G1期进入S期[10]。目前研究认为,在结肠癌、乳腺癌、卵巢癌等多种恶性肿瘤中CDC25A呈高表达状态,且与患者的预后情况密切相关[11-12]。本研究通过Real-time PCR和Western blot检测了抗凋亡基因及相关蛋白的表达情况,结果提示治疗后观察组患者肿瘤组织中突变型p53基因以及CDC25A、Bcl-2的mRNA含量及蛋白含量均低于对照组。这就说明术前射频热疗有助于抑制抗凋亡基因的表达,进而诱导细胞凋亡。
除了上述抗凋亡基因外,促凋亡基因同样也对肿瘤细胞的增殖和凋亡发挥了重要的调控作用。p16基因又称为多肿瘤抑制因子(MTS),具有明确的细胞增殖抑制活性,直接参与细胞周期的调控,是近年来发现的一类比p53更加重要的新型抑癌基因[13];当p16基因丢失后,机体调节细胞周期、促进细胞凋亡的能力明显减弱,细胞发生恶性增殖的风险大大增加[14]。Caspase家族是一类蛋白水解酶,包括14种家族成员,直接参与细胞凋亡的过程,细胞凋亡的上游始动作用和下游效应作用均有不同Caspase家族成员的参与[15]。Caspase-3是凋亡过程的下游效应分子,主要通过酶切DNA依赖性蛋白激酶、固醇调控元件结合蛋白等特异性底物来参与细胞凋亡[16]。Bax是与Bcl-2具有极高的同源性的蛋白,功能却截然相反;能够与Bcl-2形成异源二聚体,从而抑制同源二聚体的形成来发挥抗凋亡作用。本研究通过Realtime PCR和Western blot的方法检测了抗凋亡基因的表达情况,结果提示治疗后观察组患者肿瘤组织中Caspase-3、p16、Bax的mRNA含量和蛋白含量均高于对照组。这就说明术前射频热疗有助于上调促凋亡基因的表达,进而诱导细胞凋亡。
综上所述,术前射频热疗联合FOLFOX辅助治疗有助于降低结肠癌组织中的MVD,同时上调促凋亡分子、抑制抗凋亡分子的表达,对于消除结肠癌术后微小病灶,减少患者术后复发及转移有积极的意义。
[1] 韩江琼,陈云兰,秦锴,等.5-氟尿嘧啶联合亚叶酸钙与奥沙利铂化疗方案治疗晚期结直肠癌的临床研究[J].中国临床药理学杂志,2014,30 (8):674-676.
[2] 孔天东,朱眉,高伟艳,等.晚期大肠癌SOX与FOLFOX4方案一线化疗对生存质量影响随机对照研究[J].中华肿瘤防治杂志,2014,21(18): 1445-1450.
[3] 许凤,陈石伟,李勇,等.介入、热疗联合FOLFOX辅助治疗术后Ⅲ期结肠癌患者的疗效分析[J].中国癌症杂志,2011,21(1):52-55.
[4] Devun F,Biau J,Huerre M,et al.Colorectalcancer metastasis:the DNA repair inhibitor Dbait increases sensitivity to hyperthermia and improves efficacy of radiofrequency ablation[J].Radiology, 2014,270(3):736-746.
[5] 吕伽林,刘海鹰,鲁伟群,等.全身热疗联合FOLFOX7方案治疗晚期大肠癌近期疗效观察[J].中华物理医学与康复杂志,2006,28(6):412-414.
[6] Randle R W,Levine E A,Clark C J,et al.Cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for gallbladder cancer:a retrospective review[J].Am Surg,2014,80(7):710-713.
[7] 陈奇,曾照芳.p53基因突变与消化系统恶性肿瘤的关联[J].激光杂志, 2012,33(2):79-80.
[8] 李志,刘卫红,王青,等.抗肿瘤相关抗原Imp1、p62、Koc、p53、c-myc的抗体联合检测对结肠癌诊断的价值[J].中国卫生检验杂志,2012,22 (7):1484-1486.
[9] Yun H J,Hyun S K,Park J H,et al.Widdrolactivates DNAdamage checkpointthrough the signaling Chk2-p53-Cdc25A-p21-MCM4 pathway in HT29 cells[J].MolCellBiochem,2012,363(1-2): 281-289.
[10] Cai W,Chen C,Li X,et al.Association of CDC25 phosphatase family polymorphisms with the efficacy/toxicity of platinumbased chemotherapy in Chinese advanced NSCLC patients[J]. Future Oncol,2014,10(7):1175-1185.
[11] Sengupta S,Jana S,Bhattacharyya A.TGF-β-Smad2 dependent activation of CDC25A plays an important role in cell proliferation through NFATactivation in metastatic breast cancer cells [J].CellSignal,2014,26(2):240-252.
[12] Brunetto E,Ferrara A M,Rampoldi F,et al.CDC25A protein stability represents a previously unrecognized target of HER2 signaling in human breast cancer:implication for a potentialclinical relevance in trastuzumab treatment[J].Neoplasia,2013,15(6): 579-590.
[13] Yoruker E E,Mert U,Bugra D,et al.Promoter and histone methylation and p16(INK4A)gene expression in colon cancer[J].Exp Ther Med,2012,4(5):865-870.
[14] 陆毅.C-myc基因和p16基因在结肠癌中的表达及其临床意义[J].中国老年学杂志,2010,30(11):1602-1603.
[15] Radhakrishnan E K,Bava S V,Narayanan S S,et al.[6]-Gingerol induces caspase-dependent apoptosis and prevents PMA-induced proliferation in colon cancer cells by inhibiting MAPK/AP-1 signaling[J].PLoS One,2014,9(8):e104401.
[16] 董晓彤,黄莹,李巍,等.Caspase-3、Bcl-2的表达在结肠癌诊断中的临床意义[J].世界华人消化杂志,2013,21(30):3281-3285.
Effect of preoperative radio-frequency thermotherapy combined with FOLFOX adjuvant treatment on microvessel density and expression apoptosis-related molecules in colon carcinoma
FU Quanhang.Department of Surgical Oncology,Dongyang People's Hospital, Dongyang 322100,China
【 Abstract】 Objective To investigate the effect of preoperative radio-frequency thermotherapy combined with FOLFOX adjuvant treatment on microvessel density(MVD)and expression of apoptosis-related molecules in colon carcinoma. Methods One hundred and twenty patients with colon cancer treated in our hospital from 2013 January to 2014 June were enrolled and randomly divided into two groups.Patients in study group received preoperative radio-frequency thermotherapy combined with FOLFOX chemotherapy before surgery,those in control group received FOLFOX chemotherapy only.Microvessel density of tumor tissue were assayed by immunohistochemical staining,the mRNA and protein expressions of apoptosis-related molecules in tumor tissue were assayed by Real-time PCR and Western blot respectively. Results MVD in study group was lower than that in control group(P<0.05).The mRNA and protein expressions of pro-apoptotic molecules Caspase-3,p16 and Bax in tumor tissue of study group were higher than those of control group(P<0.05).The mRNA and protein expression of anti-apoptotic molecules p53,CDC25A and Bcl-2 in tumor tissue of study group were lower than those of control group(P<0.05). Conclusion Preoperative radio-frequency thermotherapy combined with FOLFOX adjuvant treatment may reduce microvessel density,up-regulate pro-apoptotic molecules expression,and down-regulate anti-apoptotic molecules expression in colon cancer.
Colon cancerRadio-frequency thermotherapy Microvesseldensity Apoptosis Apoptosis gene
2015-09-18)
(本文编辑:田云鹏)
322100 东阳市人民医院肿瘤外科

