金银花黄酒制备工艺及产品稳定性和抗氧化活性研究
陈丽玲,陈 勍,何冬萍,赵慧茹,倪 莉,刘志彬
(福州大学食品科学技术研究所,福建省食品生物技术创新工程技术研究中心,福建福州350108)
金银花黄酒制备工艺及产品稳定性和抗氧化活性研究
陈丽玲,陈 勍,何冬萍,赵慧茹,倪 莉,刘志彬
(福州大学食品科学技术研究所,福建省食品生物技术创新工程技术研究中心,福建福州350108)
金银花具有显著的抗氧化活性,将其与黄酒结合所生产的金银花黄酒是一个传统的保健饮品。本研究采用黄酒浸提金银花制备具有抗氧化活性的金银花黄酒,并对其生产工艺进行了优化。首先以绿原酸、总酚含量为指标对比了水、13%乙醇、无水乙醇和成品黄酒对金银花的提取效果;然后对比了金银花的样品来源和前处理方式对提取效果的影响;之后对提取料液比和浸提时间进行了优化。实验结果显示,以黄酒为浸提液,以人工种植金银花冻干样品为原料,料液比为1∶30,浸提时间为90min时,可以获得较高的绿原酸和总酚提取效率。以此条件制备金银花黄酒,并对其活性成分的稳定性和抗氧化活性(包括DPPH清除活性、ABTS清除活性、羟自由基清除活性及总还原力)进行探究,结果表明,金银花黄酒在放置28 d后,绿原酸含量和抗氧化性有所下降,但仍维持较高的抗氧化水平,其中DPPH清除率为59.27%、ABTS清除率为54.62%、羟自由基清除率为71.25%、总还原力约为0.0108mg/m LVc。
金银花黄酒; 绿原酸; 总酚; 抗氧化性
金银花,又名银花、忍冬、双花、金银藤等,是我国大宗常用中药材,在我国多地均有种植,是国务院确定的70种传统名贵中药材之一,且是卫生部确定的药食兼用的品种之一,广泛应用于医药、饮料、化妆品、香料等行业领域[1-3]。传统中医认为金银花有清热解毒、保肝利胆等功效[4-5]。现代营养学研究也表明,金银花中由于含有丰富的绿原酸、木犀草苷等多酚成分,具有显著的抗氧化、抗病毒、消炎等多种活性[6-7]。此外,金银花中还含有挥发油、三萜皂甙等组分,为金银花提供了丰富的风味来源[8-9]。
中国的黄酒,也称为米酒(ricew ine),是我国历史最悠久的传统酿造酒。黄酒不仅营养丰富,还具有抗氧化、抗衰老、降血压、降胆固醇、参与机体代谢和免疫调节等多种生理功效[10]。将性寒的金银花添加到黄酒中生产金银花黄酒,不但能提高黄酒的风味,而且能适当中和温热性的黄酒,从而达到更好的保健功效。金银花黄酒在民间有广泛的饮用基础,但相关的工艺研究较少,孔瑾等[11]在黄酒中添加金银花水提取液生产金银花黄酒;华萍等[12]用食用酒精提取金银花制备金银花液,然后再添加到黄酒中。金银花中部分多酚类是水不溶性成分,因此金银花水提液可能无法完全萃取其有效成分;而使用食用酒精提取不但提高了生产成本,而且对最终产品品质有所影响。本研究采用黄酒成品直接浸泡萃取金银花的方式获得金银花黄酒,以保障产品的品质。本研究对比了不同浸提液以及金银花样品来源和前处理方式对金银花有效成分的提取效果,优化了提取工艺,并研究了产品的稳定性以及抗氧化活性。所开发的金银花黄酒具有一定的应用潜力。
1 材料与方法
1.1 材料与试剂
1.1.1 金银花样品
实验选用的金银花样品由长珠新兴农业科技开发有限公司提供,包括人工种植金银花烘干样品(S1)、人工种植金银花冻干样品(S2)、人工种植金银花枝叶样品(S3)和野生金银花烘干样品(S4)。样品经中草药粉碎机粉碎后过200目筛密封备用。
1.1.2 黄酒样品
实验选用宁德市蕉城区石堂酒业有限公司生产的半甜型陈普家酒。
1.1.3 化学试剂
绿原酸标准品(优级纯),成都曼彻斯特公司;DPPH(优级纯)、ABTS(优级纯),汕头市西陇化工厂。磷酸氢二钾、磷酸二氢钾、铁氰化钾、三氯乙酸、三氯化铁、碳酸钠、硫酸亚铁、水杨酸、福林酚、没食子酸、过氧化氢、无水乙醇等均为优级纯试剂。
1.2 仪器与设备
紫外分光光度计(UV-1100型,上海美谱达仪器有限公司);电子天平(BS124S,德国赛多利斯公司);冷冻高速离心机(CF16RXII,HITACHI);高速中药粉碎机(HX-100型,浙江省永康市溪岸五金药具厂);旋涡混合器(XW-80A,上海精科实业有限公司);电热恒温鼓风干燥器(DHG-9076A型,上海一恒科学仪器有限公司);高效液相色谱(L2000,日本日立公司)。
1.3 实验方法
1.3.1 金银花有效成分的浸提工艺
取1 g金银花粉末样品,添加一定量提取液充分混匀,并置于暗处静止浸提一段时间,纱布过滤后,滤液用离心机以10000 r/m in速度离心5min,取上清液即为金银花浸提液。
1.3.2 金银花中总酚和绿原酸含量的测定
将上清液用70%的乙醇稀释50倍,用福林酚法测定多酚含量。吸取稀释后的样品2m L,加入2m L福林酚试剂,摇匀,反应5m in后加入2m L 7%碳酸钠溶液,室温下放置35m in后测定吸光值,以70%乙醇代替上清液作为空白对照[13]。以没食子酸作为标准品,作标准曲线来进行定量。
采用高效液相色谱(HPLC)测定绿原酸含量。方法:采用C18色谱柱(4.6mm×150mm),乙腈与0.4%磷酸为流动相,体积比为17∶83,流速为1.0 m L/min,柱温25℃,检测波长327mm[14]。
1.3.3 提取液类型的选择
分别以水、13%乙醇、无水乙醇和成品酒提取S2粉末样品,按1.3.1工艺制备金银花浸提液(料液比为1∶30,浸提时间为90m in),测定总酚和绿原酸含量。
1.3.4 样品来源和前处理方式的对比
依据1.3.3实验结果,选择最佳提取液,以1∶30,浸提90m in的方式对人工种植金银花烘干样品(S1)、人工种植金银花冻干样品(S2)、人工种植金银花枝叶样品(S3)和野生金银花烘干样品(S4)4种金银花样品进行浸提,并以总酚和绿原酸含量为指标确定最佳金银花前处理方式和样品来源。
1.3.5 浸提料液比的优化
取S2粉末样品,以黄酒为提取液,料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40、1∶60,避光提取90m in,测定提取液总酚和绿原酸含量,确定最优的料液比。
1.3.6 浸提时间的优化
取S2粉末样品,以黄酒为提取液,在1∶30料液比下,避光提取10m in、30m in、60m in、90min、120min、180m in、12 h、24 h和48 h,测定提取液绿原酸含量,确定金银花黄酒的最佳浸提时间。
1.3.7 产品总酚和绿原酸的稳定性研究
取S2粉末样品,以黄酒为提取液,料液比1∶30,避光浸提90m in后,按1.3.1工艺制备金银花黄酒,高温杀菌然后室温下密封保存28 d,并分别于0m in、30m in、90m in、12 h、24 h、48 h、72 h、96 h、7 d、14 d、21 d、28 d时测定总酚和绿原酸含量,观察金银花有效成分的稳定性。
1.3.8 产品抗氧化活性的测定
取S2粉末样品,以黄酒为提取液,料液比1∶30,避光浸提90m in后,按1.3.1工艺制备金银花黄酒,高温杀菌然后室温下密封保存0m in、72 h和28 d后测定其抗氧化活性。参照Wu等[15]的方法测定金银花黄酒的DPPH自由基清除率;参照Wang等[16]的方法测定金银花黄酒的ABTS自由基清除率;参照GüLCIN等[17]的方法测定金银花黄酒的还原力;参照Zhang等[18]的方法测定金银花黄酒的羟自由基清除率。
2 结果与分析
2.1 提取液类型的选择
采用水、13%乙醇、无水乙醇和黄酒(酒精度约为13%vol)分别浸提获得金银花提取液,测定其绿原酸和总酚含量,结果见图1和图2。

图1 金银花浸提液绿原酸含量

图2 金银花浸提液总酚含量
由图1和图2可知,水、13%乙醇、无水乙醇和成品酒4种提取液对S2金银花粉末进行浸提,浸提效果差异显著。其中,用黄酒浸提获得的浸提液绿原酸和总酚含量最高,分别为1.350mg/m L和1.481mg/m L,用无水乙醇浸提绿原酸和总酚含量最低,分别为0.671mg/m L和0.871mg/m L。绿原酸易溶于乙醇,采用13%乙醇和黄酒可获得比水更高的提取效率。但由于绿原酸是胞内酸,高浓度乙醇能使得细胞膜凝固,从而抑制了绿原酸的扩散,使绿原酸的浸提效率降低。虽然黄酒和13%乙醇的乙醇浓度相似,但由于黄酒中存在的氨基酸多肽等成分可能会对绿原酸有一定的保护作用,从而获得更高的提取效率。
2.2 样品来源和前处理方式的对比
对人工种植金银花烘干样品(S1)、人工种植金银花冻干样品(S2)、人工种植金银花枝叶样品(S3)和野生金银花烘干样品(S4)4种金银花样品以1∶30料液比,用黄酒浸提90min,测定其绿原酸及总酚含量,结果见图3和图4。

图3 金银花不同品种及部位绿原酸含量

图4 金银花不同品种及部位总酚含量
由图3和图4可以看出,野生金银花绿原酸和总酚含量显著高于人工种植品种。而人工种植品种中,花部位(S1和S2)的绿原酸和总酚含量高于枝叶,可见金银花的主要活性成分集中在花中。由于绿原酸和部分多酚的热稳定性不佳,高温烘干的过程可能破坏部分绿原酸和多酚成分,因此烘干样品(S1)的绿原酸和总酚略低于冻干样品(S2)。虽然野生金银花具有较高的活性成分,但野生的金银花量少且花朵小,而人工栽培的金银花花朵大且量多,产量高,同时考虑到价格的因素,野生金银花不适合用于工业生产。因此本研究选取人工种植金银花冻干样品(S2)作为后续研究的样品。
2.3 浸提料液比的优化
取S2粉末样品,以黄酒为提取液,料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40、1∶60,避光浸提90min,测定提取液总酚和绿原酸含量,结果见图5和图6。
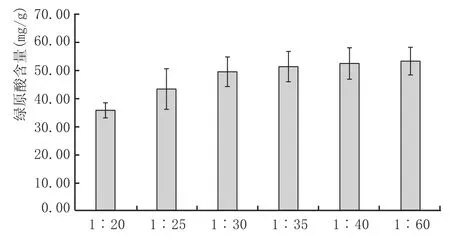
图5 不同料液比浸提液的绿原酸含量

图6 不同料液比浸提液的总酚含量
由图5和图6可知,料液比在高于1∶30以后,黄酒浸提金银花得到绿原酸和总酚的含量基本不再上升。基于成本的考虑,以1∶30为料液比作为最佳的浸提料液比。
2.4 浸提时间的优化
取S2粉末样品,以黄酒为提取液,在1∶30料液比下,避光浸提10 m in、30 m in、60m in、90 m in、120 m in、180min、12 h、24 h和48 h,测定提取液绿原酸含量,结果见图7。

图7 不同浸提时间绿原酸含量
由图7可知,当浸提时间为90m in时,绿原酸的浓度最高,达到1.35mg/m L。浸提90m in之后,提取液的绿原酸含量没有显著上升,甚至在提取12 h后有显著的下降。这可能是由于绿原酸稳定性较差,易分解和氧化,因此延长浸提时间促进了绿原酸的分解、氧化,不利于获得高品质的金银花黄酒产品。因而,本实验选取的最佳浸提时间为90m in。
2.5 金银花黄酒的稳定性
取S2粉末样品,以黄酒为提取液,按照上述最优化浸提工艺制备金银花黄酒,随后,滤去金银花粉末,对产品进行高温杀菌后,密封贮存于室温环境28 d,并分别于0min、30min、90m in、12 h、24 h、48 h、72 h、96 h、7 d、14 d、21 d、28 d时测定产品的总酚和绿原酸含量,结果见图8和图9。

图8 金银花黄酒中总酚的稳定性

图9 金银花黄酒中绿原酸的稳定性
由图8、图9可知,产品的有效成分在贮存28 d的过程中,整体呈下降趋势。在前48 h能保持较高的绿原酸和总酚含量,但在72 h之后,绿原酸和总酚含量显著下降,并趋于稳定,产品最终稳定时,总酚和绿原酸含量分别为0.562mg/m L和0.334mg/m L。
2.6 金银花黄酒的抗氧化指标检测
取S2粉末样品,以黄酒为提取液,按照上述最优化浸提工艺制备金银花黄酒,随后,滤去金银花粉末,对产品进行高温杀菌后,密封贮存于室温环境28 d。分别于0m in、72 h与28 d时对金银花黄酒进行取样,测定产品的DPPH自由基清除率、ABTS自由基清除率、羟自由基清除率和总还原力,结果见图10—图13。
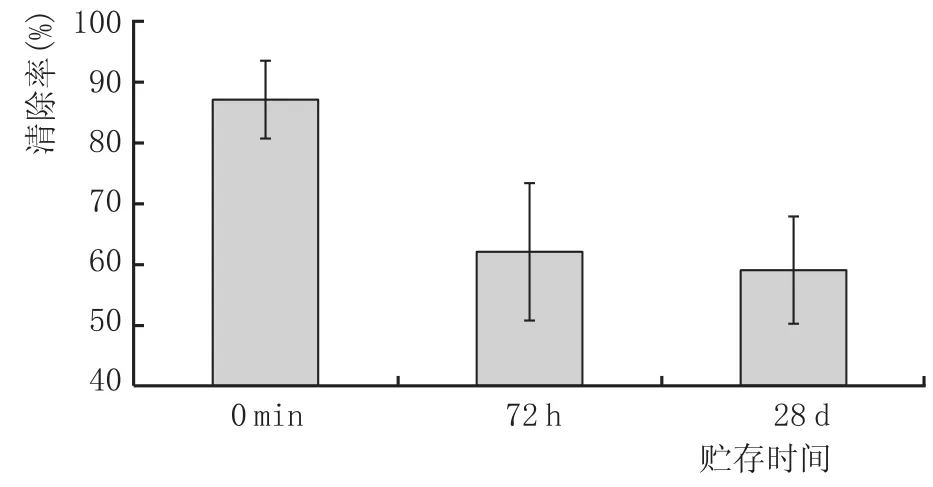
图10 DPPH自由基清除率
由图10—图13可知,在起始阶段(0min)样品对DPPH、ABTS、羟自由基3种自由基的清除率都在90%左右,总还原力相当于0.0248mg/m LVc。贮存过程中,产品的抗氧化活性整体有下降趋势,贮存至28 d后,产品的DPPH和ABTS自由基清除率约为55%,羟自由基清除率为71.2%,总还原力相当于0.0108mg/m LVc。产品抗氧化活性的变化基本符合金银花有效成分的变化趋势。

图11 ABTS自由基清除率

图12 羟自由基清除率

图13 总还原力
3 结论
本研究优化了金银花黄酒的制备工艺,分析了金银花黄酒产品在贮存过程中有效成分的稳定性和产品的抗氧化活性的变化,获得结论如下:
对样品选择的结果表明,野生金银花的绿原酸和总酚含量是最高的,但是考虑生产成本问题,故研究采用人工栽培金银花冻干品(S2)作为样品。经优化后确定的最佳浸提工艺为:使用黄酒作为浸提液,以1∶30为料液比,浸提时间90min,在此工艺条件下生产的金银花黄酒产品具有最高的总酚及绿原酸含量。
由于以绿原酸为代表的多酚类成分不稳定,在28 d的密封贮存过程中,金银花黄酒产品的主要有效成分在前3 d有较为明显的下降,在28 d后趋于稳定,绿原酸和总酚的最终含量达到0.334mg/m L和0.562mg/m L。产品的抗氧化活性有类似变化趋势,在贮存的第3天抗氧化活性有明显下降,28 d后趋于稳定。因此,为了获得更为稳定,抗氧化活性更强的产品,需进一步研究产品的保藏工艺条件,如预先添加Vc、调节pH值等。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第72卷[M].北京:科学技术出版社,1988:143.
[2] 孟明利,宫璀璀,郑玉霞,等.金银花抗氧化作用的分子学机理研究[J].实用医药杂志,2008,12(9):1104-1106.
[3] 张雁冰,寇娴,王桂红,等.密县金银花及其茎叶中绿原酸含量测定[J].河南医科大学学报,1996,34(2):36-37.
[4] 达超超,单磊,呼延晓颖,等.金银花中绿原酸提取工艺的研究[J].江西饲料,2010(6):7-10.
[5] 张鞍灵,马琼,高锦明,等.绿原酸及其类似物与生物活性[J].中草药,2001,32(2):173-176.
[6] 胡佳钦,向福,石长萍,等.金银花中绿原酸的双水相萃取及抗氧化能力研究[J].中国酿造,2015,34(12):286.
[7] 赵国玲,刘佳佳,林丹,等.金银花化学成分及药理研究进展[J].中成药,2002,24(12):973-976.
[8] 和顺琴,胡秋芬,杨光宇.忍冬科植物金银花的研究现状[J].云南化工,20l0,37(3):72-76.
[9]狄留庆,蔡宝昌,李东伟,等.金银花挥发性成分的GC-MS分析[J].中药材,2003(7):491-492.
[10] 叶杰,陈躬瑞,倪莉.福建黄酒抗氧化活性的研究[J].中国食品学报,2006(1):345-350.
[11] 孔瑾,叶孟韬.金银花、黄酒保健饮料的开发与研究[J].河南职技师院学报,2000,28(4):33-36.
[12] 华萍,赵丽霞.金银花黄酒的生产工艺研究[J].江西食品工业, 2009(3):35-36.
[13] 于丽丽,陈丹.芙蓉李总多酚的提取工艺研究[C]//2009全国中药创新与研究论坛学术论文集.运城:2009全国中药创新与研究论坛,2009.
[14] 刘欣,陈玉保.山银花绿原酸提取方法的比较[J].化学与生物工程,2015(4):41672-5425.
[15]Wu H C,Chen HM,Shiau CY.Free am ino acidsand peptidesas related to antioxidantproperties in protein hydrolysatesofmackerel(Scomberaustriasicus)[J].Food Research International,2003,36(9):949-957.
[16] Wang B,LiZR,ChiC F,etal.Preparation and evaluation of antioxidantpeptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J].Peptides,2012,36(2):240-250.
[17] Gülcin I,AliciHA,CesurM.Determination of in vitro antioxidantand radicalscavenging activitiesof propofol[J]. Chemical&pharmaceuticalbulletin,2005,53(3):281-285.
[18] Zhang Y,Duan X,Zhuang Y.Purification and characterization of novelantioxidantpeptides from enzymatic hydrolysatesof tilapia(Oreochromisniloticus)skin gelatin[J].Peptides,2012, 38(1):13-21.
Production of Honeysuck le Yellow RiceW ineand Study on Its Stability and Anti-Oxidation Properties
CHEN Liling,CHEN Qing,HEDongping,ZHAO Huiru,NILiand LIU Zhibin
(Fujian Research Centerof Food Biotechnology Innovation Engineering,Institute of Food Science and Technology,Fuzhou University,Fuzhou,Fujian 350108,China)
Honeysuckle has significantanti-oxidation properties and it could be used for the production of yellow ricew ine.In this study,the production of honeysuckle yellow ricew inewas explored and the stability and anti-oxidation properties of the produced w inewere investigated.Firstly,w ith chlorogenic acid and total phenol contentas the indexes,the extracting effects of honeysuckle by four kinds of solvent includingwater,13%ethanol,absoluate ethanol,and productyellow ricew inewere compared.Then the effectsof sample source and pretreatmenton the extraction of honeysucklewere compared.Finally,solid-liquid ratio and the extracting timewere optimized.The experimental results suggested that,the bestextracting effects could be achieved w ith yellow ricew ine used as the extracting solvent,freeze dried honeysuckle used as raw material,solid-liquid ratio at1∶30,and extracting time of 90min.After28 d placementof the produced w ine,chlorogenic acid contentand the anti-oxidation properties of thew ine reduced,however,high anti-oxidation properties still remained w ith DPPH,ABTSand hydroxyl radicalscavenging ratio of 59.27%,54.62%and 71.25%respectively,and the total reducing capacity was0.0108mg/m LVc.
honeysuckle yellow ricew ine;chlorogenic acid;totalphenol;anti-oxidation properties
TS262.4;TS261.4
A
1001-9286(2016)12-0047-05
10.13746/j.njkj.2016175
国家自然科学基金(31371820)。
2016-05-24
陈丽玲(1991-),女,硕士研究生,主要研究方向为食品科学。
刘志彬,男,助理研究员,E-mail:liuzhibin@fzu.edu.cn。
优先数字出版时间:2016-11-04;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20161104.1436.008.htm l。

