不同工艺对麸曲中酸性蛋白酶活性的影响
程 伟,卓毓崇,杨 柳,王 西,甘浪飞,陈梦园,罗爱民
(1.四川郎酒集团有限责任公司,四川古蔺646523; 2.四川大学轻纺与食品学院,四川成都610065)
不同工艺对麸曲中酸性蛋白酶活性的影响
程 伟1,卓毓崇1,杨 柳1,王 西1,甘浪飞1,陈梦园2,罗爱民2
(1.四川郎酒集团有限责任公司,四川古蔺646523; 2.四川大学轻纺与食品学院,四川成都610065)
以1株蛋白酶活性较高的菌株为种子培养液,通过改变麸曲培养基配比、培养时间和培养前接种量3个因素,研究不同工艺对麸曲中酸性蛋白酶活性的影响。结果表明,选择麸皮80%、谷壳20%的配比制作麸皮培养基,培养时间为55 h,菌液接种量为1%的条件,麸曲中酸性蛋白酶活性可以达到最大值。
麸曲; 工艺; 酸性蛋白酶; 活性
白酒在我国已有几千年的历史[1],它主要以香味独特、酒体醇厚、幽雅细腻、空杯留香等特点而深受消费者喜爱[2-3]。庄名扬的研究发现白酒的独特性质与其特定的生产工艺有关[4]。沈玉洁等[5]从大曲中分离筛选出具有较高活性的酸性蛋白酶,在大曲制作的传统工艺基础之上,引入一定量的酸性蛋白酶制成麸曲来提升酒质贵州省轻工业科学研究所生产的麸曲在提高酒的质量上有明显的作用[4]。应用纯种微生物制成麸曲应用到白酒的生产中,是以后科研工作的努力方向[6]。周恒刚发现在白酒多次发酵过程中,随着酒醅中残留蛋白质越来越少,酒味越来越寡淡,提出白酒中许多香味成分来自蛋白质和蛋白酶[7]。但这并不是说蛋白质含量越高,蛋白酶活力越高,白酒中香味成分就越高,酒质就越好。在白酒的生产过程中,酒糟通过堆积后,经过微生物的发酵呈偏酸性,在酵池中发挥作用的主要是酸性蛋白[8]。在白酒生产过程中,高级醇也主要来源于酸性蛋白酶分解蛋白质所生成,酸性蛋白酶与白酒中香味物质的形成有着密切的关系,因此适当提高麸曲中酸性蛋白酶活力以使其能在发酵过程中更好地发挥作用就显得非常重要[9]。
影响麸曲中酸性蛋白酶活性的因素的研究报道较为少见。本实验以高温大曲中筛选出的1株产蛋白酶活力较高的细菌作为种子菌,通过研究不同制作工艺对麸曲中酸性蛋白酶的影响,并优化培养条件,以期得到麸曲中酸性蛋白酶活力较高时的制作工艺,为后续麸曲的研究提供理论参考。
1 材料与方法
1.1 材料、试剂及仪器
材料:菌株DQ-34,Bacillus subtilis,保存于四川大学轻纺与食品学院食品科学与工程新技术研究室;谷壳、麸皮和小麦粉(由酒厂提供)。
试剂:福林试剂、0.4mol/L碳酸钠溶液、0.4mol/L三氯醋酸溶液、10 g/L酪蛋白溶液、pH3.0乳酸-乳酸钠缓冲液。
仪器:G2-250-HIS型恒温恒湿培养箱,韶关市广智科技设备有限公司;WH-2型微型漩涡混合仪,上海沪西分析仪器厂有限公司:SW-CJ-2F型洁净工作台,苏州安泰空气技术有限公司;立式透明门冷藏柜、手提式不锈钢压力蒸汽灭菌器、721型分光光度计等。
1.2 培养基
牛肉膏蛋白胨培养基(g/L):牛肉膏5,蛋白胨10,氯化钠5,琼脂20,pH7.0~7.2,121℃灭菌30m in,备用。
LB液体培养基(g/L):蛋白胨10,酵母膏5,氯化钠10,pH7.0,121℃灭菌20m in,备用。
1.3 实验方法
1.3.1 接种前培养液细菌密度的确定
取DQ-34斜面菌种1支,以无菌操作方式挑取并在牛肉膏蛋白胨培养基上划平板,37℃条件下倒置培养24 h。培养完成后选择单菌落,无菌环境下挑取1环于40m L的LB培养液内,37℃条件下160 r/m in摇床培养,每隔1 h取出1次,无菌条件下摇匀测培养液在600 nm条件下的OD值,并取出1m L培养液,梯度稀释后取其中3个梯度的稀释液进行平板涂布,37℃条件下倒置培养24 h后计数。
1.3.2 酸性蛋白酶酶活性测定
酸性蛋白酶活力测定采用福林酚法[10],酸性蛋白酶活力单位定义:1 g酶粉在40℃、pH3.0条件下,1m in水解酪蛋白产生1μg酪氨酸,即为1个酸性蛋白酶活力单位,以U/g表示。
1.3.3 麸曲培养基配比对酸性蛋白酶活力影响
清蒸后的谷壳添加量为20%,分别混合80%的麸皮、60%的麸皮配20%的小麦粉、40%的麸皮配40%的小麦粉、20%的麸皮配60%的小麦粉、80%的小麦粉制作麸皮培养基,原料混匀后加60%~65%的水充分拌和。常压条件下蒸1 h,冷却后分装进1 L的三角瓶后用双层纱布封口,于121℃、0.1MPa条件下灭菌30m in。将灭菌完成的麸皮培养基在无菌操作台中冷却,备用。向各培养基接种体积质量分数为3%(v∶m=3m L∶100 g)的种子培养液,摇匀后以37℃培养72 h,培养结束后取出,40℃烘干24 h,粉碎测酸性蛋白酶活力[11],每个配比组合做3个平行样。
1.3.4 麸曲培养时间对酸性蛋白酶活力影响
在灭菌冷却后的麸皮培养基(20%谷壳、80%麸皮)中接种体积质量分数为3%的种子培养液,摇匀后于37℃条件下分别培养45 h、50 h、55 h、60 h、65 h和70 h,培养结束后取出,40℃烘干24 h,粉碎测酸性蛋白酶活力,每种培养时间做3个平行样。
1.3.5 麸曲培养前接种量对酸性蛋白酶活力影响
在灭菌冷却后的麸皮培养基(20%谷壳、80%麸皮)中分别接种体积质量分数为1%、2%、3%、4%、5%的种子培养液,充分摇匀后在37℃条件下培养55 h,培养结束后取出,40℃烘干24 h,粉碎测酸性蛋白酶活力,每种接种量做3个平行样。
2 结果与分析
2.1 菌株DQ-34液体培养生长动态
培养时间从1~3 h细菌数量缓慢增长,OD值变化小(从0.026到0.040)。培养时间从3 h到6 h细菌数量增长迅速,OD值由0.040增加到0.420。之后随着培养时间的继续延长,细菌数量增长速度逐渐放缓,当培养时间为9 h时,培养液中细菌总数的对数值达到8.821,OD值达到1.060。
由图1可知,为了保证每次接种到麸皮培养基中的细菌的数量和生长状态一致,选取对数期接近稳定期的细菌作为种子细菌,当LB液体培养基600 nm条件下OD值为0.700左右时,停止培养并进行麸皮培养基接种。

图1 细菌DQ-34生长曲线
2.2 麸皮培养基配比对产酸性蛋白酶的影响
用不同配比的麸皮和小麦粉制成的培养基培菌完成后测其酸性蛋白酶活力值,其结果见图2。图2表明,随着培养基中麸皮含量的降低,酸性蛋白酶活力值呈现先降低后升高再降低的变化规律。

图2 麸皮培养基配比对DQ-34产酸性蛋白酶的影响
酸性蛋白酶活力在麸皮含量80%时其酸性蛋白酶活力最高(19.003U/g),而在麸皮和小麦粉含量各为40%时最低(9.304 U/g),之后随着麸皮含量的增加逐渐增大,但是仍低于麸皮含量较高时的值。麸皮含量高时培养基较蓬松,DQ-34是好氧性细菌,在氧气较充足的条件下能更好地生长,相应产生的蛋白酶也较多,所以麸皮含量从80%降到60%、40%时,酸性蛋白酶活力也迅速下降达到16.250U/g、9.304U/g。麸皮含量降到20%时,蛋白酶活力不降反升,为12.767U/g,当麸皮含量为0%时,蛋白酶活力稍有下降,为12.331U/g,这与小麦粉中蛋白质含量比麸皮中的高,培养前期培养基较蓬松时积累了一定的蛋白酶有关。随着培养时间的延长,培养过程中产生的水吸附在培养基质上不易排出,细菌生长速度减缓,培养结束后其酸性蛋白酶活力较低。
2.3 麸曲培养时间对产酸性蛋白酶的影响
培养时间的长短对微生物的生长速度和代谢能力有着重要的影响[12]。由图3可知,在所选的6个时间点中,培养时间为45 h时,酸性蛋白酶活力最低,只有17.214U/g,培养时间为50 h时,酸性蛋白酶活力为19.204 U/g。55 h时酶活力达到最大值30.101 U/g,之后延长培养时间到60 h、65 h时,酶活力逐渐下降到24.639U/g、22.681U/g。当培养时间为70 h时,酸性蛋白酶活力值已经降到19.679U/g。随着培养时间的延长,酸性蛋白酶活力在开始的55 h内呈逐渐上升趋势,说明此时的菌体数在不断增长,达到顶点后随时间的推移逐渐下降,说明在底物不断消耗的同时,菌体生长也进入衰亡期,导致产酶及酶活性也逐渐下降。

图3 麸曲培养时间对DQ-34产酸性蛋白酶的影响
2.4 麸曲接种量对产酸性蛋白酶的影响
不同接种量的麸曲培养完成后酸性蛋白酶活力值变化情况见图4,由图4可知,当接种量从1%增加至5%的过程中,酸性蛋白酶活力从97.145 U/g开始一直下降,分别为81.393U/g、30.101U/g、24.270U/g、5.706U/g。
酸性蛋白酶活力与接种量呈负相关,这可能是因为随着接种量的增加,进入麸皮培养基的初始细菌数量增加,培养基的消耗速度加快,这些处于对数期的种子细菌更快地结束了调整期,通过了对数期进入了稳定期并接着走向衰亡期,而酸性蛋白酶主要产生于对数期,所以对数期时间持续长的麸皮培养基培养完成后酸性蛋白酶活力就高。从这一方面来看,适当减少接种量有助于延长种子细菌在麸皮培养基中对数期持续的时间,增加酸性蛋白酶活力。
3 结论
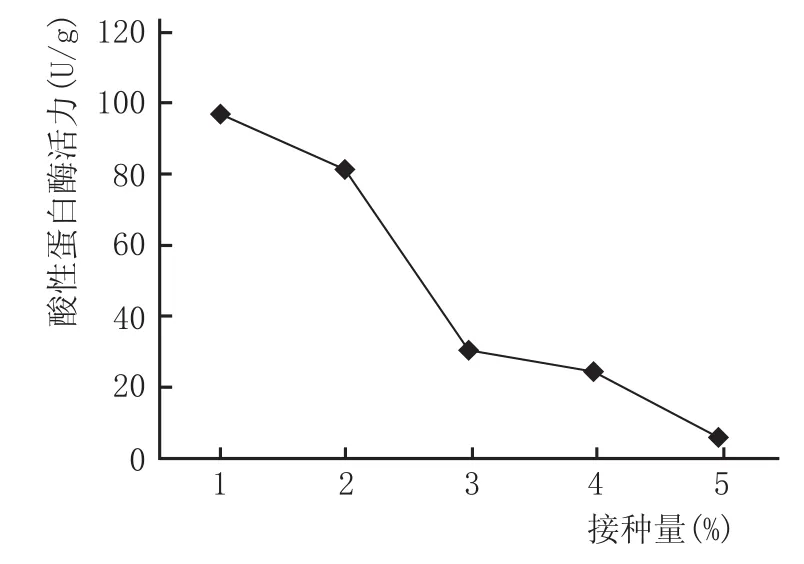
图4 麸曲接种量对DQ-34产酸性蛋白酶的影响
本研究探讨了麸曲中产蛋白酶菌中的酸性蛋白酶活性与不同制作工艺的关系,得到了麸曲中酸性蛋白酶活力最大时的制作工艺。麸曲培养基的配比对酸性蛋白酶的影响与王秋辰[13]等在固态发酵中酸性蛋白酶条件优化中结果一致。随着培养基中麸皮用量的降低,酸性蛋白酶活力值呈现先降低后升高再降低的变化规律。随麸曲培养时间的延长,酸性蛋白酶活力在开始的55 h内呈逐渐上升趋势,达到顶点后随时间的推移逐渐下降。随着麸曲接种量的增加,酸性蛋白酶活力呈下降趋势。最终确定麸曲在麸皮80%、谷壳20%的配比制作麸皮培养基,并在培养时间为55 h,菌液接种量为1%的条件下时酸性蛋白酶的活性最大。
[1] 熊子书.中国三大香型白酒的研究(二)酱香.茅台篇[J].酿酒科技,2005(4):25-30.
[2] 范文来,徐岩.酱香型白酒中呈酱香物质研究的回顾与展望[J].酿酒,2012,39(3):8-16.
[3] Zhang R,Wu Q,Xu Y.Aroma characteristicsofMoutaiflavour liquor produced w ith Bacillus licheniformis by solid-state fermentation[J].Journalof Applied M icrobiology, 2013,57:11-18.
[4] 庄名扬.中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵,2007(2):1-6.
[5] 沈玉洁,张明春,向苇.高产酸性蛋白酶菌株的筛选及发酵条件研究[J].食品与发酵科技,2010,46(6):23-26.
[6] 钟方达.酱香型白酒生产现状分析及思考[J].酿酒科技,2009 (11):123-127.
[7] 马荣山,于影.麸曲酱香型白酒的酿制研究[J].中国酿造, 2010,214(1):138-140.
[8] 周恒刚.白酒生产与酸性蛋白酶[J].酿酒,1991(6):5-8.
[9] 周恒刚.高温大曲酸性蛋自酶高的原因何在[J].酿酒科技, 1996(3):14-17.
[10]李兰.酸性蛋白酶在生料酿酒中的应用研究[J].四川食品与发酵,2002(3):23-26.
[11]张树政.酶制剂工业[M].北京:科学出版社,1984:446-447.
[12]何诚,任道群.浓香型白酒人工窖泥培养过程中微生物变化研究[J].酿酒科技,2011(1):16-18.
[12]王秋辰.红曲霉固态发酵产糖化酶及酸性蛋白酶条件的优化[J].酿酒科技,2014(8):45-48
Influenceof Different Techniqueson Acid Protease Activity in Fuqu
CHENGWei1,ZHUOYuchong1,YANG Liu1,WANG Xi1,GAN Langfei1,CHENMengyuan2and LUOAimin2
(1.Sichuan Langjiu Group Co.Ltd.,Gulin,Sichuan 646523;2.College of Light Industry, Textileand Food Engineering,Sichuan University,Chengdu,Sichuan 610065,China)
Using a strain w ith high protease activity as the seed,we investigated the influence of different techniques on acid protease activity in Fuqu by changing the culture composition,the culture time and the inoculation quantity.The results showed that,the highestacid protease activity was achieved when the culture consisted of 80%bran and 20%husk,culture timewas 55 h,and inoculation quantity was 1%.(Trans. by HUANG Xiaoli)
Fuqu;technique;acid protease;activity
TS262.3;TS261.4
A
1001-9286(2016)12-0040-03
10.13746/j.njkj.2016349
四川省科技成果转化专项资金项目(2014SC0013)。
2016-11-24
程伟(1973-),男,本科,白酒国家评委,郎酒集团公司高级工程师,主要从事白酒尝评、勾调和酿酒生产科研工作。
罗爱民(1971-),男,四川大学副教授,博士,主要从事酿酒生产科研工作。
优先数字出版时间:2016-12-02;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20161202.1631.007.htm l。

