恶性卵巢甲状腺肿合并甲状腺功能异常一例报道并文献复习
曾佳玲,张 红
·个案报告·
恶性卵巢甲状腺肿合并甲状腺功能异常一例报道并文献复习
曾佳玲,张 红
目的 分析恶性卵巢甲状腺肿合并甲状腺功能异常患者的临床表现、实验室检查结果,进一步加深对本病的认识。方法 回顾性分析广西医科大学第四附属医院2015-04-29收住的1例恶性卵巢甲状腺肿合并甲状腺功能异常的罕见病例,同时通过检索卵巢甲状腺肿合并甲状腺功能异常的文献,进一步了解并认识此疾病。结果 卵巢甲状腺肿多见于围绝经期女性,单侧为主,一般为良性,恶性少见,全身多处转移更罕见,本例患者发病年龄与文献相符,表现为高度恶性并全身多处转移,同时合并甲状腺功能异常,属临床极罕见病例。结论 卵巢甲状腺肿可以导致甲状腺功能亢进,其产生的甲状腺素可能来源于:高功能卵巢甲状腺组织、高功能甲状腺和卵巢甲状腺组织同时存在、甲状腺组织分泌合并无功能卵巢甲状腺肿;由卵巢甲状腺肿导致的甲状腺功能亢进应该表现为盆腔摄碘率高而颈部摄碘率低;卵巢甲状腺肿合并甲状腺功能亢进的诊断较困难,多因反复复发的甲状腺功能亢进而引起重视,无功能性卵巢甲状腺肿更易引起漏诊;功能性卵巢甲状腺类似于异位甲状腺高功能腺瘤,其可分泌甲状腺激素,从而抑制甲状腺本身功能,但卵巢甲状腺肿以分泌三碘甲状腺原氨酸(T3)为主,可出现总三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)水平升高,促甲状腺素(TSH)、总甲状腺素(TT4)、游离甲状腺素(FT4)水平降低等异常甲状腺功能表现,但还需进一步研究证实。
卵巢甲状腺肿;甲状腺功能亢进症;病例报告;历史文献
曾佳玲,张红.恶性卵巢甲状腺肿合并甲状腺功能异常一例报道并文献复习[J].中国全科医学,2016,19(32):4002-4008.[www.chinagp.net]
ZENG J L,ZHANG H.Coexistence of thyroid dysfunction and malignant struma ovarii:one case report and literature review[J].Chinese General Practice,2016,19(32):4002-4008.
卵巢甲状腺肿为起源于三胚层生殖细胞的卵巢成熟畸胎瘤[1],占成熟卵巢畸胎瘤不足5%,常见报道为2.0%~4.8%[2-6],其大部分为甲状腺组织,多为单侧良性占位,一般为无功能性[7-8];任何年龄段均可发病,极少发生恶变,恶变率仅为1%~2%,50岁以上恶变率也低于5%[9-10],即使是恶性病例也很少发生转移,恶性卵巢甲状腺肿仅有5%~10%发生转移[11-13];其所导致甲状腺功能亢进属于甲状腺功能亢进病因中的极罕见类型,5%~15%的卵巢甲状腺肿可合并甲状腺功能亢进[7,14-18]。本文报道广西医科大学第四附属医院收治的1例恶性卵巢甲状腺肿合并甲状腺功能异常并全身多处转移患者,因其异常的甲状腺功能亢进表现目前尚未见文献描述,特报道如下。
1 病例简介
患者,女,46岁,已婚,因“甲状腺功能异常6年,腹围增加2年,下腹胀半年余”于2015-04-29入本院。2009年患者无明显诱因下出现阵发性心悸伴手颤、易饥饿,站立时下肢颤动等不适,2009-03-18在外院查甲状腺功能示甲状腺功能亢进(具体甲状腺功能指标水平见表1);甲状腺彩超未见异常;甲状腺球蛋白抗体(TGAb)618 U/ml(参考范围<115 U/ml),甲状腺球蛋白(TG)>500.0 μg/L(参考范围1.4~78.0 μg/L),抗甲状腺过氧化物酶抗体(TPOAb)17 U/ml(参考范围<34 U/ml),甲状腺摄碘率:3 h 3.6%、24 h 5.3%,诊断为“甲状腺功能亢进”。予抗甲状腺功能亢进治疗,多次查反三碘甲状腺原氨酸(rT3)0.13~0.18 nmol/L(参考范围0.54~1.46 nmol/L),抗甲状腺功能亢进治疗后即出现甲状腺功能异常,2009年7月—2012年8月反复调整治疗方案,甲状腺功能指标水平仍异常(具体情况及治疗详见表1)。2013年停用抗甲状腺功能亢进药物及优甲乐(左甲状腺素钠片),近2年来发现腹围逐渐增加伴下腹胀痛、隐痛,2015年4月外院查B超提示盆腔巨大包块;全腹CT平扫及增强提示:(1)附件原发性恶性肿瘤并盆腔、腹腔及肝脏多发转移瘤;少量腹腔积液;(2)右肺中叶及双肺下叶小结节,疑为转移瘤;(3)双侧腋窝淋巴结增大;(4)子宫肌瘤,恶性肿瘤侵犯未能除外。查肿瘤标志物提示:糖类抗原125(CA125)74 U/ml(参考范围0~35 U/ml)。2015-04-17外院行盆腔肿瘤穿刺活检术,术后病理提示:甲状腺组织,符合甲状腺肿改变;免疫组化:TG(+)。
既往孕2产1,人流1次,顺产1子,放置宫内节育器数年,末次月经2015-04-20;有高尿酸血症及高胰岛素血症病史;2006年发现右侧附件囊肿,行附件囊肿切除术,术后病理示平滑肌瘤,考虑诊断右侧卵巢甲状腺肿,术前、术后未见甲状腺功能异常。入院查体:36.9 ℃,心率100次/min,呼吸20次/min,血压106/73 mm Hg(1 mm Hg=0.133 kPa),全身浅表淋巴结未扪及肿大,甲状腺无肿大,心、肺检查未见异常,腹稍膨,下腹部可见4个腹腔镜术口,腹尚软,全腹无压痛及反跳痛,下腹可触及一质硬肿物,大小200 mm×100 mm,光滑、边界清、活动欠佳,无压痛。入院后相关检查:甲状腺功能检查:TGAb 624 U/ml,TG>500.0 μg/L,TPOAb 11 U/ml,促甲状腺素(TSH) 0.02 mU/L(参考范围0.27~4.20 mU/L),总三碘甲状腺原氨酸(TT3) 4.6 nmol/L(参考范围1.3~3.1 nmol/L),总甲状腺素(TT4) 55 nmol/L(参考范围66~181 nmol/L),游离三碘甲状腺原氨酸(FT3) 11.3 pmol/L(参考范围3.1~6.8 pmol/L),游离甲状腺素(FT4) 7.2 pmol/L(参考范围12.0~22.0 pmol/L)。性激素六项:促黄体生成素(HLH)44.8 U/L(处于排卵期激素水平),促卵泡激素(HFSH)21.4 U/L(处于排卵期激素水平),催乳素(PRL)371 mU/L(参考范围102~496 mU/L),孕酮4.33 nmol/L(处于排卵期激素水平),雌二醇779 pmol/L(处于排卵期激素水平),睾酮2.45 nmol/L(参考范围0.29~1.67 nmol/L);CA125 71 U/ml;甲状腺彩超未见异常(见图1,本文图片详见本刊官网www.chinagp.net电子期刊相应文章附件);胸部CT平扫+增强扫描示:(1)双肺多发小结节,考虑转移瘤;(2)肝尾叶区可疑肿块,建议进一步检查(见图2)。盆腔MRI示:考虑盆腔恶性肿瘤,考虑来源于子宫可能,并盆腔、腹腔多发播散转移(子宫前壁可见不规则分叶软组织肿块影,大小14.0 cm×8.0 cm×18.8 cm ,部分与小肠粘连;盆腔两侧分别见2个较大结节影,右侧7.1 cm×7.6 cm×8.1 cm,左侧3.8 cm×5.1 cm×6.8 cm;膀胱后壁与肿块粘连;肝脏周围、脾脏周围及左侧上腹部肠系膜可见多发大小不等结节影,最大4.7 cm×5.2 cm×6.3 cm)(见图3)。全身骨扫描(ECT)未见骨转移(见图4)。上腹部CT平扫+增强示:肝脏周围、脾脏周围、肠系膜内、肝门区软组织密度影,考虑转移瘤(见图5)。2015-05-13行盆腔肿物活检术,术中见:未见明显腹腔积液,盆腹腔与大网膜表面可见粟粒样及结节样肿物,表面不规则,质硬,直径0.5~5.0 cm不等;大网膜呈饼状、表面血管充盈,并与腹膜及肠系膜粘连致密,膀胱底、子宫双附件无法暴露;肝脏表面、膈下密布可见质硬结节,直径2.5~5.0 cm不等。快速冷冻病理结果提示:(盆腔肿物)甲状腺组织,考虑:(1)单胚层畸胎瘤(卵巢甲状腺肿);(2)甲状腺癌转移(见图6)。术后常规病理:(盆腔肿物)送检为甲状腺组织,甲状腺滤泡增生活跃,滤泡上皮细胞较拥挤,局灶可疑侵犯包膜,考虑:甲状腺癌转移;单胚层畸胎瘤,请结合临床,并建议到上级医院会诊。多次上级医院病理考虑:(盆腔肿瘤)符合卵巢单胚层畸胎瘤-甲状腺肿,卵巢甲状腺癌可能。考虑恶性肿瘤多处转移,建议化疗,患者未同意,随访5个月未见继续转移,自行中草药治疗(具体不详),甲状腺功能未恢复正常。

表1 卵巢甲状腺肿合并甲状腺功能异常患者甲状腺功能指标水平
2 文献复习
检索PubMed、MeSH terms、中国知网、万方数据知识服务平台2000年1月—2015年12月所有关键词/标题中含有卵巢甲状腺肿/Struma ovarii字样的文献,从结果中逐一筛查出同时含有甲状腺功能亢进、甲状腺功能减退的文献,从中筛选出数据及文章内容完整的文献共20篇[7,14,17,19-35],包括本例患者共23例。卵巢甲状腺肿发病年龄在20~73岁,中位年龄为48岁,多见于中老年;均为单侧病变,左侧15例,右侧8例;恶性病例少见,仅3例(13.0%),恶性病例均为围绝经期后发生,均存在转移,且血清TG水平明显升高。所有患者病程1个月~10年,合并甲状腺功能亢进者多同时存在高代谢临床表现,但均是因同时发现盆腔占位后手术切除占位病变病理明确诊断;所有患者中CA125水平升高8例,均为良性,存在胸、腹腔积液7例;行盆腔核酸扫描者6例,均表现为浓聚;除本例患者外均行手术治疗,多数患者术后甲状腺功能可恢复正常,仅少数出现甲状腺功能减退(见表2)。
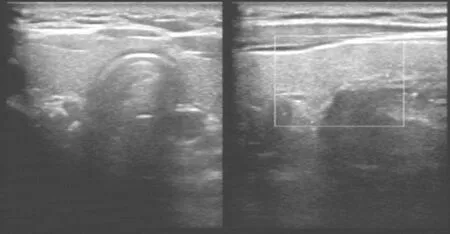
图1 甲状腺彩超未见甲状腺大小、形态异常,血流正常
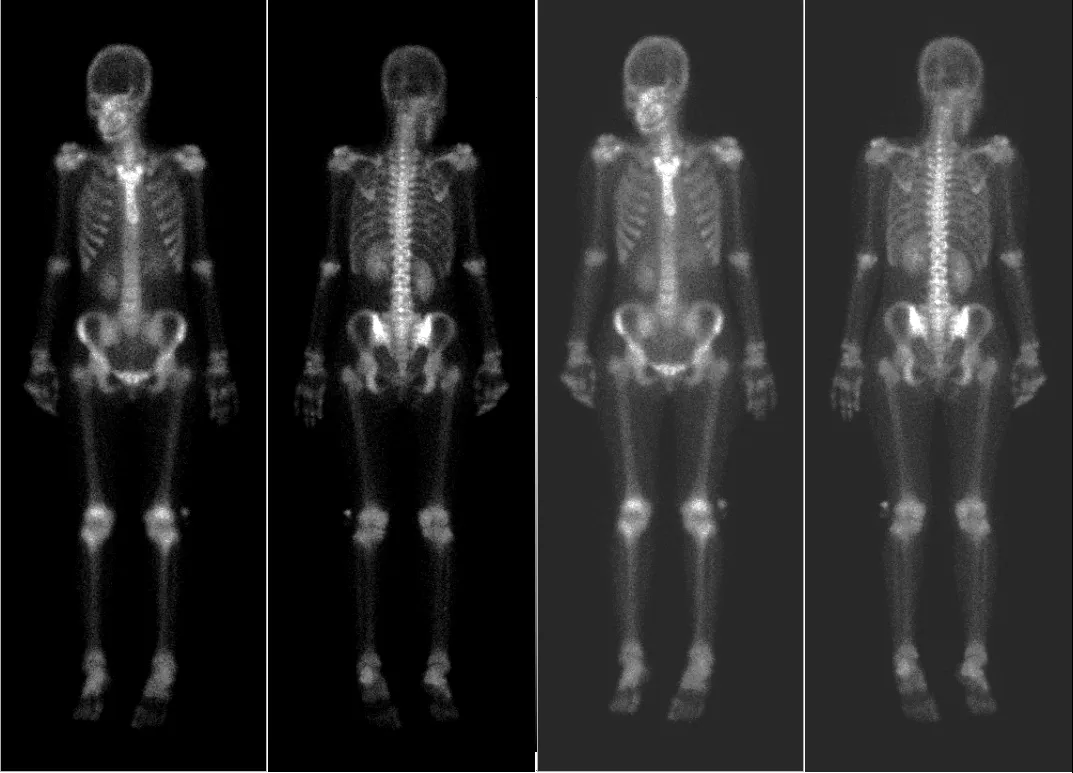
图4 全身骨扫描(ECT)未见骨转移

图2 胸部CT平扫可见双肺数个小结节影,增强扫描未见强化
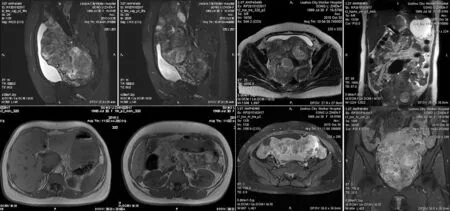
图3 盆腔MRI可见盆腔多发占位,卵巢、子宫结构紊乱
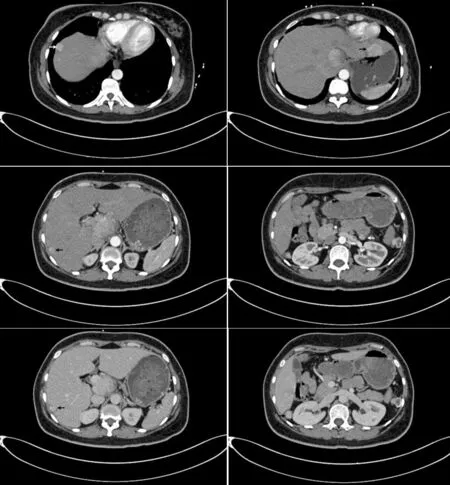
图5 上腹部CT平扫+增强可见肝脏周围、脾脏周围、肠系膜内、肝门区散在结节影,增强扫描稍强化

图6 盆腔组织病理结果提示:甲状腺滤泡增生活跃,滤泡上皮细胞较拥挤,局灶可疑侵犯包膜(苏木精-伊红染色)
3 讨论
卵巢甲状腺肿是一种很罕见的肿瘤,为卵巢成熟畸胎瘤的特殊类型,20%的卵巢畸胎瘤包含有甲状腺组织,但其中仅有1%~3%诊断为卵巢甲状腺肿[36-38]。本研究文献复习结果显示,卵巢甲状腺肿多发生于围绝经期妇女,多为良性肿瘤,临床上可无明显症状,多数患者以腹部肿块就诊,依据术后病理确诊。5%~15%的患者表现为甲状腺功能亢进或甲状腺毒症表现[7,14-18,21]。

表2 卵巢甲状腺肿合并甲状腺功能异常患者临床特征及主要实验室指标情况
卵巢甲状腺肿极少发生恶变,恶变率为1%~2%[39],多见于绝经期妇女,全身转移更为少见,仅有5%~10%发生转移[11-13],但MAKANI等[40]通过文献复习,发现恶性患者发生转移的占5%~23%。转移顺序一般为对侧卵巢、盆腔、骨、肝脏、脑和肺脏,最常见的转移部位为腹膜、肠系膜、大网膜[41]。本例患者出现了包括肺脏、肝脏、子宫、盆腔等多处转移,转移范围广、恶性程度高。当卵巢甲状腺肿同时合并胸、腹腔积液,血清CA125水平升高时,应高度怀疑恶性可能[42],但CA125水平升高并不是作为评估良恶性的标准,文献复习中2例恶性卵巢甲状腺肿患者,血清CA125水平不高,本例患者血清CA125水平仅轻度升高,无明显胸、腹腔积液,却全身多脏器转移,恶性程度极高;而CA125水平明显升高者多合并有大量胸、腹腔积液表现,故其水平升高可能为胸、腹腔积液存在对胸、腹膜刺激引起所致[22],而不能作为判定良恶性标志;有学者指出恶性诊断成立应为:排除原发性甲状腺癌后,肿瘤具有侵袭性和/或转移[19],本例患者有明显转移,病理也高度怀疑恶性可能,似突破包膜改变,但本院未行免疫组化检查,是否高度恶性仍有待进一步病理及免疫组化证实,但也有学者指出任何有转移迹象的卵巢甲状腺肿应该视为恶性[9,12,43],故本例患者考虑为恶性卵巢甲状腺肿,出现多部位转移属罕见病例,考虑与患者病史长及临床未及时诊治有关。
TG水平升高对于恶性卵巢甲状腺肿具有重要的临床意义,文献复习中也可见到,恶性卵巢甲状腺肿TG水平明显升高,尤其测定卵巢静脉血TG水平对于区分良恶性意义更高[20]。本例患者TG水平明显升高,倾向于恶性。李明[30]指出TG水平升高应高度怀疑异位的甲状腺高功能腺瘤的可能,故TG是否可作为区分良恶性的指标尚有待研究,因文献复习中仅有少数学者提及TG水平,望今后学者多加重视。
卵巢甲状腺肿合并甲状腺功能亢进的原因一般考虑有3种可能[14]:(1)高功能卵巢甲状腺组织分泌大量的甲状腺素;(2)甲状腺本身和卵巢甲状腺肿同时分泌大量甲状腺素;(3)甲状腺分泌甲状腺素合并无功能性卵巢甲状腺肿;故卵巢甲状腺肿导致甲状腺功能亢进诊断较困难,颈部摄碘率降低,全身扫描时卵巢碘剂和/或核素浓聚,同时卵巢促甲状腺激素受体抗体(TRAb)表达阳性可明确卵巢甲状腺肿导致甲状腺功能亢进的发生[27];本例患者曾有对侧卵巢甲状腺肿病史,后诊断甲状腺功能亢进,多次测定甲状腺摄碘率不高,甲状腺彩超未见甲状腺肿大改变,长期接受抗甲状腺功能亢进药物及优甲乐治疗,多次测定甲状腺功能异常,停用抗甲状腺功能亢进药物后甲状腺功能长期未恢复正常,故有依据怀疑患者卵巢甲状腺肿合并甲状腺功能亢进可能。
卵巢甲状腺肿可导致甲状腺功能亢进的发生,引起甲状腺功能亢进的机制尚未明确,有学者指出TRAb在卵巢甲状腺肿中扮演着极重要的角色[27];卵巢甲状腺组织受循环血中促甲状腺激素受体(TSHR)的反复刺激导致循环血中TRAb水平明显升高,分泌大量甲状腺素入血引起;文献复习显示,测定TRAb的6例患者中,阳性及阴性各3例,本例患者入住科室为妇科,未测定TRAb水平,且文献中多数患者也未测定,故TRAb与卵巢甲状腺肿的关系有待进一步的研究证实,建议后期对于甲状腺功能亢进患者尤其是反复发作的甲状腺功能亢进,抗甲状腺功能亢进药物治疗效果差的患者应该测定TRAb,甲状腺功能亢进患者TRAb水平升高同时合并盆腔占位者应高度怀疑卵巢甲状腺肿所致甲状腺功能亢进可能。
少部分患者在卵巢甲状腺肿瘤切除后可出现甲状腺功能减退[26],文献复习也证实了这点;本例患者甲状腺功能变化及目前甲状腺功能表现为TT3、FT3水平升高,TSH、TT4、FT4水平降低,目前国内外均未见有类似甲状腺功能指标水平的描述,HASLETON等[44]曾指出功能性卵巢甲状腺肿的标志性生物学表现为TG及三碘甲状腺原氨酸(T3)阳性,这是否可解释为卵巢甲状腺肿中的甲状腺组织在TRAb的刺激下主要以分泌T3为主,而目前大多数学者认为卵巢甲状腺肿引起甲状腺功能亢进的原因可能为卵巢甲状腺肿类似于异位甲状腺高功能腺瘤,异位甲状腺高功能腺瘤抑制甲状腺本身功能分泌大量的甲状腺激素(主要为T3),循环血中T3水平的升高通过负反馈作用抑制垂体TSH的合成与分泌,TSH水平降低再次抑制甲状腺合成和分泌甲状腺素,而循环血中甲状腺素水平的降低又可以导致卵巢甲状腺肿代偿性的分泌更多的T3入血;故本例患者表现为T3水平升高等甲状腺功能异常,本例患者甲状腺功能异常罕见,后期需要大量的研究进一步证实。
本文报道1例恶性卵巢甲状腺肿合并甲状腺功能亢进,后期出现甲状腺功能异常表现,属罕见病例,国内外目前尚未见有类似甲状腺功能异常描述,有一定研究价值;通过本例患者,临床中(无论是内分泌科或其他非内分泌科医师)对于甲状腺功能亢进病史长,抗甲状腺功能亢进药物治疗效果差者应高度怀疑异位甲状腺肿可能,重视TG、TRAb等相关抗体的检测,若条件允许应完善颈部及盆腔核酸扫描。本病应与卵巢癌、卵巢畸胎瘤、子宫内膜癌等相鉴别,对于盆腔肿瘤者妇产科医师应重视病史采集及多学科的会诊及早明确诊断及治疗,以免延误诊治时机。
作者贡献:曾佳玲进行资料收集整理、撰写论文、成文并对文章负责;张红进行质量控制及审校。
本文无利益冲突。
[1]O′NEILL J P,BURNS P,KINSELLA J.Papillary type thyroid carcinoma in an ovarian struma[J].Ir J Med Sci,2010,181(1):115-117.
[2]ZALEL Y,SEIDMAN D S,OREN M,et al.Sonographic and clinical characteristics of struma ovarii[J].J Ultrasound Med,2000,19(12):857-861.
[3]DARDIK R B,DARDIK M,WESTRA W,et al.Malignant struma ovarii:two case reports and a review of the literature[J].Gynecol Oncol,1999,73(3):447-451.
[4]RIBEIRO-SILVA A,BEZERRA A M,SERAFINI L N.Malignant struma ovarii:an autopsy report of a clinically unsuspected tumor[J].Gynecol Oncol,2002,87(2):213-215.
[5]EZON I,ZILBERT N,PINKNEY L,et al.A large struma ovarii tumor removed via laparoscopy in a 16-year-old adolescent [J].J Pediatr Surg,2007,42(8):19-22.
[6]BONADIO A G.Hashimoto′s thyroiditis in "struma ovarii".Case report and review of the literature[J].Minerva Endocrinol,2002,27(1):49-52.
[7]GUIDA M,MANDATO V D,DI SPIEZIO SARDO A,et al.Coexistence of Graves′ disease and benign struma ovarii in a patient with marked ascites and elevated CA-125 levels[J].J Endocrinol Invest,2005,28(9):827-830.
[8]NAGAI K,YOSHIDA H,KATAYAMA K,et al.Hyperthyroidism due to struma ovarii:diagnostic pitfalls and preventing thyroid storm[J].Gynecology and Minimally Invasive Therapy,2016.DOI:10.1016/j.gmit.2016.05.002.
[9]DESIMONE C P,LELE S M,MODESITT S C.Malignant struma ovarii:a case report and analysis of cases reported in the literature with focus on survival and I131 therapy[J].Gynecol Oncol,2003,89(3):543-548.
[10]YAMASHITA M,ISHII T,OHTORI S,et al.Metastasis of malignant struma ovarii to the lumbar spine[J].J Clin Neurosci,2010,17(2):269-272.
[11]KABUKCUOGLU F,BAKSU A,YILMAZ B,et al.Malignant struma ovarii[J].Pathol Oncol Res,2002,8(2):145-147.
[12]DEVANEY K,SNYDER R,NORRIS H J,et al.Proliferative and histologically malignant struma ovarii:a clinicopathologic study of 54 cases[J].Int J Gynecol Pathol,1993,12(4):333-343.
[13]O′CONNELL M E,FISHER C,HARMER C L.Malignant struma ovarii:presentation and management[J].Br J Radiol,1990,63(749):360-363.
[14]ANASTASILAKIS A D,RUGGERI R M,POLYZOS S A,et al.Coexistence of Graves′ disease,papillary thyroid carcinoma and unilateral benign struma ovarii:case report and review of the literature[J].Metabolism,2013,62(10):1350-1356.
[15]BAYOT M R,CHOPRA I J.Coexistence of struma ovarii and Graves′ disease[J].Thyroid,1995,5(6):469-471.
[16]WONG L Y,DIAMOND T H.Severe ophthalmopathy developing after treatment of coexisting malignant struma ovarii and Graves′ disease[J].Thyroid,2009,19(10):1125-1127.
[17]BARTEL T B,JUWEID M E,O′DORISIO T,et al.Scintigraphic detection of benign struma ovarii in a hyperthyroid patient[J].J Clin Endocrinol Metab,2005,90(6):3771-3772.
[18]RANA V,SRINIVAS V,BANDYOPADHYAY S,et al.Bilateral benign non functional struma ovarii with Pseudo-Meigs′ syndrome[J].Indian J Pathol Microbiol,2009,52(1):94-96.
[19]KANO H,INOUE M,NISHINO T,et al.Malignant struma ovarii with Graves′ disease [J].Gynecol Oncol,2000,79(3):508-510.
[20]MATSUDA K,MAEHAMA T,KANAZAWA K.Malignant struma ovarii with thyrotoxicosis[J].Gynecol Oncol,2001,82(3):575-577.
[21]CICCARELLI A,VALDES-SOCIN H,PARMA J,et al.Thyrotoxic adenoma followed by atypical hyperthyroidism due to struma ovarii:clinical and genetic studies[J].Eur J Endocrinol,2004,150(4):431-437.
[22]LOIZZI V,CORMIO G,RESTA L,et al.Pseudo-Meigs syndrome and elevated CA125 associated with struma ovarii[J].Gynecol Oncol,2005,97(1):282-284.
[23]MITROU S,MANEK S,KEHOE S.Cystic struma ovarii presenting as pseudo-Meigs′ syndrome with elevated CA125 levels.A case report and review of the literature[J].Int J Gynecol Cancer,2008,18(2):372-375.
[24]PALADINI D,VASSALLO M,SGLAVO G,et al.Struma ovarii associated with hyperthyroidism,elevated CA125 and pseudo-Meigs syndrome may mimic advanced ovarian cancer[J].Ultrasound Obstet Gynecol,2008,32(2):237-238.
[25]KIM D,CHO H C,PARK J W,et al.Struma ovarii and peritoneal strumosis with thyrotoxicosis[J].Thyroid,2009,19(3):305-308.
[26]JIANG W,LU X,ZHU Z L,et al.Struma ovarii associated with pseudo-Meigs′ syndrome and elevated serum CA125:a case report and review of the literature[J].J Ovarian Res,2009,3(1):18.
[27]SITASUWAN T,HANAMORNROONGRUANG S,PEERAPATDIT T,et al.Coexistence of Graves′ disease and unilateral functioning Struma ovarii:a case report[J].BMC Endocr Disord,2015,15(1):68.
[28]MERZA Z,WHITE D,KHANEM N.Struma ovarii in pregnancy:an uncommon cause of hyperthyroidism[J].Clin Nucl Med,2015,40(8):687-688.
[29]邓伟胜,张开鄂.卵巢甲状腺肿致甲亢1例[J].广东医学,2000,21(10):832.
[30]李明.甲状腺肿性卵巢瘤与甲状腺功能亢进症[J].国外医学(内分泌学分册),2000,20(3):160.
[31]温运昌,邓伟胜,张练宗.卵巢甲状腺肿合并甲状腺功能亢进症1例[J].陕西医学杂志,2002,31(2):191-192.
[32]吴成秀,谢建平,张涛,等.卵巢甲状腺肿合并甲状腺功能亢进一例[J].中华核医学杂志,2004,24(6):352.
[33]于明庆,吕焕芝.卵巢甲状腺肿伴甲亢一例[J].肿瘤防治杂志,2003,10(9):970.
[34]于蕊,姚莉,李君东,等.卵巢甲状腺肿伴Meig′s综合征3例报告[J].医师进修杂志,2001,24(7):62.
[35]张鸿艳,邵元平.卵巢甲状腺肿致甲亢1例[J].中国现代医药杂志,2008,10(6):97.
[36]ROTH L M,TALERMAN A.The enigma of struma ovarii[J].Pathology,2007,39(1):139-146.
[37]DHINGRA K K,JAIN P,GARG A,et al.Coexistent struma ovarii and serous cystadenofibroma in the same ovary[J].Int J Gynecol Pathol,2009,28(3):231-233.
[38]YÜCESOY G,CAKIROGLU Y,MUEZZINOGLU B,et al.Malignant struma ovarii:a case report[J].J Korean Med Sci,2010,25(2):327-329.
[39]ZANNONI G F,GALLOTTA V,LEGGE F,et al.Pseudo-Meigs′ syndrome associated with malignant struma ovarii:a case report[J].Gynecol Oncol,2004,94(1):226-268.
[40]MAKANI S,KIM W,GABA A R.Struma ovarii with a focus of papillary thyroid cancer:a case report and review of the literature[J].Gynecol Oncol,2004,94(3):835-839.
[41]STEINMAN R A,DE CASTRO I O,SHRAYYEF M,et al.Two cases of malignant struma ovarii with metastasis to pelvic bone[J].Gynecologic and Obstetric Investigation,2013,75(2):139-144.
[42]JIN C,DONG R,BU H,et al.Coexistence of benign struma ovarii,pseudo-Meigs′ syndrome and elevated serum CA125:case report and review of the literature[J].Oncol Lett,2015,9(4):1739-1742.
[43]WILLEMSE P H B,OOSTERHUIS J W,AALDERS J G,et al.Malignant struma ovarii treated by ovariectomy,thyroidectomy,and 131 I administration[J].Cancer,1987,60(2):178-182.
[44]HASLETON P S,KELEHAN P,WHITTAKER J S,et al.Benign and malignant struma ovarii[J].Arch Pathol Lab Med,1978,102(4):180-184.
(本文编辑:陈素芳)
Coexistence of Thyroid Dysfunction and Malignant Struma Ovarii:One Case Report and Literature Review
ZENGJia-ling,ZHANGHong.DepartmentofEndocrinology,theFourthAffiliatedHospitalofGuangxiMedicalUniversity,LiuzhouWorker′sHospital,Liuzhou545005,China
ZHANGHong,DepartmentofEndocrinology,theFourthAffiliatedHospitalofGuangxiMedicalUniversity,LiuzhouWorker′sHospital,Liuzhou545005,China;E-mail:996489443@qq.com
Objective To explore the clinical manifestation and laboratory test results of patients with thyroid dysfunction and malignant struma ovarii,to enhance the understanding of the disease.Methods A patient with thyroid dysfunction and malignant struma ovarii was admitted to the Fourth Affiliated Hospital of Guangxi Medical University on 29 April 2015,the data of the case were analyzed retrospectively.To further understand coexistence of thyroid dysfunction and malignant struma ovarii by literature retrieval.Results Struma ovarii is more common in perimenopausal women and on unilateral side,and most of them are benign,multiple metastases are rarely seen.The onset age of this case is identical with the onset age recorded in literatures,the lesion is highly malignant and multiple metastases are observed,and the case is clinically very rare because of the existence of thyroid dysfunction.Conclusion Struma ovarii can cause hyperthyroidism,possible sources of thyroxine:high functional ovarian thyroid tissue,high functional thyroid and struma ovarii,thyroid tissue secretion combined with non functional ovarian goiter;for hyperthyroidism caused by struma ovarii,the iodine uptake rate in pelvic cavity should be high and the iodine uptake rate in the neck should be low;the diagnosis of struma ovarii combined with hyperthyroidism is relatively difficult,the disease always is paid more attention to due to repeated recurrence of hyperthyroidism,non functional struma ovarii is more likely to cause missed diagnosis;functional ovarian thyroid is similar to ectopic thyroid gland hyperactive adenoma,and can secrete thyroid hormone,thus can inhibit thyroid function,but struma ovarii secrets triiodothyronine(T3) mainly,the abnormal thyroid function performance such as increased levels of TT3and FT3,and decreased levels of TSH,TT4and FT4may exist,all of these findings warrant further research.
Struma ovarii;Hyperthyroidism;Case reports;Historical article
545005广西柳州市,广西医科大学第四附属医院 柳州市工人医院内分泌科
张红,545005广西柳州市,广西医科大学第四附属医院 柳州市工人医院内分泌科;E-mail:996489443@qq.com
R 730.265.7 R 581.1
D
10.3969/j.issn.1007-9572.2016.32.022
2016-03-13;
2016-09-21)

