高效抑制O157∶H7 B.s.2012的选育及抗菌物质提取的研究
石 慧, 肖 畅, 杜小凤 , 向星杰 , 张俊红
(1.武汉设计工程学院 食品与生物科技学院,湖北 武汉 430205;2.华中农业大学 园艺林学学院,湖北 武汉 430070)
高效抑制O157∶H7B.s.2012的选育及抗菌物质提取的研究
石 慧1, 肖 畅1, 杜小凤1, 向星杰1 , 张俊红2*
(1.武汉设计工程学院 食品与生物科技学院,湖北 武汉 430205;2.华中农业大学 园艺林学学院,湖北 武汉 430070)
对枯草芽胞杆菌2012进行诱变,提高抗菌物质的产量,并提取抗菌物质。用紫外线及亚硝基胍协同诱变处理对数生长中期的枯草芽胞杆菌2012 (B.s.2012),在大肠埃希菌为敏感菌的生物鉴定板上筛选产量提高的菌株。比较用乙酸乙酯法、80%乙醇法和甲醇法提取抗菌物质的优劣。正交试验优化甲醇提取法。突变株B.s.2012-21和B.s.2012-28的抑菌圈直径比原菌株分别增大84.62%和40.38%。甲醇法提取的得率最高。正交试验结果表明,提取pH为2.0,菌株发酵时间为36 h,4 ℃处理时间为36 h时,抗菌物质的得率最高。获得抗菌物质产量大幅提高的B.s.2012-21突变菌株。甲醇法是提取抗菌物质得率最高的方法。
枯草芽胞杆菌;抗菌物质;紫外诱变;NTG诱变;提取
枯草芽胞杆菌能分泌具有潜在生物医药价值的低分子量的抗菌肽和细菌素类的抗菌活性物质,且对人及动物无害,这对于人类和动物疾病治疗具有重要意义[1],目前产抗菌物质的芽胞杆菌主要用于植物病害防治并投产[2],也广泛用于动物饲料添加剂[3]。在防治人和动物疾病上,由于枯草芽胞杆菌分泌的抗菌物质浓度低,生产及提取成本高,这一领域的应用还有很大的拓展空间。O157∶H7是一种主要通过食物传播的致病菌[4],在肉及肉制品、奶制品、水、蔬菜沙拉、水果及果酱中都有发现[55],可以引起婴幼儿腹泻、出血性结肠炎、溶血性尿毒综合症 (HUS) 和血栓性血小板减少性紫癜(TTP),甚至死亡[6]。本文筛选到1株枯草芽胞杆菌B.s.2012 能有效抑制大肠埃希菌O157∶H7的生长,在控制大肠埃希菌O157∶H7食源性食物中毒及其引起的人畜共患疾病上有很好的应用前景,并通过诱变育种改良有效提高了其生产能力,初步研究了其抗菌物质的提取方法。
1 材料与方法
1.1 材料
1.1.1 菌种 枯草芽胞杆菌2012 (B.s.2012),大肠埃希菌(O157∶H7)。
1.1.2 培养基 ①活化培养基:牛肉膏10 g,蛋白胨20 g,MgSO4·7H2O 0.5 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.0;②种子培养基:葡萄糖3.5 g,蛋白胨0.83 g,酵母膏0.5 g,KH2PO40.35 g,CaCO30.2 g,蒸馏水1 000 mL,pH 7.0;③发酵培养基:牛肉膏10 g,蛋白胨20 g,葡萄糖5 g,NaCl 5 g,MgSO4·7H2O 0.5 g,KH2PO40.03 g,蒸馏水1 000 mL,pH 7.0;④软琼脂 LB:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂粉 7.5 g,蒸馏水 1 000 mL,pH 7.0。
1.1.3 试剂 4 mg/mL亚硝基胍 (NTG) 溶液[7],pH 7.4的磷酸盐缓冲液(PBS)。
1.2 方法
1.2.1B.s.2012 对数生长中期的测定 取B.s.2012划线转接至活化培养基平板上,37 ℃ 培养12 h。取活化后的单菌落接入种子培养基中,37 ℃,150 r/min振荡培养12 h备用。以1%的接种量将B.s.2012接入另一瓶种子培养基中,37 ℃,150 r/min振荡培养。从接入液体菌种开始计时,每隔2 h取样,以种子培养基为空白对照,在波长为600 nm处用分光光度计测定OD600。以培养时间为横坐标,OD600为纵坐标,绘制B.s.2012 的生物量曲线,找到生长到对数生长中期所需的时间。
1.2.2B.s.2012 的紫外线诱变剂量的选择 将B.s.2012 单菌落接种到种子培养基中,待生长到对数生长中期(OD600=0.4~0.5)时,稀释菌悬液到10-5,取10-5稀释液10 mL 至无菌平皿,放置在超净工作台上,用磁力搅拌器低速搅拌。黑暗中,用紫外灯(约 60 cm高)分别照射5、10、15、20、25、30、35、40、45、50 min。取各个照射处理后的菌悬液 0.1 mL,在红光下均匀涂布在活化培养基平板上,用黑色塑料袋包裹,37 ℃培养12 h,计活菌数,计算致死率。以照射时间为横坐标,B.s.2012 的致死率为纵坐标,绘制曲线,找到致死率为70%时的照射时间,即为紫外线诱变剂量。
1.2.3B.s.2012 的亚硝基胍诱变剂量的选择 以20、40、80、160、320、640 μg/mL 的 NTG 质量终浓度处理稀释到10-5对数生长中期的B.s.2012 1 h,取0.1 mL 涂布在活化培养基平板上,37 ℃培养12 h,计活菌数。以处理质量浓度为横坐标,B.s.2012 的致死率为纵坐标,绘制曲线,找到致死率为70%时 NTG 的工作浓度,即为最适的 NTG 诱变剂量。
1.2.4B.s.2012 的诱变及突变菌株的筛选 将培养到对数生长中期的B.s.2012 10-5稀释液10 mL 先在超净工作台上用紫外灯照射35 min,再加入质量终浓度为 250 μg/mL的 NTG 处理 1 h,取诱变处理后的菌悬液 0.1 mL 涂布于平板上,37 ℃ 培养12 h。分别挑取平板中的单菌落接到种子培养基中,37 ℃、150 r/min 培养过夜备用。控制接种量为1%,将各菌株分别接入发酵培养基中,于37 ℃、150 r/min下振荡培养30 h。发酵液在5 000 r/min 离心10 min 后用 0.22 μm 的无菌过滤膜过滤除菌备用。以大肠埃希菌O157∶H7 为敏感指示菌,取20 μL过夜培养液,混入3 mL 灭菌软琼脂 LB,轻轻摇匀,倾倒在活化培养基平板上,铺平冷却。取各菌株无菌滤液 10 μL 点接在平板上,晾干1 h,37 ℃ 培养过夜,观察并测量各个抑菌圈直径的大小,筛选突变菌株,整个筛选过程以未做诱变处理的B.s.2012 做对照,并始终保持菌体位于黑暗之中。
1.2.5B.s.2012-21 发酵液中抗菌物质的提取 取B.s.2012-21 单菌落接入到种子培养基中,37 ℃、150 r/min振荡培养9 h后转接100 μL至100 mL发酵培养基中,37 ℃、150 r/min下振荡培养30 h。将B.s.2012-21 发酵液在5 000 r/min下离心15 min,收集上清液备用。①乙酸乙酯法提取抗菌物质:取B.s.2012-21 100 mL 发酵上清液,用等体积乙酸乙酯萃取 2 遍,收集有机相减压浓缩至约 30 mL,得到抗菌物质的粗提物。将抗菌物质粗提物于50 ℃干燥至恒重,用1 mL 甲醇把富集粗提物溶解为溶液,再将其放于50 ℃ 下干燥至恒重,得到抗菌物质粗提物结晶体,称重。②乙醇法提取抗菌物质:取B.s.2012-21 100 mL 发酵上清液,用 6 mol/L HCl 调节 pH 值到 2.0,在4 ℃冰箱中静置24 h (提取时间)后,5 000 r/min 离心15 min,弃上清液。用 2 mL 80%乙醇在室温下反复抽提2~3次,5 000 r/min 离心15 min,收集每次离心的上清液,在50 ℃的烘箱中干燥至恒重,得黄褐色粗提物结晶体,称重。③甲醇法提取抗菌物质:方法同 ②,仅将甲醇置换掉80%的乙醇。将提取所得的结晶体称重。④不同方法提取的抗菌物质的抑菌试验:用管蝶法检测不同样品的抑菌能力[8]。 将不同方法纯化的样品晶体均溶解在2 mL PBS 缓冲液中备用。以O157∶H7 为敏感菌,过夜培养,取0.1 mL 1 000 倍稀释的菌液涂布在活化培养基平板上,以提取溶剂乙酸乙酯、甲醇、80%的乙醇溶液及原发酵液为对照,测试不同样品的抑菌能力。各样品均取50 μL到牛津杯中,28 ℃静置培养24 h,观察并测量抑菌圈直径。
1.2.6 甲醇法中影响抗菌物质提取得率的主要因素的正交试验 发酵时间(A)、提取pH(B)、提取时间(C)这3个因素为影响甲醇法提取得率的最重要因素,本试验选取这3个因素做正交试验,每个因素均取3个水平,进行3因素3水平正交试验。其正交试验设计见表1。

表1 3 因素 3 水平正交试验设计
选取抑菌圈直径作为试验处理优劣的鉴定指标,抑菌圈直径可以直接反映抗菌物质提取得率的高低,这样设计的正交试验就可说明不同试验号抗菌物质的提取效果,进而确定最佳的提取方案。
2 结果与分析
2.1B.s.2012 对数生长中期的测定结果
在不同培养时间下取样,将B.s.2012 原菌液稀释3倍后,测定OD600,根据所测得的数据绘制其生物量曲线如图 1。

图1 B.s.2012 生物量曲线Fig.1 The biomass curve of Bacillus subtilis 2012
由图 1可知,B.s.2012 培养至约 4 h 开始进入对数生长期,在培养至约 9 h 时,结束对数生长,开始进入稳定期,对数生长中期的时间约为 6~7 h。本试验选择培养7 h 的B.s.2012 菌悬液进行诱变处理,可以有效地避免芽胞的干扰,有利于诱变处理。
2.2 紫外线诱变剂量的选择结果
B.s.2012 在紫外灯照射处理后,根据照射时间和该照射时间下的致死率绘制了致死率曲线,其结果如图 2 所示。

图2 B.s.2012紫外诱变致死率曲线Fig.2 The death rate curve of B.s.2012 mutagensised by UV
由图 2可知,枯草芽胞杆菌B.s.2012 用超净工作台上紫外灯照射35 min 时,其致死率可达到70%。在照射距离和紫外灯管的额定功率不变时,35 min即为B.s.2012 合适的紫外线诱变剂量。
2.3B.s.2012 的亚硝基胍诱变剂量的选择结果
B.s.2012 经 NTG 处理1 h 后,根据处理浓度和该处理浓度下的致死率绘制了致死率曲线,其结果如图 3 所示。由图 3可知,当 NTG 的浓度为 250 μg/mL时,致死率为70%,此浓度即为 NTG 的最适诱变浓度。

图3 B.s.2012 NTG诱变致死率曲线
2.4B.s.2012 的诱变处理及突变菌株的筛选结果
诱变处理后,各存活菌株发酵液抑菌能力的变化见表 2 及图 4a、图 4b。
表2 诱变后各存活菌株发酵液的抑菌能力测试
Table 2 The antibacterial activity test of
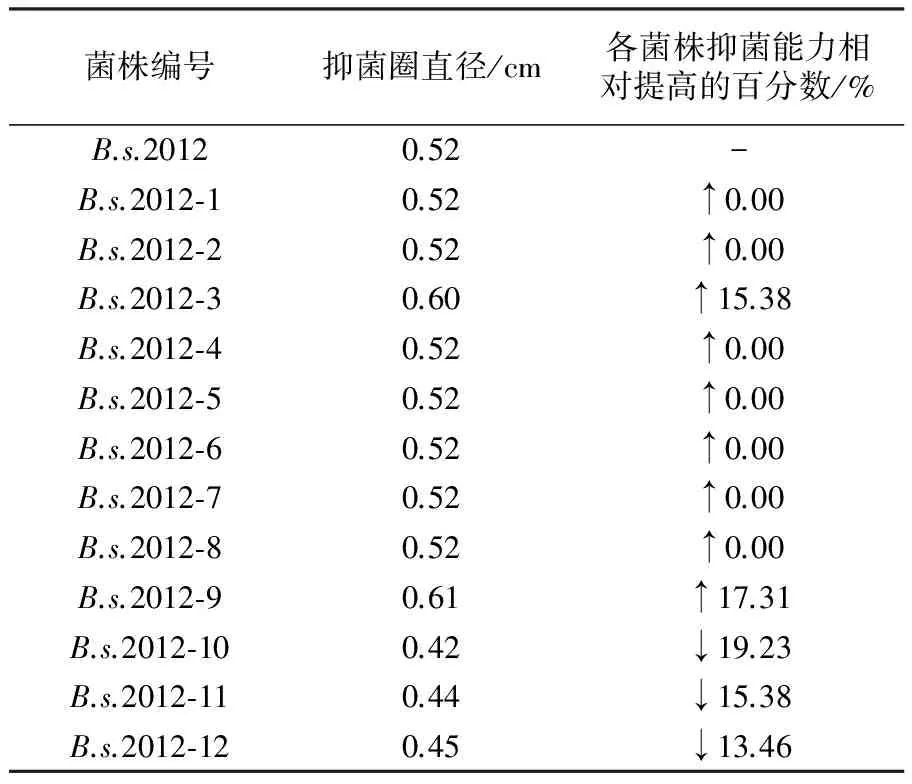
菌株编号抑菌圈直径/cm各菌株抑菌能力相对提高的百分数/%B.s.20120.52-B.s.2012⁃10.52↑0.00B.s.2012⁃20.52↑0.00B.s.2012⁃30.60↑15.38B.s.2012⁃40.52↑0.00B.s.2012⁃50.52↑0.00B.s.2012⁃60.52↑0.00B.s.2012⁃70.52↑0.00B.s.2012⁃80.52↑0.00B.s.2012⁃90.61↑17.31B.s.2012⁃100.42↓19.23B.s.2012⁃110.44↓15.38B.s.2012⁃120.45↓13.46

续表2
注:“-”表示未计算出发菌株对自身抑菌能力提高的百分数;“↑”表示该菌株比出发菌株抑菌能力提高的百分数;“↓”表示该菌株比出发菌株抑菌能力低的百分数

图4 诱变后各菌株对O157∶H7的抑制作用Fig.4 The inhibition by different strains after mutation treatment to O157∶H7
由表2及图 4a、图 4b 可知,菌株B.s.2012-21、B.s.2012-28 与未处理的B.s.2012 对照相比抑菌圈直径明显增大。经多次重复,这 2 株菌与未诱变处理B.s.2012 在相同的条件下发酵,当敏感菌均为O157∶H7 时,菌株B.s.2012-21、B.s.2012-28 产生的抑菌圈直径稳定大于原B.s.2012 所产生的抑菌圈直径,说明经过诱变处理后,该 2 株菌产抗菌物质的能力提高了。其中, 菌株B.s.2012-21产抗菌物质的能力提高了84.62%,B.s.2012-28提高了40.38%。
2.5 不同方法提取枯草芽胞杆菌B.s.2012-21 发酵液中抗菌物质的结果
2.5.1 不同方法提取B.s.2012-21 发酵液中抗菌物质晶体质量的比较 每种提取方法均取100 mL 相同发酵液来提取抗菌物质,称量提取后所得的晶体质量,结果如图 5 所示。由图 5可知,3种方法中甲醇法提取的抗菌物质平均质量最高,乙酸乙酯法提取的抗菌物质质量最低。但由于不能判断所提取的抗菌物质的纯度,故还不能判断哪种提取方法抗菌物质的得率最高。
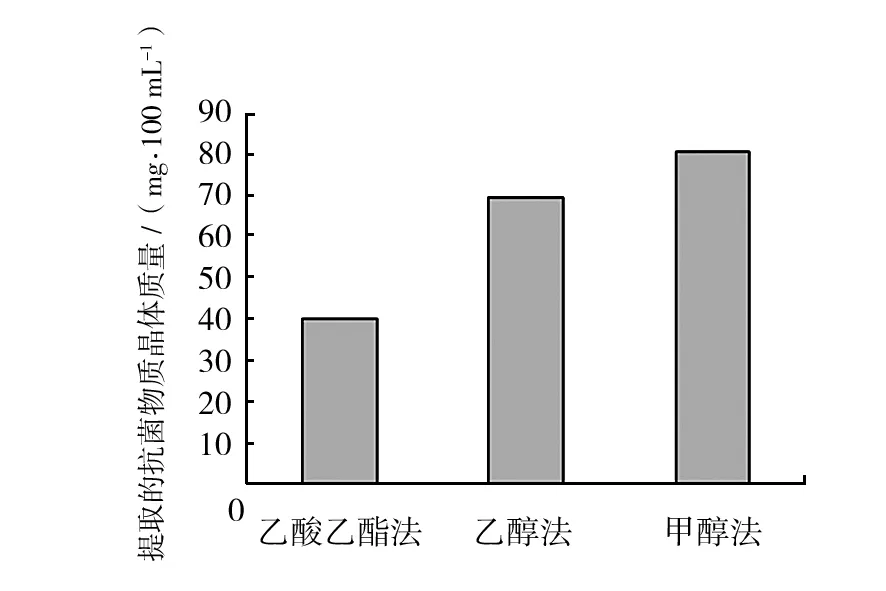
图5 不同方法提取抗菌物质的质量比较Fig.5 The quality comparison of antimicrobial substances from different extraction methods

图6 不同提取法抗菌物质溶液的抑菌效果对比Fig.6 The comparison of antibacterial effect of antibacterial substance solution from different extraction method1:乙酸乙酯对照;2:甲醇对照;3:80%乙醇对照;4:原发酵液对照;5:乙酸乙酯法提取物溶液;6:乙醇法提取物溶液;7:甲醇法提取物溶液1:Ethyl acetate control; 2:Methanol control; 3:80% ethanol control; 4:Control of original fermentation liquid; 5:The solution extracted by Ethyl acetate method; 6:The solution extracted by ethanol method; 7:The solution extracted by methanol method
2.5.2 不同方法提取B.s.2012-21 发酵液中抗菌物质溶液的抑菌效果比较 将不同方法提取的 抗菌物质均用2 mL PBS缓冲液溶解,以O157∶H7 为敏感菌的抑菌效果见图6。由图5及图6可知,排除对照的影响,甲醇法提取物溶液的质量最大,在相同条件下抑菌直径也最大,所提取的抗菌物质溶液抑菌能力最强,乙酸乙酯所提取的抗菌物质溶液的抑菌直径最小,抑菌能力最弱。结合图 5 可充分说明甲醇法提取的抗菌物质得率最高,在三种方法中占有优势。
2.6 甲醇法中影响抗菌物质提取得率的主要因素正交试验的结果
以发酵时间(A)、提取pH(B)、提取时间(C)这3个因素设计正交试验结果见表 3。
由表 3可知,极差值B>A>C,影响抑菌圈直径最重要的因素为 pH,其次为发酵时间,影响最小的因素为样品在4 ℃ 时的静置时间。在9个试验组中,抑菌圈直径最大的试验组合为A2B2C3,即为最优组合。枯草芽胞杆菌B.s.2012-21 在发酵36 h后,调节发酵上清液的pH为2.0,4 ℃冰箱静置36 h 时使用甲醇提取法抗菌物质溶液的抑菌圈直径最大,抗菌物质的提取得率最高。

表3 正交试验结果
3 讨 论
诱变处理通常采用化学诱变剂处理、物理诱变处理及生物诱变处理。在枯草芽胞杆菌诱变处理中,紫外诱变是最常用的诱变育种方式,NTG 诱变剂也较常用。但两种或多种诱变剂先后使用比单一诱变剂效果要好[9]。王瑞霞等[10]以枯草芽胞杆菌 B-903为出发菌株,利用 NTG 和微波联合诱变处理,菌株的抑菌能力比出发菌株提高21.8%。卢燕回等[11]先用紫外线诱变,再用亚硝基胍诱变,得到抗菌活性提高了80%的枯草芽胞杆菌菌株B1。袁晖等[12]用链霉素和利福平结合紫外诱变筛选到高产他克莫司的菌株,产量提高82.6%。本试验先用紫外线诱变,再用亚硝基胍诱变,得到抗菌活性提高 84.62%和40.38%的突变菌株,菌株产抗菌物质的产量明显增强,说明该方法是一种针对枯草芽胞杆菌诱变的有效方法,且经过多次传代后,稳定性良好。
孔建等[13]在研究枯草芽胞杆菌 B-903 菌株所产的抗菌物质的理化特性时,证明在强酸(pH 2~3)条件下,可使有效物质从溶液中沉淀分离出来。王雅[14]经盐酸沉淀、甲醇萃取枯草芽胞杆菌菌株 Bv10 胞外抗菌物质,得到抗菌活性较高的粗提物。别小妹等[15]发现乙醇、正丁醇和时间对枯草芽胞杆菌抗菌物质的提取总量有显著的正相关,pH 有显著的负相关。本文也对抗菌物质的提取做了初步研究,发现该菌株所产的抗菌物质是一种胞外抗菌物质。影响其提取的因素较多,但最主要的因素为pH、发酵时间、提取时间。
[1] 赵鹏超,王建华,权春善,等.枯草芽胞杆菌抗菌肽生物合成的研究进展[J].中国生物工程杂志,2010,30(10):108-113.
[2] 彭研,陈蕾蕾,裘纪莹,等.产广谱抗菌物质芽孢杆菌的筛选与鉴定[J].中国农学通报,2013,29(36):372-377.
[3] Muhammad Nauman Aftab, Ikram-ul-Haq, Shahjahan Baig. Systematic Mutagenesis Method for Enhanced Production of Bacitracin byBacillusLicheniformisMutant Strain UV-MN-HN-6 [J]. Brazilian Journal of Microbiology,2012,43(1):78-88.
[4] Josefa M. Rangel,Phyllis H. Sparling,Collen Crowe,et al.Epidemiology ofEscherichiacoliO157∶H7 Outbreaks, United States,1982-2002[J].Emerging Infectious Diseases,2005,11(4):603-609.
[5] S.A. Burt,R.D. Reinders.Antibacterial Activity of Selected Plant Essential Oils AgainstEscherichiacoliO157∶H7 [J]. Letters in Applied Microbiology,2003,36(3):162-167.
[6] 徐尚荣.大肠杆菌 O157∶H7 的生物学特性[J].青海畜牧兽医杂志,2008,38(4):56-58.
[7] 常翠贤,梁海秋,杨辉,等.亚硝基胍、紫外诱变筛选高产纤溶酶菌株[J].现代食品科技,2005,21(2):32-34.
[8] 房耀维,王淑军,刘姝,等.西沙群岛海域海洋放线菌的分离及其抗菌活性[J].微生物学杂志,2014,34(4):47-52.
[9] 杨森,王金水,杨小佳,等.枯草芽胞杆菌诱变育种研究进展[J].农产品加工(学刊),2014,3:76-78.
[10]王瑞霞,刘红彦,刘玉霞,等.枯草芽胞杆菌B-903菌株的诱变选育[J].微生物学通报,2005,(5): 10-13.
[11]卢燕回,黎起秦,林纬,等.西瓜枯萎病生防菌枯草芽胞杆菌B11菌株高产拮抗物质的诱变选育[J].广西农业生物科学,2006,25(4):300-304.
[12]袁晖,张新宜,王欣荣. 抗性突变他克莫司高产菌株的选育[J]. 微生物学杂志,2014,34(5):81-86.
[13]孔建,王文夕,赵白鸽,等.枯草芽胞杆菌 B-903 菌株的研究 п 抗菌物质的理化特性[J]. 中国生物防治,2000,16(1):12-14.
[14]王雅.枯草芽胞杆菌菌株Bv10胞外抗菌物质的纯化及其特性测定[D]. 南宁:广西大学,2013.
[15]别小妹,陆兆新. 影响枯草芽胞杆菌 fmbR 菌株抗菌物质提取的主要因子[J].南京农业大学学报,2005,28(4):126-129.
Breeding ofB.s. 2012 and Antibiotic Substance Extraction that Efficiently Inhibit O157∶H7
SHI Hui1, XIAO Chang1, DU Xiao-feng1, XIANG Xing-jie1, ZHANG Jun-hong2
(1.SchoolofFoodandBiotechnology,Wuhan430205;2.Horticultre&ForestrySciences,Wuhan430070)
B.subtilis2012 was mutagenized to increase the production of antibiotic substances, and extracted its antimicrobial substances. TheB.s.2012 in mid-logarithmic growing period was mutagenized cooperatively treated with NTG and UV, and screened the strains with increased production on a bio-identifying plate with sensitive microbes. The good and bad of the extracted antibiotics were compared using the extraction with ethyl acetate method, 80% ethanol and methanol method. And optimized the methanol method with orthogonal experiment. The results showed that diameter of the inhibition zone of mutant strainsB.s.2012-21 andB.s. 2012-28 increased by 84.62% and 40.38% respectively as compared with the original strain. The extraction rate by methanol method was the highest. The results of orthogonal experiment showed that, when pH at 2.0, the fermentation time was 36 h and treated at 4 ℃, the recovery rate of antibiotics was the highest. This study obtained a mutant strainB.s.2012-21 with antibiotic substance production increased by big margin and methanol method to extract the antibacterial substances was the best method at the highest extraction rate.
Bacillussubtilis2012;antibacterial substances;UV mutation;NTG mutation;extraction
武汉设计工程学院(原华中农业大学楚天学院)重点科研基金项目(K201403)
石慧 女,硕士,副教授。研究方向为应用微生物学。E-mail:ann.black@163.com
* 通讯作者。男,教授,博士生导师。研究方向为蔬菜采后卫生及保鲜等方向的研究。 E-mail:zhangjunhng@mail.hzau.edu.cn
2015-05-19;
2015-06-13
Q939.92
A
1005-7021(2016)02-0039-06
10.3969/j.issn.1005-7021.2016.02.007

