短小芽胞杆菌HLK8-1的分离鉴定及抑菌特性分析
赵彩春, 陈国明, 张家学
(广东海大集团股份有限公司,广东 广州 511400)
短小芽胞杆菌HLK8-1的分离鉴定及抑菌特性分析
赵彩春, 陈国明, 张家学
(广东海大集团股份有限公司,广东 广州 511400)
从海南翁田镇凡纳滨对虾(Litopenaeusvannamei)养殖场筛选获得1株能抑制副溶血弧菌(Vibrioparahaemolyticus)等多种病原菌的芽胞杆菌HLK8-1。经形态特征分析、16S rDNA序列分析及Biolog微生物自动鉴定系统鉴定为短小芽胞杆菌(Bacilluspumilus);菌株生长及抑菌性能研究表明该菌株抑菌物质主要产生在生长对数期及平台期;相对于盐度及初始pH等因素,该菌株的抑菌性能受温度影响较大;菌株在pH值范围为7.0~8.5,盐度范围为0~0.2%,温度为30 ℃等条件下表现出较高的生长水平及抑菌性能;共培养试验表明该菌能将水体中的副溶血弧菌数量控制在较低水平,培养24 h时实验组105cfu/mL,而对照组108cfu/mL。该菌抑制多种水产病原菌,对水体环境耐受能力强,具有防治水产养殖病原菌的应用潜力,且易于培养,抑菌物质分泌到胞外便于分离提取,亦具有发酵工程应用潜力。
短小芽胞杆菌;副溶血弧菌;16S rDNA;抑菌活性
近年来,弧菌病害频发,严重制约了水产养殖业的发展[1]。自 2009 年以来, 凡纳滨对虾(Litopenaeusvannamei)急性肝胰腺坏死综合征 (acute hepato-pancreas necrosis syndrome, AHPNS)或早期死亡综合征 (early mortality syndrome, EMS)在亚洲地区暴发并蔓延, 造成养殖对虾大量死亡[2]。EMS致病原因于2013年5月被确定为特定类型的副溶血弧菌感染,并将此病改名为急性肝胰腺坏死病(acute hepato-pancreas necrosis disease, AHPND)[3]。副溶血弧菌是一种广泛分布于自然海区的条件性致病菌,是对虾中一种常见重要的病原菌,也可引起人和鱼、蟹、贝等水产养殖动物感染发病[4-5]。添加抗生素是目前治疗细菌疾病的主要手段,但长期使用会产生病原菌的耐药性及药物残留,危及人类健康[6]。鉴于此,以微生态制剂为代表的生防技术已成为水产科研工作者的研究热点。芽胞杆菌是目前应用最广泛的水产微生态制剂菌种之一,其在生长代谢过程中能分泌抑菌物质,这些抑菌物质大多为低分子抗生素以及蛋白或多肽类化合物[7],可以帮助降低环境中病原菌数量,减少养殖动物病害危险。而且这些物质具有无毒、无残留、无污染、抗菌性强、稳定性好等自身优势[8-9]。目前报道的生防类芽胞杆菌主要是陆源的及用在陆生动植物病害防治方面[10],而用于防治水产动物病害的研究相对较少[11]。本研究报道了1株筛选自凡纳滨对虾养殖场、能抑制副溶血弧菌等多种水产病原菌的芽胞杆菌,对菌株进行菌种鉴定,并对其生长特性及抑菌物质分泌特性进行了初步分析。
1 材料与方法
1.1 材料
1.1.1 试验菌株 菌株HLK8-1分离自海南翁田对虾养殖场水体。病原指示菌副溶血弧菌(Vibrioparahaemolyticus)、哈氏弧菌(Vibrioharveyi)、 嗜 水 气 单 胞 菌(Aeromonashydrophila)均购自广东微生物菌种保藏中心。
1.1.2 培养基 ①菌株保存用营养琼脂(NA)斜面(g/L):蛋白胨10.0,牛肉粉3.0,氯化钠5.0,琼脂15.0,pH (7.3±0.1);②抑菌活性测定用补充添加5 g/L 氯化钠的胰蛋白大豆琼脂(TSA)(g/L):胰蛋白胨15.0,大豆蛋白胨5.0,氯化钠10.0,琼脂15.0,pH (7.3±0.2);③发酵培养用胰蛋白大豆肉汤培养基(TSB),购自美国BD;④副溶血弧菌活菌计数用TCBS培养基,购自广东环凯。
1.2 方法
1.2.1 菌株的筛选与分离 取养虾塘水体,80 ℃水浴处理15 min后稀释涂布TSA平板,30 ℃培养18~24 h,通过点种法初步筛选出有显著抑菌效果的菌落[12]。将初筛得到的菌落反复划线纯化,接种至TSB培养液中摇床培养18~24 h,取菌液1 000 r/min离心10 min收集上清液;通过平板扩散法[13],30 ℃恒温培养24 h,测量抑菌圈直径(本文所有试验均取2 mL菌液离心取上清,打孔器孔径为6 mm,加液量为30 μL/孔),复筛出目标菌株。
1.2.2 菌株的鉴定 ①菌株培养特征:将菌株划线至TSA平板上,30 ℃培养18~24 h,观察菌落形态,并进行革兰染色,镜检观察菌体形态特征。②细菌生理生化鉴定:将培养18 h的HLK8-1菌株,用无菌接种棒接种于空管中,加入GN/GP-IF-A接种液制备成悬液,比浊调节至浊度(28±3)%,加入到NP微孔板中,加液量为100 μL/孔,30 ℃培养16~24 h,在Biolog GEN III上读结果[14]。③分子生物学鉴定:将菌株HLK8-1在TSB液体培养基中培养48 h,收集菌体,用细菌DNA提取试剂盒提取细菌总DNA。根据细菌16S rDNA基因保守序列引物:F1:5′-AGA GTT TGA TCC TGG CTC- 3′,反R1:5′-AAG GAG GTG ATC CAG CCG CA-3′进行PCR扩增。扩增条件: 94 ℃预变性3 min;94 ℃ 45 s,50 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃延伸7 min,PCR产物用10 g/L的琼脂糖凝胶电泳检测。PCR产物经纯化后,直接在ABI PRISMTM 377全自动DNA测序仪上进行测序。所测序列与GenBank中序列进行Blast比对,并从中选取部分相关的16S rDNA序列,采用ClustalX1.8软件进行多序列匹配排列,用Mega 5.0采用邻位相连法(Neighbor-Joining)进行系统发育树,通过自举分析(Bootstrap)进行置信度检测,自举数集1 000次。
1.2.3 细菌生长及抑菌性能分析 探索细菌生长及抑菌活性相关规律以及温度、盐度、pH等因素对细菌生长和抑菌物质分泌的影响。通过检测菌液浓度A600及抑菌圈直径来分析菌株生长情况及抑菌物质分泌情况。
1.2.4 高温及紫外线处理对细菌分泌到胞外的抑菌物质活性的影响 取18~24 h的菌株培养液,10 000 r/min高速离心15 min,取上清液,分别进行高温处理、紫外照射处理,以副溶血弧菌为指示菌,初步判断这些处理对细菌抑菌物质活性的影响。
1.2.5 菌株与副溶血弧菌共培养试验 将TSB中培养18~24 h的HLK8-1菌液和副溶血弧菌菌液分别至调节A600一致,用生理盐水再将HLK8-1菌液稀释100倍备用。取2组250 mL锥形瓶,每瓶装有经高压灭菌过的养殖池塘水(补充NaCl至盐度为10‰)100 mL,实验组同时接种备用的副溶血弧菌液及HLK8-1菌液各0.5 mL,对照组只接种副溶血弧菌菌液0.5 mL,30 ℃、180 r/min摇床培养,分别在0、24、36、48 h取样稀释涂布于TCBS平板上30 ℃恒温培养24 h记录副溶血弧菌数量。
2 结果与分析
2.1 菌株HLK8-1的抑菌特性
经过初筛、复筛分离筛选到HLK8-1,其发酵上清对副溶血弧菌、哈氏弧菌、嗜水气单胞菌都具有明显的抑制作用(表1)。
2.2 细菌鉴定
2.2.1 培养特征鉴定 TSA平板上培养24 h,菌落圆形,边缘整齐,无光泽,乳白色或乳黄色,不透
明,有些菌落表面有同心圆轮纹微皱,有些菌落无轮纹;培养48 h,菌落表面褶皱加深,无光泽。革兰染色镜检显示菌体短杆状,两端钝圆,革兰阳性。
表1 菌株HLK8-1菌液上清液对不同病原菌的抑菌活性
Table 1 Inhibition activities of HLK8-1supernatant on different pathogens strains
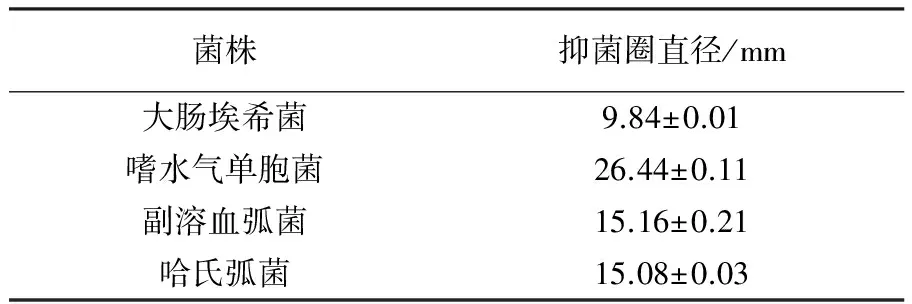
菌株抑菌圈直径/mm大肠埃希菌9.84±0.01嗜水气单胞菌26.44±0.11副溶血弧菌15.16±0.21哈氏弧菌15.08±0.03
2.2.2 生理生化鉴定 Biolog 微生物鉴定系统方法根据菌株对碳源利用情况作出分析[7],鉴定结果判定菌株HLK8-1为短小芽胞杆菌Bacilluspumilus。PROB 值为1,SIM值为0.764,DIST值为3.999,表明该鉴定结果是一个比较可靠的匹配结果,即菌株HLK8-1为短小芽胞杆菌(图1)。

图1 菌株HLK8-1 Biolog 生理生化鉴定结果
HLK8-1生理生化试验结果显示,菌株M.R试验阴性,过氧化氢酶试验阳性,不产淀粉酶产酪蛋白酶,产纤维素酶等(表2)。
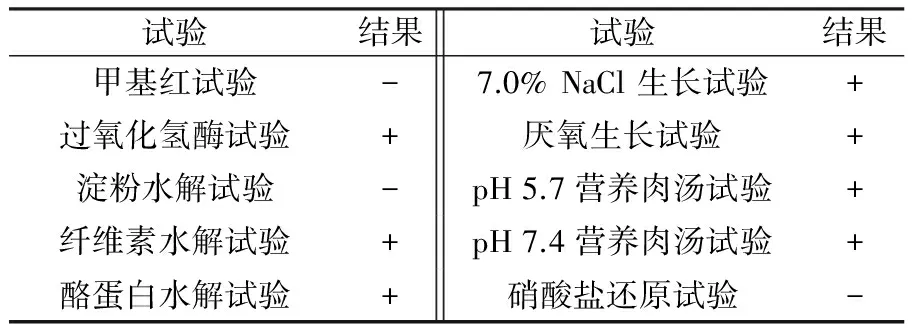
表2 菌株HLK8-1生理生化特性
注:“+”表示阳性;“-”表示阴性
2.2.3 分子生物学鉴定 菌株16S rDNA扩增图见图2。在1 500 bp左右处显示出一条特异性条带,与目标条带大小相符。

图2 菌株HLK8-1 16S rDNA扩增片段琼脂糖凝胶电泳Fig.2 16S rDNA fragment of HLK8-1 by agarose gel electrophoresisM:Marker V;1:HLK8-1菌株16S rDNA扩增片段M:Marker V;1:16S rDNA fragment of HLK8-1
将扩增得到的基因片段回收测序,得到的序列用Blast(http://www.ncbi.nlm.nih.gov/balst)在GenBank中搜索比对结果显示,该16S rDNA序列与短小芽胞杆菌Bacilluspumilusstrain B14的序列同源性为99.8%。以16S rDNA为基础的HLK8-1系统发育树分析结果显示,HLK8-1与短小芽胞杆菌Bacilluspumilus在同一分枝上,可靠度为100%(图3)。
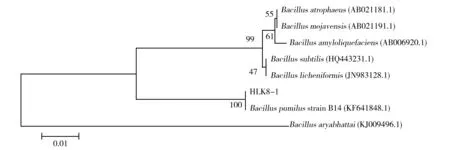
图3 基于16S rDNA 序列分析的HLK8-1系统发育树
2.3 菌株生长及抑菌性能分析
2.3.1 菌株生长与抑菌物质分泌之间的关系 细菌HLK8-1菌体生长随培养时间呈现出基本微生物生长曲线规律,4 h以前细菌处于适应期,4~36 h处于对数生长期,菌体分裂快,菌液浓度迅速增长,36~56 h处于平台期,菌液A600值基本处于稳定,56 h后细菌开始进入衰败期,菌液浓度逐渐减小(图4)。
HLK8-1上清液抑菌活性显示,在培养4 h时菌液上清液即显示出抑菌效果,说明4 h即有抑菌物质分泌到外界环境中,随后4~28 h抑菌性能缓慢增强,28~56 h抑菌物质分泌基本不再增加趋于稳定,56 h后抑菌活性开始显著减弱(图4)。菌株的抑菌物质分泌曲线与细菌生长曲线基本保持一致,菌株的抑菌性能主要产生在生长对数期及平台期。
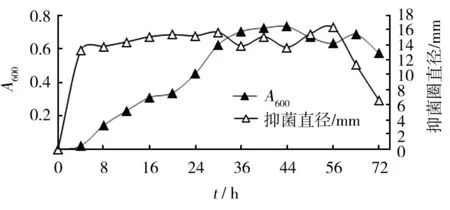
图4 培养时间对HLK8-1生长及抑菌物质分泌影响Fig.4 Effects of incubation time on growth and antibacterial substances production of HLK8-1
2.3.2 pH条件对菌株生长及抑菌物质分泌的影响 试验结果显示,HLK8-1在pH 5.5~9.5范围内能良好生长,培养24 h菌液稀释10倍后A600值均在0.6以上,说明HLK8-1菌株对酸碱环境良好的耐受性。pH偏酸性时,菌液浓度明显低于中性及碱性条件下菌液浓度,pH 7.5~9.5菌液浓度均处于较高水平,HLK8-1菌株可能更喜好偏碱性环境,最适生长酸碱环境在pH 7.0~9.0之间。从菌株抑菌物质产生规律来看,不同pH条件下HLK8-1菌株分泌的抑菌物质活性并无显著差异,抑菌圈直径大小无显著差异(图5)。
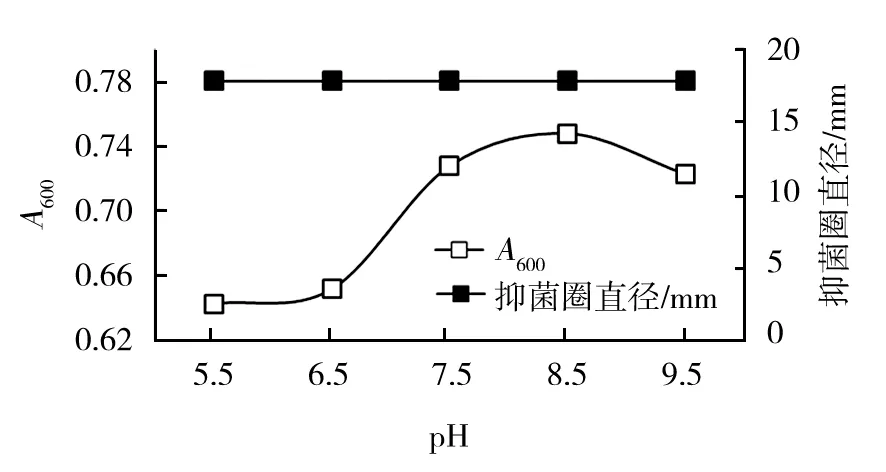
图5 pH 条件对菌株生长及抑菌物质分泌的影响
Fig.5 Effects of pH on growth and antibacterial substances production of HLK8-1
2.3.3 温度条件对菌株生长及抑菌物质分泌影响 菌株HLK8-1在10 ℃不能生长,15 ℃可以生长,并且50 ℃高温环境也可生长,但是50 ℃培养时上清液几乎无抑菌特性,说明高温条件下菌株虽然能维持生命繁殖,但抑菌物质分泌受到抑制,30 ℃是该菌株生长及抑菌物质产生的最佳温度(图6)。
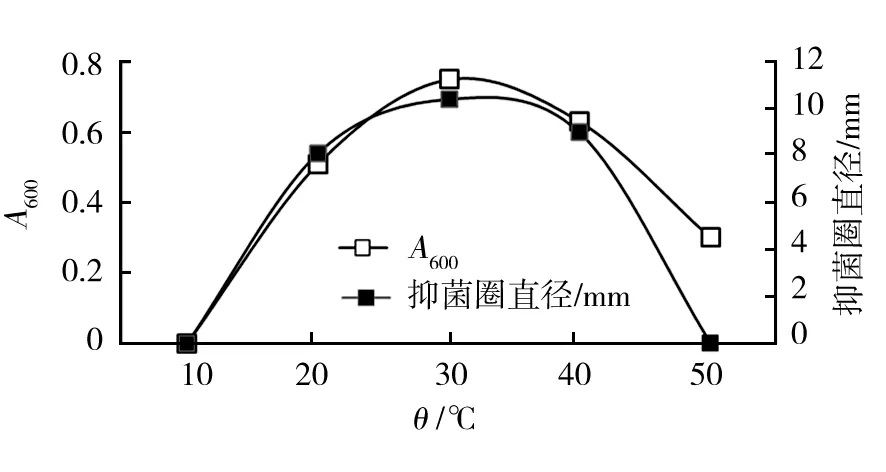
图6 温度对菌株HLK8-1生长及抑菌物质分泌的影响Fig.6 Effects of temperature on growth and antibacterial substances production of HLK8-1
2.3.4 盐度对菌株生长及抑菌物质分泌的影响 菌株HLK8-1能耐受70‰以内盐度环境,菌株生长良好,培养24 h后的菌液稀释10倍后A600值可达0.4以上,但是各盐度条件下菌液上清液抑菌圈直径却基本稳定在约10 mm((10.48±0.89) mm)(图7)。说明在一定范围内盐度变化对菌株HLK8-1抑菌物质活性无显著影响。
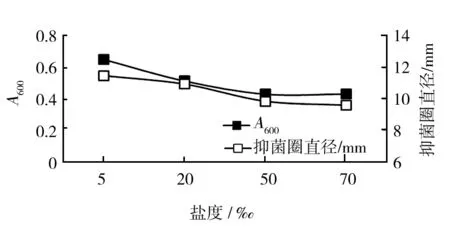
图7 盐度对菌株HLK8-1生长及抑菌物质分泌的影响
Fig.7 Effects of salinity on growth and antibacterial substances production of HLK8-1
2.4 高温及紫外线对菌株抑菌物质活性的影响
2.4.1 高温对抑菌物质活性影响 发酵液上清通过高温水浴处理后检测抑菌效果,结果表明高温处理对上清液抑菌活性有明显影响,80 ℃处理5 min后的上清液没有显示抑菌圈,100 ℃处理10 min后的上清液也没有显示抑菌圈。说明HLK8-1菌株产生的抑菌物质不耐高温处理(表3)。
2.4.2 紫外照射对抑菌物质活性的影响 经过紫外灯(PHILIPS G8T5 TUV8W)距离30 cm照射1 h的发酵液上清抑菌圈直径显著减小(对照组15.44 mm, 紫外照射后9.71 mm),表明抑菌物质对紫外线敏感(表3)。
表3 外界因子对菌株HLK8-1上清液抑菌活性影响结果表
Table 3 Effects of factors on inhibition activities of HLK8-1Bacterial supernatant

对照组紫外线照射1h80℃,10min100℃,5min抑菌圈直径/mm15.44±0.159.71±0.2400
2.5 菌株HLK8-1与副溶血弧菌共培养实验结果
从共培养实验结果来看,对照组中病原菌迅速增长,24 h活菌量积累到108cfu/mL水平,但实验组病原菌数量一直处于相对较低水平(最高仅达到105cfu/mL),连续培养48 h,实验组副溶血弧菌水平均显著低于对照组(图8)。表明菌株HLK8-1在养殖水体中能显著抑制副溶血弧菌数量,使之处于相对较低水平。
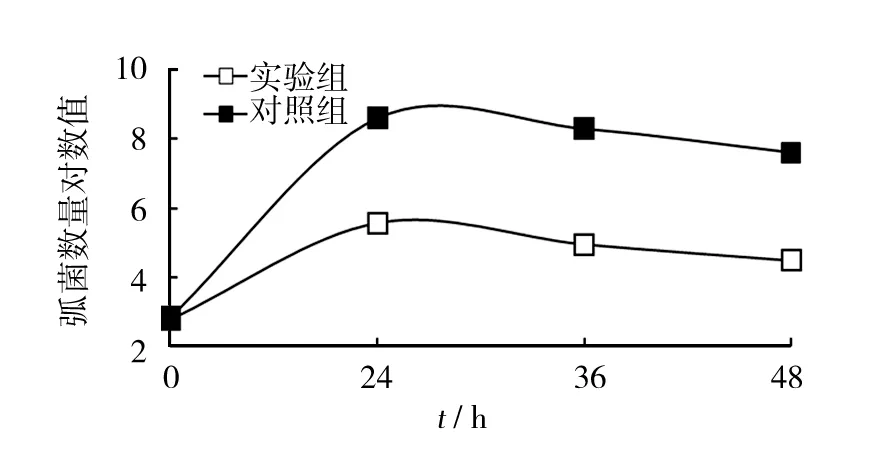
图8 菌株HLK8-1与副溶血弧菌共培养时副溶血弧菌数量的变化情况Fig.8 HLK8-1 inhibit the number of Vibrio parahaemolyticus in pond water
3 讨 论
定期检测弧菌,控制养殖过程中副溶血弧菌数量无疑是预防和控制AHPND的有效途径之一。水产养殖中抗菌药物的长期使用或滥用所引起的致病菌耐药性、高残留和环境污染问题日益严重[15],而绿色、安全的益生菌微生态预防治疗解决方式更受养殖户青睐。从养殖环境中健康动物体内获取拮抗菌是公认的提倡方法[16]。本试验从凡纳滨对虾养殖场分离筛选到1株对副溶血弧菌有良好抗性的芽胞杆菌HLK8-1,经16S rDNA序列分析与Biolog全自动微生物鉴定仪及其他生理生化分析最终鉴定为短小芽胞杆菌(Bacilluspumilus)。
一般来说,细菌产生抗菌物质的含量与其生长条件密切相关[23]。菌株HLK8-1对环境适应性强,对盐度、温度、pH均具有广泛适应性,表现出较高的生长性能及抑菌性能,表明该菌株对环境要求简单。在灭菌池塘水中共培养结果显示菌株能显著抑制副溶血弧菌数量使其处于相对较低的水平。研究还发现HLK8-1具有产蛋白酶、产纤维素酶能力,这些特性功能使其具有水产养殖益生菌的应用潜力。另外,由于菌株的抑菌物质能分泌到胞外,分离简单,适合扩大培养,因此可开展发酵工艺优化的研究,为发酵工程奠定基础,为更合理高效利用菌株优势提供更多数据支持。
[1] Gatesoupe F. The use of probiotics in aquaculture[J]. Aquaculture, 1999, 180(1/2): 147-165.
[2] Flegel TW. Historic emergence, impact and current status of shrimp pathogens in Asia[J].Journal of invertebrate pathology, 2012, 110: 166-173.
[3] Tran L, Nunan L, Redman RM, et al.Determination of the infectious nature of the agent of acute hepatopancreaticnecrosissyndrome affecting penaeid shrimp[J]. Diseases of Aquatic Organisms, 2013, 105:45-55.
[4] 龚斌, 潘育胜, 张艳秋, 等. 泛纳宾对虾细菌性病原的分离鉴定和耐药性研究[J]. 微生物学杂志, 2014, 34(5): 70-74.
[5] 葛红星, 李健, 陈萍, 等. 亚硝酸盐氮胁迫下凡纳滨对虾对副溶血弧菌的易感性[J]. 中国水产科学, 2004, 21(3): 629-636.
[6] 张珂, 丁翠玲. 一株海洋拮抗菌的分离鉴定及其培养特性研究[J]. 海洋湖沼通报, 2011,(2): 79-85.
[7] 权春善, 王军华, 徐洪涛, 等. 一株抗真菌解淀粉芽胞杆菌的分离鉴定及发酵条件的初步研究[J]. 微生物学报, 2006, 46(1): 7-12.
[8] 付天玺, 魏开建, 许国焕. 芽胞杆菌在水产养殖中的研究和应用概况[J].水利渔业, 2007,(3):102-104.
[9] 王晓丽, 朱小翠, 王永仙, 等. 八株芽胞杆菌的分离鉴定及其抗逆性比较[J].中国兽医科学, 2010,40(10): 1017-1022.
[10]Melentev AI, Aktuganov GE, Galimzyanova NF. The role of chitinase in the antifungal activity ofBacillussp.739 [J].Microbiology, 2001,70(5): 548-552.
[11]韦露, 陈偿, 龙云映, 等. 一株短小芽胞杆菌B1的筛选鉴定及其抗菌特性研究[J]. 水产科学, 2015, 34(3): 161-168.
[12]王娟, 封永辉, 蔡立胜, 等. 来自大黄鱼(Pseudosciaenacrocea)肠道的弧菌拮抗菌的筛选与鉴定[J].海洋与湖沼, 2010,(5): 707-713.
[13]赵阳国, 任南琪, 程玉鹏. 一株芽胞杆菌的分类鉴定及其抑菌产物特性[J].微生物学杂志, 2006, 26(6): 1-6.
[14]李运, 盛慧, 赵荣华, 等. Biolog微生物鉴定系统在菌种鉴定中的应用[J].酿酒科技, 2005, 7: 84-85.
[15]苏振霞, 肖辉, 陈列欢. 3种抗生素对3种常见鱼类病原菌的抑菌活性研究[J].中国预防兽医学报, 2011, 33(6): 483-486.
[16]Watson AK, Kaspar H, Lategan MJ, et al. Probiotics in aquaculture: the need, principles and mechanisms of action and screening processes [J]. Aquaculture, 2008, 274(1): 1-14.
[17]Balcaázar JL, Rojas-Luna T, Cunningham DP. Effect of the addition of four potential probiotic strains on the survival of pacific white shrimp (Litopenaeusvannamei) following immersion challenge withVibrioparahaemolyticus[J]. Journal of Invertebrate Pathology, 2007, 96: 147-150.
[19]徐长安, 罗秀针, 俞超超. 海洋源生防细菌LHB02的筛选、鉴定及其抑菌普检测[J]. 海洋与湖沼, 2011,42(2): 284-288.
[20]王娟, 封永辉, 张庆华. 短小芽胞杆菌X93 及胞外产物对病原弧菌抑制效果的研究[J]. 阜阳师范学院报, 2013, 30(1):31-35.
[21]张新明, 李健, 刘淇. 弧菌拮抗菌的筛选及其效果[J]. 中国水产科学, 2004, 11(4): 325-332.
[22]刘全永, 杨铭, 王书锦. 海洋分离芽胞杆菌抗白念珠菌活性物质的理化性质及类别[J].微生物学杂志, 2015, 35(1): 19-23.
[23]莫照兰, 俞勇, 李会荣, 等. 弧菌拮抗菌的筛选[J].青岛海洋大学学报, 2001, 31(2): 225-231.
Isolation, Identification & Antagonistic Characteristics ofBacilluspumilusHLK8-1
ZHAO Cai-chun, CHEN Guo-ming, ZHANG Jia-xue
(GuangdongHaidGroupCo.,Ltd,Guangzhou511400)
A bacterial strain HLK8-1 with inhibition ability against a wide variety of pathogens includingVibrioparahaemolyticuswas isolated from a prawn (Litopenaeusvannamei) farm pond in the town of Wengtian, Hainan Province. It was identified asBacilluspumilusby its morphological features, 16S rDNA sequence analysis, and through Biolog Microbes Identification system; Growth and antimicrobial performance study indicated that the strain secreted antimicrobial substances mainly in the logarithmic growth phase and plateau phase; The antimicrobial activity was relatively more affected by temperature rather than salinity and pH; The optimum culture conditions for high levels of growth and inhibition were at 30 ℃, pH 7.0~8.5, salinity 0~0.2%; Co-culture tests in pond water showed that the strain inhibited againstV.parahaemolyticusat fairly low level, when experimental group of the strain at 105cfu/mL along with control group 108cfu/mL cultured for 24 h. The strain can inhibit many aquatic pathogens and had tolerance to the aquacultural water environment, indicating its potential applications in aquaculture pathogen prevention; easy to culture and easy to obtain antimicrobial substance, indicating its potential applications in fermentation engineering.
Bacilluspumilus;Vibrioparahaemolyticus; 16S rDNA; inhibiton activity
赵彩春 女,硕士,工程师。研究方向为水产养殖病害控制。E-mail:zhaocaichun@163.com
2015-04-21;
2015-05-26
Q939.124
A
1005-7021(2016)02-0033-06
10.3969/j.issn.1005-7021.2016.02.006

